
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
1.2. Хімічна рівновага
В оборотній реакції
mA + nB ⇄ pC + qD
закономірно змінюються як концентрації відвовідних реагентів, так і швидкості протилежних реакцій. Специфікою стану рівноваги оборотних процесів є сталість концентрацій усіх речовин за сталості зовнішніх умов. Такі сталі концентрації наз. рівноважними, вони характеризують склад системи, коли хімічна взаємодія відбувається в обох напрямах з однаковою швидкістю – це стан динамічної рівноваги.
Умови хімічної рівноваги:
термодинамічна ΔG = 0, тобто ΔH = TΔS. Зв’язок енергії Гіббса з константою рівноваги виражається рівнянням
ΔG = - 2,3 RT lgKT, або ΔG = - 5,69 lg K298 за стандартних умов. Процес відбувається мимовільно (ΔG < 0), коли Крівн > 1. Якщо ΔG < 0, рівновага зміщена в напрямі прямої реакції, а якщо ΔG > 0, то у бік зворотньої реакції;
кінетична, коли швидкості двох супряжених реакцій рівні
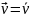 ,
для оборотного хімічного процесу
поданого термохімічним рівнянням mA
+ nB ⇄
pC +
qD,
,
для оборотного хімічного процесу
поданого термохімічним рівнянням mA
+ nB ⇄
pC +
qD,
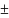 ΔH.
ΔH.
1.3. Константа хімічної рівноваги
За умови, що , отримаємо вираз кількісної характеристики стану хімічної рівноваги, яка визначається законом діючих мас:

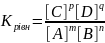 - константа хімічної
рівноваги
- константа хімічної
рівноваги
При сталій темепературі константа хімічної рівноваги оборотної реакції є сталою величиною, що показує співвідношення між концентраціями продуктів реакції (чисельник) і вихідних речовин (знаменник). яке встановлюється при рівновазі.
Для газуватих систем константа рівноваги виражається також через рівноважний парціальний тиск:
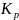 =
=
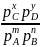
тут: рА, рВ, рС, рD - рівноважні парціальні тиски всіх газуватих компонентів системи.
Взаємозв’язок між Крівн та Кр встановлюється через рівняння стану ідеального газу Меделєєва – Клапейрона:
Кр = Крівн∙(RT)Δn
тут: Δn – різниця між числом молів газуватих продуктів реакції та газуватих вихідних речовин.
В гетерогенних процесах концентрації твердих речовин залишаються незмінними, оскільки залежать від поверхні, такі концентрації до виразу константи рівноваги гетерогенної реакції не записують.
Приклад 1.3.1. Для гетерогенної реакції
Fe2O3(тв) + 3H2(г) ⇄ 2Fe(тв) + 3H2O(г)
константа
рівноваги записується як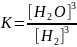 .
.
Для процесів, що відбуваються ступінчасто, загальна константа рівноваги розраховується як добуток констант рівновагі для кожного із ступенів: Кзагальна = К1∙К2∙К3...∙Кn
Приклад 1.3.2. Визначити константу рівноваги реакції А + 2В ⇄ С, якщо рівноважні концентрації: [А] = 0,3 моль/л; [В] = 1,1 моль/л;
[С] = 2,1 моль/л.
Розв’язок. Записуємо рівняння реакції і вихідні дані:
А + 2В ⇄ С
[ рівн ], моль/л 0,3 1,1 2,1
n, моль 1 2 1
Виконуємо
розрахунок: Крівн
=
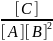 =
=
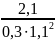 = 5,79.
= 5,79.
Приклад 1.3.3. Визначити константу рівноваги реакції (25 0С)
2NO2 ⇄ N2O4
Розв’язок. За термодинамічним критерієм:
ΔG = - 2,3 RT lgKT, або ΔG = - 5,69 lg K298 за стандартних умов. Температура Т = 298 0К. Для розрахунку зміни енергії Гіббса використовуємо довідкові дані:
ΔGх.р. = ΔG0298(N2O4) - 2ΔG0298(NO2) = (1∙98,3 - 2∙51,8) = - 5,3 кДж/моль
Розраховуємо константу рівноваги:
lgKрівн = - ΔGх.р/5,69 = -(-5,3/5,69) = 0,9316; К = 8,52
