
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
6.7. Пероксид гідрогену
В молекулі пероксиду гідрогену атоми оксигену з’єднані неполярним ковалентним зв’язком
H→O – O←H
неполярний
ковалентний
зв’язок
тому являють собою єдиний структурний елемент, який можна умовно розглядати як йон
-1 -1
[О – О] або [О2]2-,
коли кожний атом оксигену знаходиться у проміжному ступені окиснення ( див. табл. 10)
Приклад 6.7.1. Скласти рівняння ОВР, в яких пероксид гідрогену виявляє властивості а) окисника; б) відновника. Наведіть пояснення стосовно участі середовища у реакціях.
Розв’язок. Для відповіді використовуємо наведену схему.
а) Н2О2 як окисник приєднує електрони і перетворюється на оксид-йони (О2-), які не можуть самостійно існувати у розчинах, взаємодіють з елементами середовища, утворюючи Н2О чи . Приклад:
-1 -2 +6 -2
4H2O2 + H2S = H2SO4 + 4H2O
тут: Н2О2 + 2 + 2Н+ → 2Н2О – відновлення окисника у кислотному середовищі.
б) Н2О2 як відновник відщеплює електрони і перетворюється на молекулярний кисень (О20) у будь-якому середовищі. Приклад:
-1 +7 +4 0
3H2O2 + 2KMnO4 = 2MnO2 + 3O2 + 2KOH +2H2O
Таблиця 10
Схема окиснення та відновлення Н2О2 |
|
як відновник |
як окисник |
-1
О0 О20 2 молекула оксид-йони кисню О0
← О
-1
|
|
Окиснення: [О2]2- - 2 → О20 (2
В кислотному та нейтральному середовищі
-1 Н2О2 - 2 → О20 + 2Н+
В лужному середовищі:
-1 Н2О2 - 2 + 2 → О20 + 2Н2О |
Відновлення: [О2]2-
+ 2
→ 2 (2
В кислотному середовищі:
-1 -2 Н2О2 + 2 + 2Н+ → 2Н2О
В нейтральному та лужному середовищі:
-1 -2 Н2О2 + 2 → 2О
|
Приклад 6.7.2. Виявом ОВ-двоїстості є реакція диспропорціонування пероксиду гідрогену. Складіть рівняння ОВР методом електронного балансу.
Розв’язок. Визначаємо продукти, ступені окиснення і складаємо схему реакції:
-1 -2 0
Н2О2 → Н2О + О2
Складаємо електронні рівняння і визначаємо основні коефіцієнти:
О 22- + 2 → 2О 2- 2 1 відновлення
О22- - 2 → О20 2 1 окиснення
Остаточне рівняння ОВР:
2Н2О2 = 2Н2О + О2
Схема диспропорціонування:
О 2- О0
відновлення (+ ) окиснення (- )
Задачі та вправи
80. Складіть електронні схеми і напишіть рівняння таких реакцій:
а) H2O2 + J2 → HJO3 + H2O
б) H2O2 + HJO3 → J2 + O2 + H2O
в) HClO + H2O2 → HCl + O2 + H2O
г) H2O2 + PbS → PbSO4 + H2O
д) KJ + H2O2 → J2 + KOH

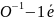 ← О
→
← О
→

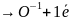
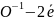 → 2О0)
→ 2О0)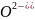
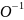 + 2
→ 2
)
+ 2
→ 2
)