
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
7.4. Гальванічний елемент
Процеси окиснення – відновлення є спряженими, тому:
їх неможливо поділити у часі;
але можна поділити у просторі;
при цьому виникає потік електронів, який можна спрямувати від відновника до окисника по зовнішньому провіднику;
такий спрямований потік електронів – це електричний струм, який виконує електричну роботу;
для виникнення е.р.с. необхідно замкнути внутрішній електричний ланцюг.
Гальванічний елемент – пристрій, що складається з двох електрохімічних електродів, у якому енергія хімічної реакції безпосередньо перетворюється на електричну енергію.
Гальванічні елементи, акумулятори, паливні елементи складають групу хімічних джерел електричного струму. Для їх створення придатні тільки ОВ-процеси, в яких відбувається перехід електронів.
Дві головні функції гальванічного елемента:
вимірювання електродних потенціалів;
джерело електричної енергії.
Зовнішній ланцюг
↑ →
↓


( ) Відновник Окисник ( )
(анод) (катод)
Окиснення Відновлення
← Йони
(розчин електроліту)
Внутрішній ланцюг
Мал. 2. Схема гальванічного елемента
→ 2 →
Зовнішній ланцюг
(-) Zn0│Zn2+ Cu2+│Cu0 (+)
Е0Zn Е0Cu
Внутрішній ланцюг
Анод Катод
Окиснення Відновлення
Мал. 3. Графічна схема елемента Якобі – Даніеля
(мідно-цинковий гальванічний елемент)
Напрямок довільного протікання процесу визначається електродним складом гальванічного елемента. Найбільш відомим є мідно-цинковий гальванічний елемент або елемент Якобі – Даніеля ( див. мал. 3).
В такому елементі сполучені два металічних електроди:
цинковий Zn│ZnSO4, Е0 = - 0,76 В;
мідний Cu│CuSO4, Е0 = + 0,34 В.
Виходячи з того, що електрод з більшим значенням Е0 завжди окиснює електрод з меншим значенням Е0, отримаємо:
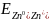 <
<
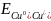
відновник окисник
окиснення відновлення
Zn0 - 2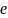 = Zn2+
Cu2+ +
2
= Cu0
= Zn2+
Cu2+ +
2
= Cu0
Формула гальванічного елемента:
(-) Zn│ZnSO4║CuSO4│Cu (+)
↑ ↑
межа поділу фаз межа поділу фаз
в електроді в електроді
просторовий поділ
електрохімічних систем
Запис у йоній формі: (-) Zn0│Zn2+║Cu2+│Cu0
В такому елементі завжди окиснюється більш активний метал, Ме0 (в ряду напруг розташований ліворуч) – це анод; йон менш активного металу, Ме n+ ( в ряду напруг розташований праворуч) – відновлюється з розчину – це катод.
Хімічні рівняння процесу виконують за правилами методу напівреакцій:
А (-) Zn0 - 2 = Zn2+ 2 1 окиснення анода
K(+) Cu2+ + 2 = Cu0 2 1 відновлення на катоді
Zn0 + Cu2+ = Zn2+ + Cu0
Остаточне молекулярне рівняння:
Zn + CuSO4 = ZnSO4 + Cu
Різниця електродних потенціалів спричиняє виникнення е.р.с., яку розраховують, виходячи з практичного правила: від більшої величини електродного потенціалу завжди віднімають меншу величину електродного потенціалу, тобто
∆ Е0 = Е0катодa - Е0анодa = Е0окисника - Е0відновника,
алгебраїчна
сума потенціалів має бути додатною
(∆Е0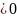 )
для виконання критерію визначення
напряму протікання ОВР: ∆G
= - nF∆Е0.
)
для виконання критерію визначення
напряму протікання ОВР: ∆G
= - nF∆Е0.
Саме це визначає факт, що струм у хімічних джерелах є постійним.
Окремий випадок – це вимірювання нормальних електродних потенціалів. Стандартним електродом порівняння є водневий електрод, якій складає спряжену пару:
Н20│2Н+ або Н2│Н2SO4,
стандартний потенціал водневого електроду умовно вважають рівним нулю. Схема гальванічного елемента для вимірювання стандартних електродних потенціалів металів:
Me0│Ме n+║2H+│H20
Приклад 7.4.1. Скласти схему гальванічного елемента для вимірювання стандартного електродного потенціалу феруму. Написати рівняння процесів, що відбуваються і розрахувати е.р.с. такого пристрою.
Розв’язок. Один з електродів у такому гальванічному елементі обов’язково – водневий електрод. Складаємо схеми електродів:
а) водневий
електрод: H2│1
M H2SO4;
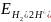 =
0,00 B
=
0,00 B
б) залізний
електрод: Fe0│FeSO4;
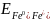 = - 0,44 B.
= - 0,44 B.
Відпоповідно до критеріїв наведених вище, визначаємо, що залізний електрод – це анод, а водневий електрод - катод. Складаємо схему гальванічного елемента:
(-)Fe0│ FeSO4 ║1 M H2SO4│ H2 (+).
Записуємо за методом напівреакцій рівняння ОВР:
А (-) Fe0 – 2 = Fe2+ 2 1 окиснення
К(+)
2Н+
+
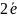 = H02
2 1 відновлення
= H02
2 1 відновлення
Fe0 + 2Н+ = Fe2+ + H02
SO42- SO42-
Сумарне рівняння ОВР: Fe0 + H2SO4 = FeSO4 + H02
Обчислюємо е.р.с.:
∆ Е0 = - = 0,00 – (- 0,44) = + 0,44 В.
Приклад 7.4.2. Складіть схему гальванічного елемента, у якому магнієва і цинкова пластинки занурені у розчини їх іонів з концентрацією 1 моль/л. Який з металів є анодом, який катодом? Напишіть рівняння окисно-відновної реакції, що протікає у гальванічному елементі і розрахуйте його е.р.с.
Розв’язок. Схема гальванічного елемента
(-) Mg│ Mg2+ ║ Zn2+│Zn (+)
Вертикальна риска позначає поверхню поділу між металом і розчином, а дві вертикальні риски – межу поділу двох рідких фаз – пористу перегородку (або електролітичний ключ). У магнію менший потенціал
(-2,37 В) і він є анодом, на якому відбувається процес окиснення:
Mg
- 2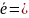 Mg2+
Mg2+
Цинк, потенціал якого -0,763 В, - катод, тобто електрод, на якому відбувається процесс відновлення:
Zn2+ + 2 = Zn
Рівняння окисно-відновної реакції, яка характеризує роботу такого гальванічного елемента, можна отримати, склавши електронні рівняння анодного і катодного процесів:
Mg + Zn2+ = Mg2+ + Zn.
Для розрахунку електрорушійної сили – е.р.с. гальванічного елемента від потенціалу катода віднімають потенціал анода.
Концентрації іонів у розчині становлять 1 моль/л, це означає, що е.р.с елемента дорівнює різниці стандартних потенціалів двох його електродів:
e.p.c. =
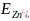 -
-
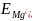 = - 0,763 – (-2,37) = 1,607 B.
= - 0,763 – (-2,37) = 1,607 B.
Приклад 7.4.3. Розрахувати е.р.с. срібно – кадмієвого гальванічного елемента, в якому концентрації йонів Ag+ i Cd2+ відповідно складають 0,1 та 0,005 моль/л.
Розв’язок. Записуємо рівняння Нернста для гетерогенних систем:
E = E0 + lgC,
Величина стандартних потенціалів електродів:
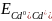 = - 0,40 B
= - 0,40 B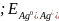 =
+ 0,8 B
=
+ 0,8 B
Розраховуємо потенціали електродів відповідно до умов задачі:
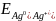 = 0,8 +
lg 0,1
= 0,8 +
lg 0,1
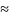 0,74 B - катод
0,74 B - катод
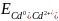 = - 0,40 +
lg 5∙10 -3
= - 0,40 +
lg 5∙10 -3
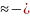 0,47 B - анод
0,47 B - анод
Обчислюємо е.р.с.
∆Е = 0,74 – (- 0,47) = 1,21 В.
