
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
1.4. Розрахунки концентрацій рівноважних систем
Позначення концентрацій:
СА – початкова (вихідна) концентрація речовини,
[А] – рівноважна концентрація речовин,
ΔСА – витрачена концентрація реагенту від початку реакції до стану рівноваги.
При протіканні реакції у прямому напрямі до стану рівноваги відбувається зменшення концентрацій газуватих реагентів і збільшення концентрації газуватих продуктів, що визначається за законом збереження маси:
для реагентів ΔСА = СА - [А], ΔСВ = СВ - [В]
для продуктів ΔСС = СС + [С] = 0 + [С] = [С],
ΔСD = CD + [D] = 0 + [D] = [D].
У відповідності до стехіометрії реакції отримаємо:
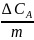 =
=
 =
=
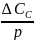 =
=
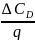
Розрахунок ΔСА і ΔСВ пов’язаний із стехіометрією реакції і визначеною рівноважною концентрацією одного з продуктів реакції, наприклад [D]:
при утворенні q молів речовини D витрачається m молів речовини А, а утворення [D], моль/л, супроводжується витратою ΔСА:
ΔСА = (m[D])/q
Розрахункові рівноважні концентрації можна використати у виразах для констант рівноваги:
Крівн
=
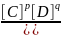
Приклад 1.4.1. Визначити рівноважні концентрації гідрогену та йоду, якщо відомо, що початкові їх концентрації дорівнюють по 0,02 моль/л, а рівноважна концентрація HJ – 0,03 моль/л. Розрахуйте константу рівноваги.
Розв’язок. З рівняння хімічної реакції
H2 + J2 ⇄ 2HJ
випливає,
що Δ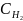 =
Δ
=
Δ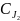 =
[HJ]/2 = 0,03:2 = 0,015 моль/л.
=
[HJ]/2 = 0,03:2 = 0,015 моль/л.
Рівноважні концентрації реагентів:
[H2]
=
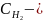 Δ
=
0,02 – 0,015 = 0,005 моль/л
Δ
=
0,02 – 0,015 = 0,005 моль/л
[J2] = - Δ = 0,02 – 0,015 = 0,005 моль/л
Розраховуємо
константу рівноваги: Крівн
=
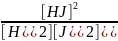 =
=
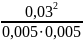 = 36
= 36
Приклад 1.4.2. В системі СО + Cl2 ⇄ COCl2 рівноважні концентрації речовин [Cl2] = 0,3 моль/л; [CO] = 0,2 моль/л; [COCl2] = 1,2 моль/л. Визначити константу рівноваги системи і початкові концентрації хлору та оксиду карбону(ІІ).
Розв’язок. а) Визначаємо константу рівноваги:
Крівн
=
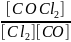 =
=
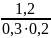 = 20
= 20
б) Визначаємо витрачені концентрації реагентів:
стехіометрія
реакції 1: 1 : 1, отже, Δ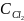 = Δ
= Δ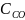 = [COCl2]
= 1,2 моль/л
= [COCl2]
= 1,2 моль/л
в) Визначаємо початкові концентрації реагентів:
= Δ + [Cl2] = 1,2 + 0,3 = 1,5 моль/л
= Δ + [CO] = 1,2 + 0,2 = 1,4 моль/л
Приклад 1.4.4. Константа рівноваги системи H2 + J2 ⇄ 2HJ за певної температури дорівнює 50. Визначити рівноважні концентрації речовин, якщо початкові концентрації H2 та J2 становлять по 1 моль/л.
Розв’язок. Припускаємо, що для досягнення рівноваги витратилось по х молів Н2 та J2, отже, рівноважні концентрації [H2] та [J2] становлять по (1 – х) молів, а рівноважна концентрація [HJ] = 2х молів.
Записуємо закон діючих мас:
Крівн
=
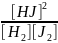 =
=
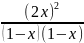 = 50; х
= 0,78
= 50; х
= 0,78
Рівноважні концентрації [H2] = [J2] = 0,22 моль/л, а [HJ] = 1,56 моль/л.
Задачі та вправи
1. Записати вирази для констант рівноваги для:
а) гомогенних реакцій б) гетерогенних реакцій
2H2 + O2 ⇄ 2H2O C + CO2 ⇄ 2CO
2CO + O2 ⇄ 2CO2 3Fe + 4H2O ⇄ Fe3O4 + 4H2
2NO2 ⇄ 2NO + O2 C + 2H2 ⇄ CH4
2. Запишіть вирази для константи рівноваги реакції А + В ⇄ С, якщо
а) А, В, С – газуваті речовини; рідини, що необмежено змішуються між собою, або речовини, які знаходяться у розчині; б) А – тверда речовина, а В та С – речовини, які знаходяться у розчині; в) А та С – газуваті речовини, а В – тверда речовина.
3. За температури 650 0С константа рівноваги системи
СО2(г) + Н2(г) ⇄ СО(г) + Н2О(г) дорівнює 1. В початковий момент часу концентрації СО2 та Н2 становили відповідно 0,2 і 0,8 моль/л. Визначити рівноважні концентрації усіх речовин.
4. Вихідні концентрації SO2 та О2 в системі 2SO2 + O2 ⇄ 2SO3 відповідно дорівнювали 0,03 і 0.015 моль/л. На момент досягнення рівноваги концентрація SO2 становить 0,01 моль/л. Визначити рівноважні концентрації інших реагуючих речовин.
5. Вихідні концентрації оксиду нітрогену (ІІ) та хлору в системі
2NO + Cl2 ⇄ 2NOCl дорівнюють відповідно 0,5 моль/л і 0,2 моль/л.
Розрахуйте константу рівноваги, якщо на момент досягнення рівноваги прореагувало 20% оксиду нітрогену(ІІ).
6. Реакційна система CO + Cl2 ⇄ COCl2 має об’єм 10 л. Склад рівноважної суміші 14 г СО; 35,5 г Cl2; 49,5 г COCl2. Розрахувати константу рівноваги.
7. При деякій температурі рівновага гомогенної системи
2NO + O2 ⇆ 2NO2 встановилася при таких концентраціях реагуючих речовин [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = 0,1 моль/л.
Розрахуйте константу рівноваги і вихідну концентрацію NO і О2.
8. Напишіть вираз для константи рівноваги гомогенної системи
N2 + 3H2 ⇆ 2NH3. Як зміниться швидкість прямої реакції при збільшенні концентрації гідрогену у три рази?
9. Напишіть вираз для константи рівноваги гомогенної системи
СН4 + СО2 ⇆ 2СО + 2Н2. Як необхідно змінити тиск і температуру для того, щоб збільшити вихід гідрогену? Реакція ендотермічна.
10. Вихідні концентрації NO і Cl2 у гомогенній системі
2NO + Cl2 ⇆ 2NOCl становлять відповідно 0,5 і 0,2 моль/л. Розрахуйте константу рівноваги, якщо на момент досягнення стану рівноваги прореагувало 20% NO.
11. Напишіть вираз для константи рівноваги гетерогенної системи
С + Н2О(г) ⇆ СО + Н2. Як необхідно змінити концентрацію і тиск для зміщення рівноваги у напрямку зворотної реакції – утворення водяної пари?
12. Для реакції (600 0К) 2SO3 ⇄ 2SO2 + O2 ΔG = 82,1 кДж/моль.
Розрахуйте константу реакції.
13. Яким буде значення при 25 0С константи рівноваги оборотної реакції, для якої величина ΔG0298 дорівнює: а) 5,714 кДж/моль; б) – 5,714 кДж/моль?
14. При 873 0К константа рівноваги Крівн реакції CO + Cl2 ⇄COCl2 дорівнює 12,12. Визначити Кр реакції при такій температурі.
