
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
5.6. Необоротний гідроліз
Утворення під час гідролізу:
важкорозчинних сполук;
слабкодисоційованих сполук;
хімічно нестійких сполук
спричиняє цілковите руйнування складу вихідної солі, найчастіше необоротно гідролізуються солі утворені слабкими багатоосновними кислотами та багатокислотнимииосновами, типовим для них є утворення нерозчинних гідроксидів і слабких кислот.
Приклад 5.6.1. Гідроліз сульфіду хрому (ІІІ):
Cr2S3 + 6H2O → 3H2S↑ + 2Cr(OH)3↓
Всі утворені продукти - леткий H2S та слабкорозчинний Cr(OH)3 - виводяться із зони реакції. В такому випадку написати йонні рівняння гідролізу неможливо.
Приклад 5.6.2. Гідроліз карбонату алюмінію:
3H2O
Al2(CO3)3 + 6H2O → 2Al(OH)3 + 3H2CO3
3CO2↑
Скорочуємо на 3H2O і отримаємо остаточне рівняння:
Al2(CO3)3 + 3H2O → 2Al(OH)3 + СО2↑
Утворюються: нерозчинний Al(OH)3 та хімічно нестійка H2CO3, яка розкладається.
Приклад 5.6.3. Складіть рівняння процесів, що відбуваються при при змішуванні розчинів NH4Cl та Na2SiO3.
Розв’язок. Хлорид амонію NH4Cl гідролізується до слабкої основи NH4ОН; силікат натрію гідролізується до слабкорозчинної силікатної кислоти Н2SiO3. Складаємо молекулярне рівняння гідролізу:
2NH4Cl + Na2SiO3 + 2H2O → 2NH4ОН + Н2SiO3↓ + 2NaCl
Записуємо йонно-молекулярне рівняння:
2 NH4+ + 2Cl- + 2Na+ + SiO32- + 2H2O →
→ 2NH4ОН + Н2SiO3↓ + 2Na+ + 2Cl-
Виключаємо однакові йони і записуємо скорочене йонне рівняння спільного гідролізу:
2NH4+ + SiO32- + 2H2O → 2NH4ОН + Н2SiO3↓
Силікатна кислота утворює осад, а гідроксид амонію залишається у розчині, середовище – слабколужне.
Приклад 5.6.4. Складіть рівняння процесів, що відбуваються при при змішуванні розчинів CrCl3 та Na2S.
Розв’язок. Для розв’язування задачі використаємо методику наведену у таблиці 8. Виконаємо уявний поділ процесів на ряд окремих ступенів.
Складаємо молекулярне рівняння обмінної реакції без урахування гідролізу:
2CrCl3 + 3Na2S = Cr2S3 + 6NaCl
гідролізується не гідролізується
Записуємо молекулярне рівняння необоротного гідролізу:
Cr2S3 + 6H2O → 2Cr(OH)3↓ + 3H2S↑
Складаємо підсумкове молекулярне рівняння:
2 CrCl3 + 3Na2S = Cr2S3 + 6NaCl
C r2S3 + 6H2O → 2Cr(OH)3↓ + 3H2S↑
2CrCl3 + 3Na2S + 6H2O = 2Cr(OH)3↓ + 3H2S↑ + 6NaCl
Записуємо йонно-молекулярне рівняння:
2Cr3+ + 6Cl- + 6Na+ + 3S2- + 6H2O = 2Cr(OH)3↓ + 3H2S↑ + 6Na+ + 6Cl-
Виключаємо однакові йони і записуємо скорочене йонне рівняння спільного гідролізу:
2Cr3+ + 3S2- + 6H2O = 2Cr(OH)3↓ + 3H2S↑
Необоротність гідролізу спричиняється утворенням леткої і важкорозчинної сполук, які виводяться із реакції.
Задачі та вправи
52. В якому напрямі зміщена рівновага гідролізу солі слабкої основи і сильної кислоти; солі сильної основи і слабкої кислоти? Наведіть обгрунтовану відповідь.
53. Якими чинниками визначається ступінь зміщення рівноваги дисоціацію води при розчинні в ній солі, що гідролізується?
54. Не складаючи хімічних рівнянь, визначити, які з наведених солей гідролізуються: а) Na2CO3; б) NaBr; в) K2CO3; г) CuSO4; д) KNO3.
55. Розташуйте у порядку зростання cхильності до гідролізу солі: HCOOK; KCN; KNO2; КСlО.
56. Для якої солі буде більшим рН розчину: NaNO3 чи NaNO2; СН3СООК чи СН3СООNH4?
57. Визначити реакцію розчинів наведених солей: KJ; AlCl3; K2S; ZnSO4; NaCN; NaNO3 і скласти відповідні йонні рівняння реакцій.
57. При змішуванні розчинів Сr(NO3)3 та К2СО3 утворюється осад Cr(OH)3. Поясніть причину і складіть відповідні молекулярні та йонні рівняння реакцій.
58. Напишіть іонно-молекулярне і молекулярне рівняння спільного гідролізу, що відбувається при змішуванні розчинів FeCl3 і K2SO3 . Кожна сіль гідролізується необоротно до кінця.
59. Розташуйте у порядку зростання cхильності до гідролізу солі: HCOOK; KCN; KNO2; КСlО.
60. Для якої солі рН розчину буде більшим: NaNO3 чи NaNO2; СН3СООК чи СН3СООNH4?
61.
Яке значення рН (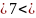 мають розчини солей MnCl2,
Na2 SO3,
Ni(NO3)2?
Складіть іонно-молекулярні і молекулярні
рівняння гідролізу відповідних солей.
мають розчини солей MnCl2,
Na2 SO3,
Ni(NO3)2?
Складіть іонно-молекулярні і молекулярні
рівняння гідролізу відповідних солей.
