
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
1.5. Порушення хімічної рівноваги
Перехід рівноважної хімічної системи від одного стану рівноваги до іншого наз. зміщенням (зрушенням) хімічної рівноваги, яке здійснюється зміною термодинамічних параметрів – температури, концентрації, тиску. Відбувається зміна концентрацій, спричинена порушенням рівноваги і новий стан хімічної рівноваги відрізняється від попереднього стану іншим співвідношенням рівноважних концентрацій усіх компонентів системи.
При зміщенні рівноваги:
у прямому напрямі (вправо) збільшується концентрація продуктів:
mA + nB ⇄ pC + qD
у зворотному напрямі (вліво) збільшується концентрація реагентів:
mA + nB ⇄ pC + qD
Кінетика рівноважного процесу залежить від співвідношення між зовнішніми та внутрішніми факторами системи:
зовнішні фактори: темепература, тиск і об’єм газуватих речовин, молярна концентрація реагентів та продуктів реакції;
внутрішні фактори: теплові ефекти (ентальпія) прямої та зворотної реакції, зміна об’ємів або числа молів газуватих речовин, зміна молярної концентрації будь-якого компоненту хімчної системи.
Напрям зміщення рівноваги визначається за результатами сумісного аналізу співвідношення зовнішніх та внутрішніх чинників і принципу Ле Шательє (принципу протидії):
якщо змінити один із зовнішніх факторів (р, Т, С), за яких система перебуває у стані хімічної рівноваги, то рівновага зміститься в напрямі тієї реакції (⇄), перебіг якої послабить ефект здійсненої зовнішньої дії.
Вплив концентрації на стан рівноваги обмежено зміною концентрації тільки тих речовин, рівноважні концентрації яких входять у вираз для константи рівноваги.
В разі збільшення коцентраціїї будь-якого компонента, що бере участь у рівновазі, рівновага зміщується у бік витрати цієї речовини; якщо концентрація будь-якого компонента зменшується, то рівновага зміщується у бік утворення такої речовини.
Для гомогенних реакцій у відповідності до принципу Ле Шательє додавання надлишку певного реагенту приводить до зміщення рівноваги у прямому, а додавання надлишку певного продукту – у зворотному напрямі, чим послаблюється ефект зовнішньої дії на систему:
надлишок реагенту (А або В) (→)
надлишок продукту (С або D) (←)
Для гетерогенних реакції додавання надлишкової кількості рідкої чи твердої речовини (реагенту або продукту) не впливає на стан рівноваги.
Наявність каталізаторів на стан рівноваги не впливає тому, що пряма і зворотна реакція прискорюються в однаковому ступені.
Приклад 1.5.1. Для гетерогенної реакції
Cu2O(тв) + 2HCl(г) ⇄ 2CuCl2(р) + H2O(г)
додавання у систему надлишку хлориду гідрогену зміщує рівновагу у прямому нарямі (вправо), а введення надлишку твердого оксиду купруму (І) на стан рівноваги не впливає.
Вплив температури на стан рівноваги відмінний для ендотермічних (ΔН > 0) та екзотермічних (ΔН < 0) реакцій.
При підвищенні температури рівновага зміщується у напрямі ендотермічної реакції, а при зниженні – у напрямі екзотермічної реакції.
У відповідності до приципу протидії зміна температури зміщує напрям таких реакцій (позначено стрілкою), чим зменшує ефект зовнішньої дії на рівноважну систему:
підвищення
температури (нагрівання)
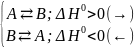
зниження
температури (охолодження)
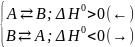
Приклад 1.5.2. Синтез аміаку – екзотермічний процес:
N2 + 3H2 ⇄ 2NH3 ; ΔН = - 92,4 кДж (←),
тому підвищення температури в системі Н2 – N2 – NH3 зміщує рівновагу вліво, відбувається розкладання аміаку, оскільки саме цей процес відбувається з поглинанням теплоти. Навпаки, синтез оксиду нітроге-ну (ІІ) – ендотермічний процес:
N2
+ O2
⇄
2NO ; ΔН
= + 180,5кДж (→)
тому при підвищенні температури в системі N2 – O2 – NO рівновага зміщується вправо – в бік утворення продукту.
Вплив тиску (за допомогою збільшення або зменшення об’єму системи) виявляється тільки при наявності в системі газуватих речовин.
В разі збільшення тиску рівновага зміщується у бік зменшення числа молекул газів, тобто у бік зменшення тиску; якщо тиск зменшується, то рівновага зміщується у бік зростання числа молекул газів, тобто у бік збільшення тиску.
У тому випадку, коли реакція вібувається без зміни числа молекул, рівновага не порушується під час будь-якої зміни тиску.
У відповідності до принципу Ле Шательє зростання тиску зміщує рівновагу у напрямі тієї реакції, яка супроводжується зменшенням об’єму газуватих речовин, а зменшення тиску – діє у протилежному напрямі. Оскільки об’єм газуватих реагентів і продуктів є пропорційним сумі стехіометричних коефіцієнтів (позначеній як Σnреаг і Σnпрод), то зміни тиску у гомогенних системах викликають зміщення рівновагиу напрямі, що зменшує вплив зовнішньої дії:
збільшення
тиску
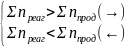
зменшення
тиску
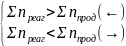
зміна тиску не впливає Σnреаг = Σnпрод (↔)
Для гетерогенних реакцій стехіометричні коефіцієнти при формулах рідких і твердих речовин до уваги не беруть.
Приклад 1.5.3. Зміщення рівноваги при збільшенні тиску в реакціях:
а) гомогенна реакція 2CO2(г) + 2H2O(г) + 2HCl(г) ⇄ 2CH3Cl(г) + 3O2(г)
Сума
стехіометричних 2 + 2 + 2 = 6 > 2 + 3 = 5
коефіцієнтів
р
З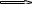 міщення
рівноваги 6
2
міщення
рівноваги 6
2
б) гетерогенна реакція 2N2O(г) + S(тв) ⇄ 2H2(г) + SO2(г)
Сума
стехіометричних 2 < 2 + 1 =3
коефіцієнтів
р
З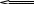 міщення
рівноваги 2
3
міщення
рівноваги 2
3
в) гетерогенна реакція N2(г) + H2(г) + 2C(тв)⇄ 2HCN(г)
Сума
стехіометричних 1 + 1 = 2 = 2
коефіцієнтів
р
З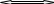 міщення
рівноваги
міщення
рівноваги
Не зміщується
Приклад 1.5.4. В якому напрямі зміститься рівновага в системі
N2 + 3H2 ⇄ 2NH3 ; ΔН = - 46, 9 кДж
а) при збільшенні концентрації H2; б) при зменшенні концентрації N2; в) при підвищенні темеператури; г) зменшенні тиску?
Розв'язок. а) Збільшення концентрації речовини, що записана у лівій частині рівняння, відповідно до принципу Ле Шательє, викликає процесс зміщення рівноваги вправо, що зменшує ефект зовнішньої дії ,
тобто приводить до зменшення концентрації гідрогену (→).
б) У відповідності з принципом протидії, зменшення концентрації речовини, що записана у лівій частині рівняння, викликає процесс, який приводить до збільшення концентрації такої речовини, тобто відбувається зміщення рівноваги вліво (←).
в) Підвищення темеператури сприяє перебігу ендотермічної реакції і в процесі синтезу аміаку спричинить зміщення рівноваги у зворотному напрямі (←). Реакція розкладання аміаку є ендотермічною.
г) Збільшення тиску викликає процес, що приводить до зменшення об’єму реакційної суміші. Відповідно до зміни суми стехіометричних коєфіцієнтів рівновага зміститься вправо 1 + 3 = 4 → 2.
Приклад 1.5.5. Яким діями в системі
2SO2(г) + O2(г) ⇄ 2SO3(г); ΔН < 0
можна досягти збільшення виходу SO3, якщо концентрація SO2 залишається сталою?
Розв’язок. Згідно з приципом Ле Шательє це досягається:
а) збільшенням концентрації О2; б) зменшенням концентрації SO3;
в) зниженням температури; г) збільшенням тиску.
Задачі та вправи
15. В якому напрямі зміститься рівновага системи H2(г) + S(тв) ⇄ H2S(г)
якщо: а) збільшити концентрацію гідрогену; б) зменшити концентрацію сульфіду гідрогену?
16. В якому напрямі зміститься рівновага системи
3Fe(тв) + 4H2O(г) ⇄ Fe3O4(тв) + 4H2(г)
якщо: а) збільшити концентрацію гідрогену, б) зменшити концентрацію водяної пари?
17. Метанол утворюється в реакції
СО(г) + 2Н2(г) ⇄ СН3ОН(р); ΔН = - 127 кДж
В якому напрямі відбудеться зміщення рівноваги при підвищенні:
а) темеператури, б) тиску?
18. Як вплине на вихід хлору в системі
4HCl(г) + O2(г)⇄ 2Cl2(г) + 2H2O(р); ΔН = - 202,4 кДж:
а) підвищення температури реакціїної системи, б) зменшення загального об’єму суміші, в) зменшення концентрації оксигену, г) збільшення об’єму реактора, д) наявність каталізатора?
19. За яких умов рівновага реакції 4Fe(тв) + 3O2(г) ⇄ 2Fe2O3(тв) буде зміщуватися у бік розкладання оксиду (ΔН < 0)?
20. В якому напрямі зміститься рівновага при підвищенні темеператури в системах:
а) COCl2(г) ⇄ CO(г) + Cl2(г); ΔН = 113 кДж
б) 2CO2(г) ⇄ 2CO(г) + O2(г); ΔН = 566 кДж
в) 4HCl(г) + O2(г) ⇄ 2Cl2(г) + 2H2O(р); ΔН = - 202,4 кДж
21. В якому напрямі зміститься рівновага системи при збільшенні тиску:
а) 2NO(г) + O2(г) ⇄ 2NO2(г)
б) 4HCl(г) + O2(г) ⇄ 2Cl2(г) + 2H2O(р)
в) H2(г) + Cl2(г) ⇄ 2HCl(г)
г) СаСО3(тв) ⇄ СаО(тв) + СО2(г)
22. Запропонуйте оптимальну зміну термодинамічних параметрів Т і р з метою збільшення виходу продуктів реакції:
а) H2(г) + Br2(р) ⇄ 2HBr(г); ΔН0 < 0
б) J2(г) + 5CO2(г) ⇄ J2O5(тв) + 5CO(г); ΔН0 > 0
в) SO3(г) + NO(г) ⇄ SO2(г) + NO2(г); ΔН0 > 0
г) PCl5(г) ⇄ PCl3(г) + Cl2(г); ΔН0 > 0
д) CO2(г) + 2SO3(г) ⇄ CS2(г) + 4O2(г); ΔН0 > 0
е) 2CuO(тв) + CO2(г) + H2O(г) ⇄ Cu2CO3(OH)2(тв); ΔН0 < 0
