
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
3. Іонно-молекулярні (іонні) реакції обміну
3.1. Визначення поняття йонних реакцій
Хімічні реакції, що відбуваються у водних розчинах за участю електролітів можна відобразити молекулярними та йонними рівняннями. Електроліти у розчинах знаходяться у формі йонів, тому реакції відбуваються між йонами, тобто – це йонні реакції. Для виявляння сутності такі реакції найзручніше записувати у йонно-молекулярній формі. Сутність таких реакцій полягає у сполучанні йонів у молекули нових речовин. Найхарактернішими є реакції обміну.
3.2. Напрям протікання йонних реакцій
Такий напрям, як напрям зміщення рівноваги, визначається із загального критерію:
обмінні реакції у розчинах електролітів протікають практично до кінця у напрямі продуктів, що виводяться із зони реакції, тобто, рівновага довільно зміщується в напрямі зменшення числа йонів у розчині.
Необхідною умовою утворення молекул реальних нових речовин є дія факторів необоротності (зміщення рівноваги):
утворюється слабкорозчинна тверда речовина, осад (↓);
утворюється слабкорозчинна летка речовина (↑);
утворюються розчинні слабкі електроліти у формі:
а) молекул, б) складних та комплексних йонів;
утворюються нестійкі первинні хімічні продукти, які продовжують змінювати свій склад.
Якщо жодна з таких речовин не утворюється, то не діють фактори необоротності, отже, реакція не відбувається.
3.3. Складання рівнянь йонних реакцій
При складанні йонних рівнянь реакцій дотримуються таких правил:
необхідно виконувати закон збереження числа атомів;
необхідно виконувати закон збереження зарядів;
тільки сильні електроліти записують у формі йонів, усі інші речовини записують у формі молекул.
при визначенні напряму протікання реакції користуються таблицями розчинності, констант дисоціації, добутків розчинності.
Таблиця 2. Методика складання іонних рівнянь хімічних реакцій
Приклад 3.3.1. Складання реакції між хлоридом барію і нітратом
аргентуму у розчині.
№ пп |
Операція |
Приклад |
1 |
Написати схему реакції |
BaCl2 + AgNO3 → AgCl + Ba(NO3)2
|
2 |
Визначити силу електролітів і розчинність речовин:
а) вихідні речовини
б) продукти реакції |
Для цього використовують таблицю розчинності і константи дисоціації.
BaCl2 – розчинна сіль, сильний електроліт AgNO3 – розчинна сіль, сильний електроліт
AgCl – нерозчинна сіль Ba(NO3)2 – розчинна сіль, сильний електроліт
|
3 |
Встановити наявність чинників зміщення рівноваги (необоротності) |
AgCl - утворює осад, отже реакція відбувається
|
4 |
Написати молекулярне рівняння реакції |
BaCl2 + 2AgNO3 → 2AgCl↓ +Ba(NO3)2
|
5 |
Написати повне йонне рівняння реакції |
Вa2+
+ 2 2AgCl↓ + Вa2+ + 2
Правило: тільки сильні електроліти записують у йонній формі, а всі інші сполуки – у молекулярній формі. |
6 |
Записати скорочене йонне рівняння:
а) виключають (викреслюють) однакові йони у лівій і правій частинах повного йонного рівняння
б) записують скорочене йонне рівняння |
В a2+ + 2 + 2Ag+ + 2 → 2AgCl↓ + Вa2+ + 2
2 + 2Ag+ → 2AgCl↓ |
Примітка: запис реакції у формі скороченого іонно-молекулярного рівняння не завжди можливий, наприклад: H2O CaCO3 + H2SO4 → CaSO4↓ + H2CO3 CO2↑
CaCO3 + 2H+ + SO42- → CaSO4↓ + CO2↑ + H2O
Скорочене йонно-молекулярне рівняння відсутнє.
|
||

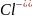 +
2Ag+
+ 2
+
2Ag+
+ 2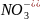 →
→