
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
6.5. Еквіваленти окисників і відновників
Якщо гідроген є окисником або відновником, то 1 моль його атомів приєднує чи відщеплює 1 моль електронів:
½Н2
→ Н+
+
 ;
½Н2
+ 1
;
½Н2
+ 1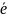 →
→
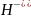
Тому фактор еквівалентності - це величина обернена до числа електронів, відщеплює або приєднує молекула відновника чи окисника:
fекв ОВР
=
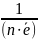 ,
,
тут:
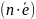 число відщеплених (приєднаних) електронів,
що припадає на одну молекулу (йон, атом).
число відщеплених (приєднаних) електронів,
що припадає на одну молекулу (йон, атом).
Отже, еквівалентна маса окисника чи відновника обчислюється, як
Еокисника
або відновника = fекв
ОВР ∙ Мокисника/відновника
=
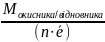
Оскільки одна й та сама сполука у різних реакціях може відщеплювати або приєднувати різне число електронів, то його еквівалентна маса буде різною.
Приклад 6.5.1. Визначити кількість речовини еквівалентів (моль) хромату калію масою 0,971 г, якщо в ОВР він перетворився на хлорид хрому (ІІІ).
Розв’язок. Визначаємо ступені окиснення хрому і записуємо схему:
+6 +3
K2CrO4 → CrCl3
Cr+6 + 3 → Cr+3 - окисник,
отже, фактор еквівалентності: fекв ОВР = ⅓. Молярна маса хромату калію дорівнює 194,2 г/моль. Еквівалентна маса:
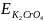 = fекв ОВР∙M
= ⅓∙194,2 = 67,733 г/моль.
= fекв ОВР∙M
= ⅓∙194,2 = 67,733 г/моль.
Кількість речовини еквівалентів:
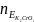 =
=
 =
=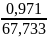 = 0,015 моль
= 0,015 моль
Задачі та вправи
71. Розрахуйте еквівалентну масу хлориду феруму (ІІ) як відновника.
72. Розрахуйте еквівалентні маси наступних окисників:
а) KClO3; б) K2Cr2O7; в) NaClO.
73. Розрахуйте еквівалентні маси таких відновників: а) K2SO3;
б) FeCO3; в) SnCl2, який перетворюється на H2[SnCl6]; г) H3PO3.
74. KMnO4 відновлюється у кислотному середовищі на сполуки, що містять йон Mn2+, у нейтральному та слабколужному середовищі – до MnO2, а у лужному середовищі – до сполуки з йоном MnO42-. Розрахуйте еквівалентну масу перманганату калію для кожного випадку. Яку кількість речовини еквівалентів у кожному випадку становить
6,32 г KMnO4?
75. Визначити нормальність 1 М розчину KNO2:
а) як відновника, якщо KNO2 окиснюється до KNO3; б) як окисника, якщо KNO2 відновлюється до NO.
6.6. Окисно – відновна двоїстстість
За виявом окисно – відновних властивостей речовини поділяють:
тільки окисники, тобто здатні тільки до відновлення із зниженням ступеня окиснення.
До них належать, наприклад, серед простих речовин – флуор,
а серед складних речовин – усі, що містять у свої структурі
йони найвищого степеня окиснення;
тільки відновники, тобто здатні тільки окиснення з підвищенням степеня окиснення.
До таких належать метали – серед простих речовин і усі складні речовини найнижчого степеня окиснення
окисники – відновники, тобто здатні виявляти обидві властивості, що залежить від умов проведення ОВР.
ОВ-двоїстість атомів хімічних елементів і простих речовин має два винятки:
метали у вільному стані (Ме0) – виявлять тільки відновлювальні властивості;
флуор – як у атомарній формі (F), так і формі простої речовини (F2) виявляє тільки окиснювальні властивості.
Усі інші неметали будуть ОВ-двоїстими, їх хімічна поведінка визначається величиною електронегативності.
Приклад 6.6.1. Написати рівняння ОВР, які доводять двоїстість властивостей сульфуру.
Розв’язок. Сульфур у вільному стані S0 поводить себе як окисник по відношенню до гідрогену та металів тому, що має більшу електронегативність:
0 0 +1 –2
H2 + S = H2S
Тут:
S0 +2 → S-2
0 0 +3 -2 окисник відновлюється
Al + S = Al2S3
по відношенню до оксигену та хлору поводить себе як відновник тому, що має меншу електронегативність:
0 0 +4 -2
S + O2 = SO2
Тут:
S0 - 4 → S+4
0 0 +4 -1 відновник окиснюється
S + 2Cl2 = SCl4
Приклад 6.6.2. Написати рівняння ОВР, які доводять двоїстість властивовостей гідрогену.
Розв’язок. Гідроген у переважній більшості випадків, а саме по відношенню до усіх неметалів, поводить себе як відновник:
0 0 -3 +1
3H2 + N2 = 2NH3
0 0 +1 -1 Тут:
H2 + Br2 = 2HBr H20 -2 → 2H+
відновник окиснюється
0 0 - 4 +1
2H2 + C = CH4
як виняток, по відношенню до лужних та лужноземельних металів виявляє себе окисником:
0 0 +1 -1
2Li + H2 = 2LiH
Тут:
H20 + 2 → 2H -1
0 0 +2 -1 окисник відновлюється
Ca + H2 = CaH2
Реакції диспропорціонування галогенів є характерними у лужному середовищі. ОВ –двоїстість виявляється у тому, що один нейтральний атом є окисником по відношенню до іншого нейтрального атому того ж галогену, який є відновником, в структурі однієї молекули.
Приклад 6.6.3. Складіть рівняння реакції диспропорціонування хлору у лужному розчині при нагріванні.
Розв’язок. При нагріванні у лужному розчині, наприклад, КОН, відбувається утворення солей хлоратної та хлоридної кислоти:
0 +5 -1
3Cl2 + 6KOH → КСlO3 + 5КСl + 3H2O
Схема диспропорціонування:
Cl-1 Cl0 Cl0 Cl+5
(+
) відновлення
окиснення (-
)
відновлення
окиснення (-
)
ОВ-двоїстість складних сполук та йонів спричиняється двома факторами:
в структурі молекули одночасно містяться іони з найнижчим і найвищим ступенем окиснення;
в структурі молекули або йона міститься атом, що знаходиться у проміжному ступені окиснення.
ОВ-двоїстість молекул, які містять одночасно йони, що знаходяться у найвищому і найнижчому ступені окиснення, визначається відмінною природою таких частин молекули.
Приклад 6.6.4. Визначить природу ОВ-двоїстості хлоридної кислоти. Складіть рівняння ОВР кислоти: а) з магнієм; б) оксидом мангану (IV). Зазначте яку фукцію: окисника чи відновника виконує хлоридна кислота у названих реакціях?
Розв’язок. Визначаємо ступені окиснення і записуємо структурну формулу:
+1 -1
HCl
окисник відновник
(найвищий ступінь (найнижчий ступінь
окиснення ) окиснення)
Отже, хлоридна кислота виявить двоїсті ОВ-властивості, які
спричинені різною електронною природою частин молекули. Додатково до уваги необхідно брати той фактор, що хлоридна кислота сильний електроліт. Рівняння дисоціації: HCl ⇆ H+ + Cl- .
а) в реакції з магнієм, який може виявити тільки відновні властивості кислота буде окисником (наявність Н+ - йона)
0 +1 +2 0
Mg + 2НСl = MgCl2 + H2
тут: 2Н+ + 2 → H20 – процес відновлення окисника (НСl).
б) в реакції з MnO2 кислота виявить властивості відновника (наявність Сl- - йона):
+4 -1 +2 0
MnO2 + 4НСl = MnCl2 + Cl2 + 2H2O
тут: 2Cl- - 2 → Cl20 – окиснення відновника (НСl).
Дві молекули НСl додатково витрачаються на зв’язування катіона мангану (+2).
ОВ – двоїстість виявляється і таких сполук чи йонів, структура яких містить атоми у проміжних ступенях окиснення. Такі структурні елементи можуть, як окиснюватись, відщеплюючи електрони, так і відновлюватись, приєднуючи електрони. В такому випадку тільки якісних ознак для визначення напряму перебігу ОВР недостатньо. Необхідно користуватися величинами стандартних ОВ-потенціалів спряжених пар. Окисником буде спряжена пара з більшою алгебраїчною величиною стандартного ОВ-потенціалу.
Приклад 6.6.5. Визначити причину ОВ-двоїстої природи нітритної кислоти та її похідних. Скласти схеми взаємодії нітритів у середовищі сульфатної кислоти: а) з перманганатом калію, б) йодидом натрію. Зазначити, які функції виконують нітрити в таких реакціях.
Розв’язок. Нітритна кислота HNO2 та нітрити містять атом нітрогену у проміжному стані, який може відновлюватися та окиснюватися:
окиснення (- )
N+5(NO3-)
(NO2-) N+3
N+2
(NO); N20;
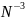 (NH3)
(NH3)
відновлення (+ )
а) в реакції з перманганатом калію нітритна кислота виявить властивості відновника:
+3 +7 +5 +2
5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O
тут: N+3 - 2 → N+5 – окиснення відновника (HNO2)
б) в реакції з йодидом натрію сіль нітритної кислоти виявить властивості окисника:
+3 -1 +2 0
2NaNO2 + 2 NaJ + 2H2SO4 = 2NO + J2 + 2Na2SO4 + 2H2O
тут: N+3 +1 → N+2 – відновлення окисника (NaNO2)
Задачі та вправи
76. Диспропорціонування хлору на холоді у лужному розчині приводить до утворення солей гіпохлоритної та хлоридної кислоти. Складіть рівняння ОВР.
77. Аміак при дії на лужні метали утворює аміди, наприклад, NH2Na,
а при взаємодії з киснем утворює оксид нітрогену (ІІ). Складіть рівняння таких ОВР і визначіть окисно-відновну функцію аміаку у кожній реакції.
78. Складіть рівняння ОВР у розчинах електронно-йонним методом:
а) HNO2 → HNO3 + NO
б) H2MnO4 → HMnO4 + MnO2
79. Складіть рівняння ОВР методом електронного балансу:
а) K2MnO4 + Cl2 → KMnO4 + КСl
б) HClO3 → ClO2 + HClO4 + H2O
в) P + H2O → H3PO3 + PH3
г) J2 + Ba(OH)2 → Ba(JO3)2 + BaJ2 + H2O
д) NaJ + NaNO2 + H2SO4 → J2 + NO + Na2SO2 + H2O
