
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
6.8. Напрям протікання овр
Можливість протікання ОВР в прямому або зворотному напрямі визначається за значеннями стандартних потенціалів Е0 напівреакцій відновлення:
Окиснена форма + n ⇆ Відновлена форма,
які вимірюють
по відношенню до стандартного водневого
електрода (рН = 0,
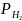 = 1∙ 105
Па)
= 1∙ 105
Па)
2Н+(р) + 2 ⇆ Н2(г),
потенціал якого умовно вважають рівним нулю.
Величина потенціалу обчислюється за рівнянням Нернста.
В гетерогенних системах окиснена і відновлена форма знаходяться у різних фазах, тому:
Е =
Е0ОВР
+
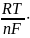 ln
Cокисн. ф.
= Е0ОВР
+
ln
Cокисн. ф.
= Е0ОВР
+
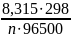 2,303∙lg Cокисн.
ф.
2,303∙lg Cокисн.
ф.
E
= Е0ОВР
+
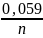 lg Cокисн.
ф.
lg Cокисн.
ф.
тут: Cокисн. ф - молярна концентрація розчиненої речовини.
В гомогенних ОВ – системах рівняння Нернста:
E
= Е0ОВР
+
lg
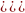
тут: n – число електронів, що приєднує одна часточка окисника;
m, q – стехіометричні коефіцієнти в рівнянні реакції.
В ОВР можуть брати участь молекули води (постійна концентрація),
а також йони Н+ та . Так для напівреакцій:
m Окисн. ф. + pН+ + n ⇆ q Відн. ф. + ½р Н2О
E
= Е0ОВР
+
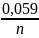 lg
= Е0ОВР
+
lg
+
lg[H+]p
lg
= Е0ОВР
+
lg
+
lg[H+]p
Отже:
якщо в реакції беруть участь Н+ чи ОН-, то їх необхідно додавати у систему для того, щоб створити необхідне рН середовища розчину;
якщо такі йони участі в реакції не беруть, то їх надлишок необхідно зв’язувати.
Стандартна енергія Гіббса для ОВР зв’язана з різницею
(Е0окисн – Е0віднов) співвідношенням:
∆G0298 = - nF(Е0окисн – Е0віднов),
тут: n – число електронів, яке переходить від відновника до окисника у відповідності до рівняння реакції; F – стала Фарадея.
Для довільних
ОВР виконується критерій ∆G0298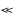 0, отже,
0, отже,
(Е0окисн
– Е0віднов)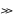 0.
0.
Такі реакції протікають в прямому напрямі; ступінь їх протікання тим вищий, чим більша різниця (Е0окисн – Е0віднов). Висновки:
окиснювальна здатність виявляється у більшому ступені у тієї речовини, яка у якості окисника в однакових умовах має біль високе число Е0;
навпаки, відновлювальна здатність тим більша, чим менше число стандартного потенціалу напівреакції, у якій певна речовина є відновленою формою (продуктом).
Тобто, напрям переходу електроні відповідає умові:
Е0окисника Е0відновника
Приклад 6.8.1. Визначити окисник та відновник для пари:
а) 2Н+ + 2 = H20 Е0 = 0,00 В
Zn2+ + 2 = Zn0 Е0 = - 0,763 В;
б) 2Н+ + 2 = H20 Е0 = 0,00 В
Cu2+ + 2 = Cu0 Е0 = + 0,338 В.
Розв’язок. Виходячи з критерію Е0окисника Е0відновника записуємо
а)
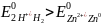 .
Отже, Н+
- окисник; Zn0
– відновник.
.
Отже, Н+
- окисник; Zn0
– відновник.
б)
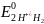 <
<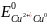 .
Отже, Cu2+
- окисник; Н20
– відновник.
.
Отже, Cu2+
- окисник; Н20
– відновник.
Приклад 6.8.2. В якому випадку відбудеться більше зміщення рівноваги у напрямі прямої реакції:
а) Cu2+ + H2 = Cu0 + 2H+ Е0окисн – Е0віднов = + 0,338 B
б) 2Fe3+ + H2 = 2Fe2+ + 2H+ Е0окисн – Е0віднов = + 0,771 B.
Розв’язок. Для відповіді на питання виконуємо розрахунок:
а) ∆G0298 = - nF(Е0окисн – Е0віднов) = - [2∙ 96500∙(+ 0,338)] =
= - 65234 кДж/моль;
б) ∆G0298 = - nF(Е0окисн – Е0віднов) = - [2∙96500∙(+ 0,771)] =
= - 148803 кДж/моль.
В обох випадках виконується вимога критерію можливості протікання реакції ∆G0298 0. Порівняння ∆G0298(а) ∆G0298(б) показує, що у реакції (б) рівновага зміщена більше.
Приклад 6.8.3. Яка з наведених речовин є сильнішим окисником у кислотному середовищі:
Mn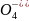 + 8H+
+ 5
= Mn2+
+ 4H2O
Е0 = + 1,531 B
+ 8H+
+ 5
= Mn2+
+ 4H2O
Е0 = + 1,531 B
MnO2 + 4H+ + 2 = Mn2+ + 2H2O Е0 = + 1,239 B ?
Розв’язок. Перманганат-йон, порівняно з оксидом мангану(ІV), буде сильнішим окисником тому, що напівреакція його відновлення характеризується більшою величиною стандартного потенціалу (+ 1,531 В).
Практично вважають, якщо:
різниця (Е0окисн – Е0віднов) + 0,4 В, то ОВР протікає до кінця (і не тільки у стандартних умовах);
різниця (Е0окисн – Е0віднов) знаходиться у межах (- 0,4)
 (+ 0,4), то в стандартних умовах реакція
відбувається у малому ступені; в такому
випадку реакцію проводять в умовах
відмінних від стандартних – беруть
великі надлишки реагентів, нагрівають
реакційну суміш тощо;
(+ 0,4), то в стандартних умовах реакція
відбувається у малому ступені; в такому
випадку реакцію проводять в умовах
відмінних від стандартних – беруть
великі надлишки реагентів, нагрівають
реакційну суміш тощо;різниця (Е0окисн – Е0віднов) < - 0,4 В, протікання реакції у прямому напрямі стає термодинамічно неможливим у будь-яких умовах.
Часто виникає необхідність визначення Е0 для певної ОВ-пари за відомими величинами Е0 інших пар, одна з яких містить окиснену форму, а інша – відновлену форму віхідної пари. Для розрахунку суммують величини Е0 проміжних пар із дотриманням законів збереження атомів та заряду.
Приклад 6.8.4. Розрахувати величину ОВ-потенціалу напівреакції:
Br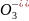 + 6H+
+ 6
=
+ 3H2O,
+ 6H+
+ 6
=
+ 3H2O,
за відомими величинами Е0 для таких напівреакцій:
Br
+ 5H+
+ 4
=
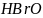 + 2H2O
Е0 = + 1,495 B
+ 2H2O
Е0 = + 1,495 B
2НВrО + 2H+ + 2 = Br2 + 2 H2O Е0 = + 1,574 B
Br2 + 2 = 2 Е0 = + 1,087 B.
Розв’язок. Складаємо діаграму Латимера
2∙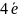 2
2
2
2
2 Br 2НВrО Br2 2
+ 1,495 + 1,574 + 1,087
12
Е0 = ?
Виконуємо розрахунок:
12Е0 = 2∙4(+ 1,495) + 2(+ 1,574) + 2(+ 1,087) = + 1,440 В.
Приклад 6.8.5. Визначити можлівість окиснення Mn2+ до Mn персульфатом калію K2S2O8.
Розв’язок. Для відповіді на питання необхідно використовувати довідкову таблицю стандартних потенціалів:
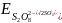
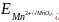 – зазначена реакція можлива.
– зазначена реакція можлива.
Приклад 6.8.6. В якому напрямі будуть протікати реакції, що виражаються такими рівняннями:
1) 2Fe3+ + 2 ⇆ 2Fe2+ + J2
2) 2Fe3+ + 2 ⇆ 2Fe2+ + Cl2
3) Cl2 + 2 ⇆ 2 + J2
Розв’язок. В таблицях стандартних ОВ-потенціалів знаходимо відповідні величини Е0 для спряжених пар:
J2/2J- Fe3+/Fe2+ Cl2/2Cl-
Е0, В 0,54 0,77 1,36
збільшення активності окисненої форми
Висновки:
1) J2 як окиснена форма системи з найменшою величиною Е0 не може окиснювати йони Fe2+ та Cl-.
2) Йони Fe3+ як окиснена форма системи з проміжною величиною Е0
можуть окиснювати йони J- не можуть окиснювати йони .
3) Сl2 як окиснена форма системи з найбільшою величиною Е0 може окиснювати йони J- та Fe2+.
Отже, в системах (1) та (3) реакції протікають у прямому напрямі, а в системі (2) – у зворотному напрямі.
У випадку рівності ОВ-потенціалів спряжених напівреакцій наступає стан рівноваги. Оскільки ∆G має зв’язок з константою рівноваги реакції, то можна записати вираз:
lg K =
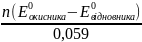
Приклад 6.8.7. Розрахувати при стандартних умовах константу рівноваги реакції:
2KBr + Cl2 = 2KCl + Br2
Розв’язок.
Cl2 + 2 = 2 E0 = 1,36 B
Br2 + 2 = 2 E0 = 1,09 B
lg
K =
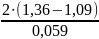 =
=
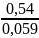 = 9,15
= 9,15
K = 1,41∙109
Приклад 6.8.8. Визначити можливість повного витиснення аргентуму з водного розчину його солі мідними ошурками.
Розвязок. Передбачення може бути зроблене за величиною константи рівноваги реакції:
lg
K =
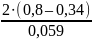 = 15,59
= 15,59
K = 3,9∙1015
Значна величина константи рівноваги дає можливість зробити висновок про те, що реакція протікає практично до кінця, отже, повне витіснення аргентуму можливе.
Задачі та вправи
81. Визначити напрям протікання реакції
6KBr + KJO3 + 3H2SO4 = 3Br2 + KJ + 3K2SO4 + 3H2O при таких концентраціях реагентів: [KBr] = 0,1 моль/л; [Br2] = 1 моль/л;
[KJ] = 0,1 моль/л; [KJO3] = 0,001 моль/л, рН = 1.
82. Наявні дві електрохімічні системи:
Cr3+ + 3 ⇆ Cr0
MnO2 + 4H+ + 2 = Mn2+ + 2H2O.
Визначити стандартну е.р.с. гальванічного елементу складеного з цих систем.
83. Визначити можливість окиснення йонів J- газуватим хлором.
84. Використайте довідкові величини Е0 і порівняйте окиснювальну активність О2, О3, Н2О2 відносно КJ (р).
85. Які окисники можна застосувати з метою здійснення процесу
Mn2+ → MnO4- : PbO2; O3; H2O2?
86. Визначити для нітритної кислоти можливість: а) окиснюватися дією КMnO4 в нейтральному та кислотному середовищі,
б) відновлюватися дією сульфітної кислоти до NO? Для можливих випадків складіть рівняння реакцій.
