
- •Часть I
- •Содержание
- •Аминокислоты
- •Ионные формы аминокислот
- •Химические свойства аминокислот
- •Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
- •Реакции аминокислот, обусловленные присутствием карбоксильных групп:
- •Реакции аминокислот, связанные с присутствием аминогрупп:
- •Методы разделения и идентификации аминокислот
- •Пептиды
- •Тема I.
- •Химические свойства аминокислот.
- •Разделение смеси аминокислот методом хроматографии на бумаге.
- •Тема II.
- •Качественные реакции на аминокислоты.
- •Реакция с формальдегидом
- •Реакция Адамкевича
- •Реакция Гопкинса-Коле
- •Качественные реакции на пептиды и белки.
- •Физико-химические свойства белков
- •Определение изоэлектрической точки белков
- •Реакции осаждения белков
- •Фракционное осаждение белков методом высаливания
- •Сложные белки
- •Гемопротеиды
- •Гемоглобин
- •Выделение гемоглобина
- •Качественная реакция на гемовую группу. Бензидиновая проба
- •Фосфопротеиды
- •Выделение казеина
- •Определение фосфорной кислоты в казеине
- •Методы количественного определения белка
- •Абсорбционная спектроскопия
- •Тема I. Методы выделения белков в гомогенном состоянии
- •Тема II. Методы количественного определения белка
- •Построение калибровочных графиков Биуретовый метод Таблица 1
- •Метод Лоури Таблица 2
- •Метод Брэдфорд Таблица 3
- •Приложение Строение и номенклатура аминокислот
- •Протеиногенные аминокислоты
- •Практикум по общей и экологической биохимии
- •Часть I
- •220009 Минск
Пептиды
Пептиды – это органические молекулы, в состав которых входит несколько аминокислотных остатков, связанных пептидной связью. В зависимости от количества остатков аминокислот и молекулярной массы различают: низкомолекулярные пептиды (состоящие из двух – десяти остатков аминокислот – ди-, три-, тетра-, пентапептиды и т. д.), пептиды со средней молекулярной массой (от 500 до 5000 дальтон, так называемые «средние молекулы») и высокомолекулярные пептиды (с молекулярной массой от 5000 до 16000 дальтон).
Качественные реакции на пептиды и белки
Биуретовая реакция позволяет обнаруживать в молекулах пептидов и белков пептидные связи. В щелочной среде белки, а также продукты их гидролиза – полипептиды – дают фиолетовое окрашивание с солями меди. Положительная биуретовая реакция проявляется у соединений, содержащих не менее двух пептидных групп (то есть у трипептидов, тетрапептидов и т.д.). Интенсивность окраски зависит от длины пептида и варьирует от сине-фиолетовой до красно-фиолетовой и красной.
Изучение механизма данной реакции показало, что с солями меди сходным образом взаимодействует биурет, который легко получается при нагревании мочевины:
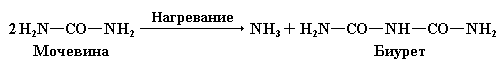
В любом случае появление окраски связано с образованием комплексного соединения – биуретового медного комплекса, который имеет следующее строение:
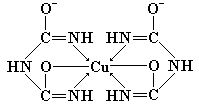
Как можно видеть из приведенной выше формулы, биурет в щелочной среде претерпевает полную енолизацию по схеме:
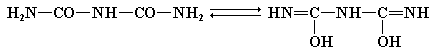
Две молекулы диенольной формы биурета взаимодействуют с гидроксидом меди (II) и образуют комплексное соединение, в котором координационные связи образованы за счет электронных пар атомов азота иминных групп. Аналогично организовано комплексное соединение меди с енолизированными пептидными группами любого другого полипептида:
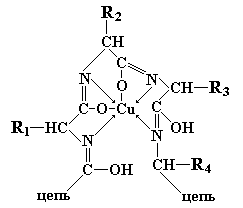
Контрольные вопросы
Принцип строения аминокислот
Классификация аминокислот
Ионные формы аминокислот. Влияние рН на заряд аминокислоты
Химические свойства аминокислот
Пептидная связь. Химический и биологический способы образования пептидных связей
Методы качественного определения аминокислот
Методы количественного определения аминокислот
Литература
Овчинников Ю.А., Биоорганическая химия, «Просвещение», М., 1987
Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, т. 1, «Мир», М., 1993
Степанов В.М., Молекулярная биология: структура и функции белков, под ред. Академика Спирина А.С., «Высшая школа», М., 1996
Кнорре Д.Г., Мызина С.Д., Биологическая химия, «Высшая школа», М., 1998
Кольман Я., Рем К.-Г., Наглядная биохимия, «Мир», М., 2000
Ход работы
Тема I.
Химические свойства аминокислот.
Реакции аминокислот в водных растворах
На универсальную индикаторную бумагу пипеткой наносят по 1 капле растворов глицина, глутаминовой или аспарагиновой кислоты и аргинина.
Отмечают развивающуюся окраску индикатора во всех трех случаях и делают заключение о реакции среды.
Записывают уравнения реакций, описывающих поведение данных аминокислот в водных растворах.
Взаимодействие аминокислот с сахарами
В две пробирки вносят по 2 мл 5% раствора фруктозы в 2.5% растворе борной кислоты.
В первую пробирку добавляют 2 мл 3% раствора аргинина, а во вторую – 2 мл дистил-лированной воды.
В третью пробирку вносят 2 мл 3% раствора аргинина и 2 мл 2.5% раствора борной кислоты.
Все три пробирки инкубируют в течение 5 мин в кипящей водяной бане.
Отмечают различие во времени появления окраски и ее интенсивности в каждой из проб.
