
- •Часть I
- •Содержание
- •Аминокислоты
- •Ионные формы аминокислот
- •Химические свойства аминокислот
- •Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
- •Реакции аминокислот, обусловленные присутствием карбоксильных групп:
- •Реакции аминокислот, связанные с присутствием аминогрупп:
- •Методы разделения и идентификации аминокислот
- •Пептиды
- •Тема I.
- •Химические свойства аминокислот.
- •Разделение смеси аминокислот методом хроматографии на бумаге.
- •Тема II.
- •Качественные реакции на аминокислоты.
- •Реакция с формальдегидом
- •Реакция Адамкевича
- •Реакция Гопкинса-Коле
- •Качественные реакции на пептиды и белки.
- •Физико-химические свойства белков
- •Определение изоэлектрической точки белков
- •Реакции осаждения белков
- •Фракционное осаждение белков методом высаливания
- •Сложные белки
- •Гемопротеиды
- •Гемоглобин
- •Выделение гемоглобина
- •Качественная реакция на гемовую группу. Бензидиновая проба
- •Фосфопротеиды
- •Выделение казеина
- •Определение фосфорной кислоты в казеине
- •Методы количественного определения белка
- •Абсорбционная спектроскопия
- •Тема I. Методы выделения белков в гомогенном состоянии
- •Тема II. Методы количественного определения белка
- •Построение калибровочных графиков Биуретовый метод Таблица 1
- •Метод Лоури Таблица 2
- •Метод Брэдфорд Таблица 3
- •Приложение Строение и номенклатура аминокислот
- •Протеиногенные аминокислоты
- •Практикум по общей и экологической биохимии
- •Часть I
- •220009 Минск
Аминокислоты
В процессах жизнедеятельности клетки
главенствующую роль играют белки –
биополимеры, построенные из мономерных
единиц – L--аминокислот.
Биологические свойства белков
определяются, в основном, их аминокислотным
составом, точнее порядком расположения
аминокислот в полипептидной цепи,
что в конечном итоге определяет
пространственную структуру белка.
Основными функциональными группами
аминокислот являются их амино- и
карбоксильные группы, которые связаны
с одним и тем же ()
углеродным атомом (рис. 1.1).
процессах жизнедеятельности клетки
главенствующую роль играют белки –
биополимеры, построенные из мономерных
единиц – L--аминокислот.
Биологические свойства белков
определяются, в основном, их аминокислотным
составом, точнее порядком расположения
аминокислот в полипептидной цепи,
что в конечном итоге определяет
пространственную структуру белка.
Основными функциональными группами
аминокислот являются их амино- и
карбоксильные группы, которые связаны
с одним и тем же ()
углеродным атомом (рис. 1.1).
Рис. 1.1 Два варианта изображения структурной формулы аминокислоты.
За исключением глицина, у которого R (см. рис. 1.1) представлен атомом водорода, у всех остальных протеиногенных аминокислот четыре группы, связанные с -углеродным атомом, различны. Благодаря тетраэдрическому расположению четырех разных заместителей у -углеродного атома, любая аминокислота (кроме глицина) обладает оптической активностью. При этом одни аминокислоты, входящие в состав белков, являются (при рН 7.0) право-вращающими, а другие – лево-вращающими. Тем не менее, вследствие того, что природные аминокислоты имеют пространственную конфигурацию L-глицеральдегида, все они относятся к L--аминокислотам.
Ионные формы аминокислот
Свободные аминокислоты включают, по крайней мере, две слабоионизованные группы: карбоксильную группу (–СОО¯ ) и аминогруппу (–NН3+). В растворе эти группы находятся в двух формах, заряженной и незаряженной, между которыми поддерживается протонное равновесие:
![]()
R–COOH и R–NH3+ являются протонированными партнерами, то есть кислотами, а R–COO¯ и R–NH2 – сопряженными основаниями (т.е. акцепторами протонов) соответствующих кислот. Следовательно, структура аминокислоты, изображенная на рис. 1.1, не может существовать в растворе, поскольку одна из указанных групп в той или иной степени ионизирована.
Вполне понятно, что суммарный заряд (алгебраическая сумма всех положительных и отрицательных зарядов) аминокислоты зависит от величины рН, то есть от концентрации протонов в растворе. Значение рН, при котором суммарный заряд аминокислоты равен нулю и она не перемещается в постоянном электрическом поле, называется ее изоэлектрической точкой (рI). Такая в целом незаряженная форма аминокислоты носит название цвиттериона. Для алифатических аминокислот цвиттерион имеет следующий вид:
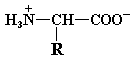
При увеличении или уменьшении рН по отношению к изоэлектрической точке происходит «перезарядка» аминокислоты и она утрачивает форму цвиттериона. В случае подкисления раствора, степень ионизации карбоксильной группы резко падает и аминокислота выступает в роли основания, присоединяя протоны.
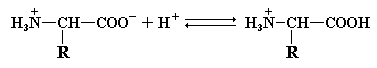
При повышении рН происходит обратный процесс: аминокислота, выступая в качестве кислоты, протоны отдает.
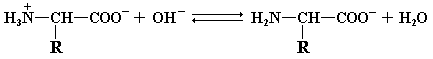
Химические свойства аминокислот
Функциональные амино- и карбоксильные группы аминокислот вступают во все характерные для них реакции.
Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
амфотерные свойства;
2. образование внутренних солей;
3. образование пептидов;
4. нингидриновая реакция.
