
- •Молекулярна фізика та термодинаміка
- •I. Основні положення молекулярної фізики і термодинаміки
- •1.1. Молекулярна фізика і термодинаміка, їх завдання та методи
- •1.2. Макроскопічні параметри системи та їх мікроскопічне тлумачення
- •1.3. Основні газові закони. Рівняння стану ідеального газу
- •1.4. Тиск газу з погляду молекулярно-кінетичної теорії
- •1.5. Молекулярно-кінетичне тлумачення температури
- •II. Перший закон термодинаміки
- •2.1. Вступ
- •2.2. Внутрішня енергія термодинамічної системи
- •2.3. Теплота і робота як форми передачі енергії
- •2.4. Теплоємність
- •2.5. Перший закон термодинаміки
- •2.6. Ізопроцеси в ідеальних газах
- •III. Другий закон термодинаміки
- •3.1. Можливості першого закону термодинаміки
- •3.2. Колові процеси
- •3.3. Цикл Карно
- •3.4. Нерівність Клаузіуса
- •3.5. Ентропія і її властивості
- •3.6. Другий закон термодинаміки
- •3.7. Статистичний характер другого закону термодинаміки
- •IV. Термодинамічні потенціали
- •4.1. Загальні відомості
- •4.2. Внутрішня енергія
- •4.3. Енергія Гельмгольца
- •4.4. Ентальпія
- •4.5. Енергія Гіббса
- •V. Третій закон термодинаміки
- •VI. Статистичні розподіли
- •6.1. Короткі відомості з теорії ймовірностей
- •6.2. Закон розподілу Больцмана
- •6.3. Закон розподілу Максвелла
- •6.4. Закон розподілу Максвелла–Больцмана
- •6.5. Закон рівномірного розподілу енергії за ступенями вільності
- •6.6. Внутрішня енергія й теплоємність ідеального газу
- •VII. Явища переносу в газах
- •7.1. Середня довжина вільного пробігу молекули
- •7.2. Дифузія в газах
- •7.3. Внутрішнє тертя з газах
- •7.4. Теплопровідність газів
- •VIII. Реальні гази
- •8.1. Відхилення реальних газів від ідеальності
- •8.2. Рівняння Ван-дер-Ваальса
- •8.3. Ізотерми реальних газів. Фазові переходи
- •8.4. Критична точка. Закон відповідних станів
- •8.5. Внутрішня енергія реального газу
- •8.6. Ефект Джоуля–Томсона
- •8.7. Зрідження газів та отримання низьких температур
- •IX. Рідини
- •9.1. Деякі властивості та будова рідини
- •9.2. Поверхневий натяг рідини
- •9.3. Поверхнево-активні речовини. Адсорбція
- •9.4. Змочування
- •9.5. Тиск викривленої поверхні. Капілярні явища
- •Х. Кристали
- •10.1. Особливості кристалічного стану
- •10.2. Класифікація кристалів
- •10.3. Фізичні типи кристалів
- •10.4. Дефекти в кристалах
2.6. Ізопроцеси в ідеальних газах
Щоразу, застосовуючи
на практиці методи термодинаміки
(розрахунки теплових двигунів, холодильних
машин тощо) досить
часто доводиться
мати справи з ізопроцесами в газах,
тобто з такими процесами, під час перебігу
яких один
з основних параметрів (
,
чи
![]() )
і маса газу не змінюються.
Розглянемо деякі з них.
)
і маса газу не змінюються.
Розглянемо деякі з них.
І зохорний
процес
– процес, що відбувається за постійного
об’єму газу. У координатах
Р-V він має вигляд прямої, що називають
ізохорою (рис. 2.3а). Оскільки
зохорний
процес
– процес, що відбувається за постійного
об’єму газу. У координатах
Р-V він має вигляд прямої, що називають
ізохорою (рис. 2.3а). Оскільки
![]() ,
то
,
то
![]() ,
,
![]() і для ізохорного процесу рівняння (2.14)
набирає вигляду:
і для ізохорного процесу рівняння (2.14)
набирає вигляду:
(2.16)
Тобто уся теплота, отримана системою в ізохорному процесі, витрачається на зміну її внутрішньої енергії.
П ри
зміні температури газу від Т1
до Т2
зі збереженням об’єму зміна його
внутрішньої
енергії та кількість наданої йому
теплоти може бути виражена рівнянням:
ри
зміні температури газу від Т1
до Т2
зі збереженням об’єму зміна його
внутрішньої
енергії та кількість наданої йому
теплоти може бути виражена рівнянням:
(2.17)
а теплоємність одного моля за постійного об’єму:

(2.18)
Ізобарний
процес
– процес, що відбувається за постійного
тиску. У координатах
![]() він
зображується прямою, названою ізобарою
(рис. 2.3б).
На
основі рівняння Мендєлєєва-Клапейрона
при
він
зображується прямою, названою ізобарою
(рис. 2.3б).
На
основі рівняння Мендєлєєва-Клапейрона
при
![]() знаходимо:
знаходимо:

З урахуванням цього, а також рівнянь (2.10) та (2.16), рівняння (2.14) набуває вигляду:
( 2.19)
2.19)
З![]() цього рівняння знаходимо зв'язок між
молярною теплоємністю газу за постійного
тиску
цього рівняння знаходимо зв'язок між
молярною теплоємністю газу за постійного
тиску
![]() і його молярною теплоємністю при
постійному об'ємі
і його молярною теплоємністю при
постійному об'ємі
![]() :
(2.20)
:
(2.20)
Це співвідношення називають рівнянням Р. Майєра.
Зі
співвідношення
 знаходимо:
знаходимо:
. (2.21)
(2.21)
З рівняння (2.21) випливає, що універсальна
газова стала R чисельно дорівнює
роботі, виконаній одним молем ідеального
газу під час його ізобарного нагрівання
на один градус. Робота, виконана в
ізобарному процесі 1–2:
рівняння (2.21) випливає, що універсальна
газова стала R чисельно дорівнює
роботі, виконаній одним молем ідеального
газу під час його ізобарного нагрівання
на один градус. Робота, виконана в
ізобарному процесі 1–2:
(2.22)
Ізотермічний
процес
– процес, що відбувається за постійної
температури. У координатах
Р-V
він зображується рівнобічною гіперболою
(рис. 2.3в), яку називають
ізотермою. Оскільки при
![]() ,
,
![]() і
і
 то рівняння першого закону термодинаміки
для цього процесу набуває вигляду:
то рівняння першого закону термодинаміки
для цього процесу набуває вигляду:
![]()
(2.23)
Н а
основі рівняння Мендєлєєва-Клапейрона
знаходимо:
а
основі рівняння Мендєлєєва-Клапейрона
знаходимо:
(2.24)
У ся
теплота
ся
теплота
![]() ,
яка була надана газу в ізотермічному
процесі,
витрачається
на здійснення
газом роботи проти зовнішніх сил:
,
яка була надана газу в ізотермічному
процесі,
витрачається
на здійснення
газом роботи проти зовнішніх сил:

(
В
В
Т
Г![]()
![]() ,
а
.
,
а
.
Адіабатний
процес
– процес,
що
відбувається без теплообміну між
системою та зовнішнім середовищем.
Його широко застосовують у циклах
двигунів внутрішнього згоряння,
холодильних установках
тощо. Для
такого процесу
![]() ,
і рівняння першого закону термодинаміки
має вигляд:
,
і рівняння першого закону термодинаміки
має вигляд:

(2.26)
Робота в адіабатному процесі виконується за рахунок внутрішньої енергії системи (газу). На основі рівняння Мендєлєєва–Клапейрона знаходимо:

Підставивши це значення в рівняння (2.26), отримаємо:
![]()
Оскільки
![]() ,
то
,
то
![]()
Р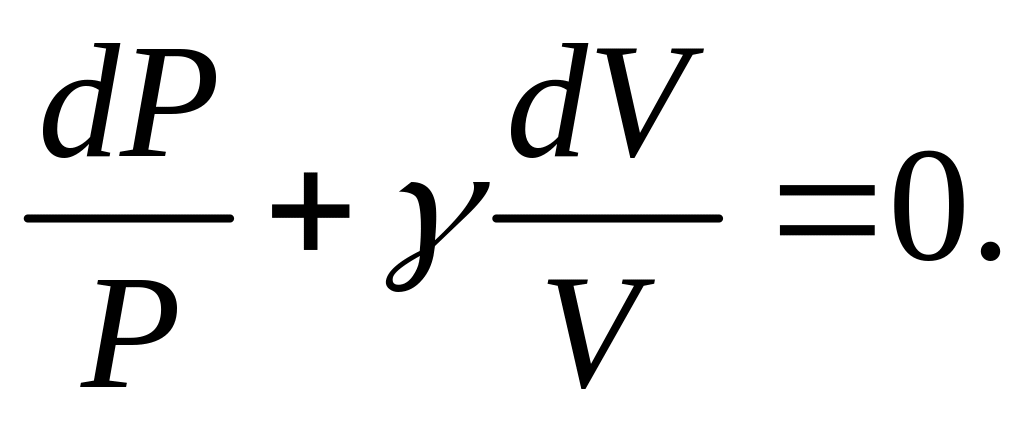 озділимо
це рівняння на
озділимо
це рівняння на
![]() ,
позначивши
,
позначивши
![]() ,
отримаємо:
,
отримаємо:
(2.27)
Приймаючи
![]() ,
що в не дуже великому інтервалі звичайних
температур практично вірно, проінтегруємо
останнє рівняння й отримаємо:
,
що в не дуже великому інтервалі звичайних
температур практично вірно, проінтегруємо
останнє рівняння й отримаємо:
![]()
з![]() відки:
відки:
(2.28)
Це рівняння називають рівнянням Пуассона, а лінію, що зображує адіабатний процес, називають адіабатою. У координатах вона представлена на рис. 2.3 г.
Р озділивши
рівняння
озділивши
рівняння
![]() на
і спотенціювавши
результат ділення,
отримаємо:
на
і спотенціювавши
результат ділення,
отримаємо:
(2.29)
Я![]()
![]()
![]()
 кщо
за рівнянням Мендєлєєва–Клапейрона
виразити тиск
і об'єм
і підставити їх послідовно в рівняння
(2.28)
і
(2.29), то після незначних математичних
перетворень можна
одержати
рівняння
адіабати, виражені
через параметри
кщо
за рівнянням Мендєлєєва–Клапейрона
виразити тиск
і об'єм
і підставити їх послідовно в рівняння
(2.28)
і
(2.29), то після незначних математичних
перетворень можна
одержати
рівняння
адіабати, виражені
через параметри
![]() і
і
![]() :
:
(2.30)
Р оботу
оботу
![]() ,
яка виконується газом в адіабатному
процесі 1-2, знайдемо на основі рівняння
(2.26):
,
яка виконується газом в адіабатному
процесі 1-2, знайдемо на основі рівняння
(2.26):
(2.31)
На основі рівнянь (2.20) і (2.27) знаходимо:
 (2.32)
(2.32)
П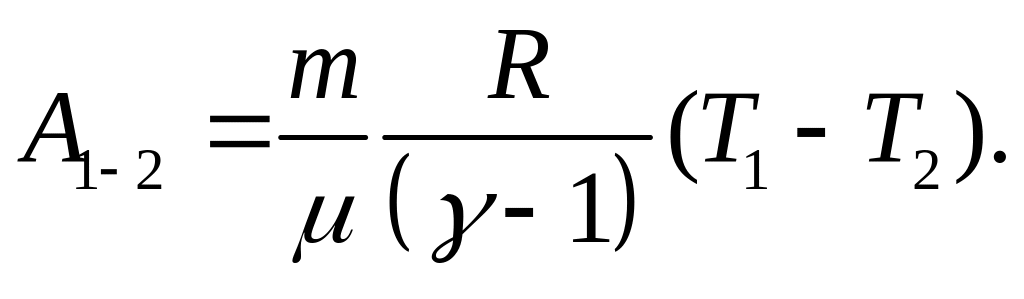 ідставимо
це значення
у
рівняння (2.31) і знайдемо:
ідставимо
це значення
у
рівняння (2.31) і знайдемо:
(2.33)
Р озділивши
й помноживши
праву частину цього рівняння на
озділивши
й помноживши
праву частину цього рівняння на
![]() і з огляду
на
рівняння Мендєлєєва–Клапейрона,
отримаємо:
і з огляду
на
рівняння Мендєлєєва–Клапейрона,
отримаємо:
(2.34)
На
основі рівнянь адіабат
![]() і
і
![]() знаходимо:
знаходимо:

Підставивши ці значення в рівняння (2.33), отримаємо:

(2.35)
Політропні
процеси
– це процеси, при протіканні яких
теплоємність
тіла залишається
постійною.
Одержимо
рівняння політропи
на основі першого закону
термодинаміки. Якщо з рівняння
Клапейрона-Мендєлєєва
виразити
![]() і підставити в рівняння
і підставити в рівняння
![]() ,
то з урахуванням рівняння
,
то з урахуванням рівняння
![]() ,
після деяких перетворень, можна отримати:
,
після деяких перетворень, можна отримати:

І![]() нтегруючи
це рівняння, отримаємо:
нтегруючи
це рівняння, отримаємо:
(2.36)

де
(2.37)
У
(2.38)![]() – молярна теплоємність в умовах
розглянутого процесу.
Рівняння (2.36) і є шукане рівняння
політропи.
– молярна теплоємність в умовах
розглянутого процесу.
Рівняння (2.36) і є шукане рівняння
політропи.
І з
рівняння (2.37) знаходимо:(2.38)
з
рівняння (2.37) знаходимо:(2.38)
С користавшись
співвідношеннями (2.20), (2.32) і (2.38), одержимо
користавшись
співвідношеннями (2.20), (2.32) і (2.38), одержимо
(2.39)
де
![]() – показник політропи,
–
показник адіабати.
– показник політропи,
–
показник адіабати.
На
основі рівнянь (2.36) – (2.39) легко показати,
що рівняння
політропи охоплює усі раніше описані
ізопроцеси.
Так, при
![]()
![]() . За цих умов рівність (2.36) виконується
при
. За цих умов рівність (2.36) виконується
при
![]() ,
що відповідає ізохорному процесу.
Якщо
,
що відповідає ізохорному процесу.
Якщо
![]() ,
то
,
то
![]() і
і
![]() ,що
відповідає
ізобарному процесу.
Рівняння (2.36) переходить у рівняння
ізотерми
,що
відповідає
ізобарному процесу.
Рівняння (2.36) переходить у рівняння
ізотерми
![]() при
при
![]() .
При цьому відповідно до
рівняння
(2.38),
.
При цьому відповідно до
рівняння
(2.38),
![]() ,
що відповідає ізотермічному
процесу.
Нарешті, при заміні
на
теплоємність
,
що відповідає ізотермічному
процесу.
Нарешті, при заміні
на
теплоємність
![]() і політропа (2.36) переходить в адіабату
(2.28).
і політропа (2.36) переходить в адіабату
(2.28).
Робота,
виконана ідеальним газом у процесі
 .
.
Оскільки
![]() ,
то
,
то
![]() ,
а
,
а
![]() ,
де
,
де
![]() і
і
![]() – тиск й об'єм
газу на початку процесу.
– тиск й об'єм
газу на початку процесу.
Тоді:

(2.40)
