
- •Молекулярна фізика та термодинаміка
- •I. Основні положення молекулярної фізики і термодинаміки
- •1.1. Молекулярна фізика і термодинаміка, їх завдання та методи
- •1.2. Макроскопічні параметри системи та їх мікроскопічне тлумачення
- •1.3. Основні газові закони. Рівняння стану ідеального газу
- •1.4. Тиск газу з погляду молекулярно-кінетичної теорії
- •1.5. Молекулярно-кінетичне тлумачення температури
- •II. Перший закон термодинаміки
- •2.1. Вступ
- •2.2. Внутрішня енергія термодинамічної системи
- •2.3. Теплота і робота як форми передачі енергії
- •2.4. Теплоємність
- •2.5. Перший закон термодинаміки
- •2.6. Ізопроцеси в ідеальних газах
- •III. Другий закон термодинаміки
- •3.1. Можливості першого закону термодинаміки
- •3.2. Колові процеси
- •3.3. Цикл Карно
- •3.4. Нерівність Клаузіуса
- •3.5. Ентропія і її властивості
- •3.6. Другий закон термодинаміки
- •3.7. Статистичний характер другого закону термодинаміки
- •IV. Термодинамічні потенціали
- •4.1. Загальні відомості
- •4.2. Внутрішня енергія
- •4.3. Енергія Гельмгольца
- •4.4. Ентальпія
- •4.5. Енергія Гіббса
- •V. Третій закон термодинаміки
- •VI. Статистичні розподіли
- •6.1. Короткі відомості з теорії ймовірностей
- •6.2. Закон розподілу Больцмана
- •6.3. Закон розподілу Максвелла
- •6.4. Закон розподілу Максвелла–Больцмана
- •6.5. Закон рівномірного розподілу енергії за ступенями вільності
- •6.6. Внутрішня енергія й теплоємність ідеального газу
- •VII. Явища переносу в газах
- •7.1. Середня довжина вільного пробігу молекули
- •7.2. Дифузія в газах
- •7.3. Внутрішнє тертя з газах
- •7.4. Теплопровідність газів
- •VIII. Реальні гази
- •8.1. Відхилення реальних газів від ідеальності
- •8.2. Рівняння Ван-дер-Ваальса
- •8.3. Ізотерми реальних газів. Фазові переходи
- •8.4. Критична точка. Закон відповідних станів
- •8.5. Внутрішня енергія реального газу
- •8.6. Ефект Джоуля–Томсона
- •8.7. Зрідження газів та отримання низьких температур
- •IX. Рідини
- •9.1. Деякі властивості та будова рідини
- •9.2. Поверхневий натяг рідини
- •9.3. Поверхнево-активні речовини. Адсорбція
- •9.4. Змочування
- •9.5. Тиск викривленої поверхні. Капілярні явища
- •Х. Кристали
- •10.1. Особливості кристалічного стану
- •10.2. Класифікація кристалів
- •10.3. Фізичні типи кристалів
- •10.4. Дефекти в кристалах
6.6. Внутрішня енергія й теплоємність ідеального газу
О скільки
молекули ідеального газу на відстані
не взаємодіють між собою, то внутрішня
енергія такого газу дорівнює сумі
енергій його окремих молекул.
Отже, внутрішня енергія одного моля
ідеального газу буде дорівнювати:
скільки
молекули ідеального газу на відстані
не взаємодіють між собою, то внутрішня
енергія такого газу дорівнює сумі
енергій його окремих молекул.
Отже, внутрішня енергія одного моля
ідеального газу буде дорівнювати:
(6.29)
де
![]() – число Авогадро,
– число Авогадро,
![]() – універсальна газова стала.
– універсальна газова стала.
М![]() олярна
теплоємність газу за постійного об'єму
олярна
теплоємність газу за постійного об'єму
![]() буде дорівнювати:
буде дорівнювати:
(6.30)
М![]() олярна
теплоємність за постійного тиску, згідно
з рівнянням Майєра, буде дорівнювати:
олярна
теплоємність за постійного тиску, згідно
з рівнянням Майєра, буде дорівнювати:
(6.31)
Звідси знаходимо, що показник адіабати дорівнює:
![]()
(6.32)
З гідно
з рівняннями (6.29) – (6.31) молекула
двохатомного газу із жорстким зв'язком
характеризується такими величинами:
гідно
з рівняннями (6.29) – (6.31) молекула
двохатомного газу із жорстким зв'язком
характеризується такими величинами:
а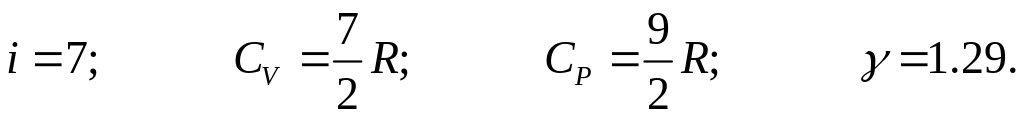 для молекули того ж газу із пружним
зв'язком:
для молекули того ж газу із пружним
зв'язком:
Д ля
одноатомного газу ці характеристики
такі:
ля
одноатомного газу ці характеристики
такі:
Експериментальні
дані для реальних газів за звичайних
умов
такі: гелій –
![]() =
= 1,67; кисень
= 1,40; оксид
вуглецю
=
1,40. Здавалось би, що відповідність
між теорією
та експериментом цілком задовільна.
Однак, згідно з рівняннями (6.30) і (6.31),
теплоємність кратна
1,67; кисень
= 1,40; оксид
вуглецю
=
1,40. Здавалось би, що відповідність
між теорією
та експериментом цілком задовільна.
Однак, згідно з рівняннями (6.30) і (6.31),
теплоємність кратна
![]() .що
розходиться з
експериментальними даними. Крім
того, відповідно до класичної теорії,
теплоємність газів не повинна залежати
від температури.
.що
розходиться з
експериментальними даними. Крім
того, відповідно до класичної теорії,
теплоємність газів не повинна залежати
від температури.
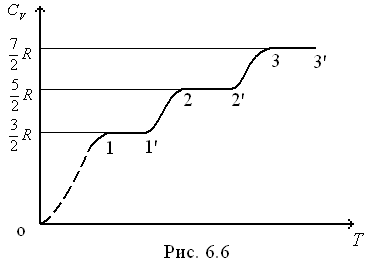
Експеримент в області низьких температур не узгоджується з цією теорією. Так, молярна теплоємність водню в області низьких температур складним чином залежить від температури (рис. 6.6). На підставі такої залежності можна уявити, що ділянки 0-1, 1΄-2 та 2΄-3 відповідають збудженню енергій поступального, обертального та коливального рухів. Зі збільшенням температури газу для кожного з інтервалів зростає число молекул, що беруть участь у відповідному виді руху. Горизонтальні ділянки 1-1΄ та 2-2΄ відповідають процесам накопичення енергії для збудження обертального та коливального рухів відповідно. Число ступенів вільності, що зумовлюють величину теплоємності, залежить від температури.
Розбіжність між класичною теорією та експериментом зумовлена тим, що властивості реального газу відрізняються від властивостей ідеального газу. Енергетичні процеси в області мікросвіту описуються законами не класичної, а квантової теорії, яка досить добре узгоджується з експериментом і пояснює зазначені тут розбіжності.
VII. Явища переносу в газах
7.1. Середня довжина вільного пробігу молекули
В иконуючи
тепловий рух, молекули газу час від часу
стикаються одна з одною. Кожна молекула
вільно пролітає коротку відстань від
одного зіткнення до іншого. Цю відстань
називають довжиною вільного пробігу.
Навіть для однієї і тієї самої молекули
ці відстані відрізняються.
У момент зіткнення швидкість молекули
відчуває різку зміну як за величиною,
так і за напрямком.
У результаті траєкторія молекули являє
собою ламану лінію, а просування молекули
вперед відбувається порівняно повільно.
Для опису руху молекул газу Клаузіус
ввів поняття середньої довжини вільного
пробігу
иконуючи
тепловий рух, молекули газу час від часу
стикаються одна з одною. Кожна молекула
вільно пролітає коротку відстань від
одного зіткнення до іншого. Цю відстань
називають довжиною вільного пробігу.
Навіть для однієї і тієї самої молекули
ці відстані відрізняються.
У момент зіткнення швидкість молекули
відчуває різку зміну як за величиною,
так і за напрямком.
У результаті траєкторія молекули являє
собою ламану лінію, а просування молекули
вперед відбувається порівняно повільно.
Для опису руху молекул газу Клаузіус
ввів поняття середньої довжини вільного
пробігу
![]() .
Розрахуємо цю величину на підставі
молекулярно-кінетичної теорії газу,
скориставшись моделлю твердих куль.
.
Розрахуємо цю величину на підставі
молекулярно-кінетичної теорії газу,
скориставшись моделлю твердих куль.
Для
спрощення розрахунку спочатку припустимо,
що всі молекули перебувають у стані
спокою, а рухається тільки одна молекула
з середньою швидкістю
![]() відносно молекул, які перебувають у
стані спокою. Рухаючись, молекула буде
зіштовхуватися
з усіма нерухомими молекулами, центри
яких відстоять
від траєкторії руху центра молекули на
відстанях, що не перевищують
ефективний діаметр молекули
відносно молекул, які перебувають у
стані спокою. Рухаючись, молекула буде
зіштовхуватися
з усіма нерухомими молекулами, центри
яких відстоять
від траєкторії руху центра молекули на
відстанях, що не перевищують
ефективний діаметр молекули
![]() .
За одиницю часу
молекула, за якою ведеться спостереження,
зіштовхнеться з усіма молекулами, центри
яких лежать всередині циліндра з висотою
і радіусом
основи
(рис 7.1). Число таких зіткнень молекули,
що рухається, з молекулами,
які перебувають у стані спокою,
буде дорівнювати:
.
За одиницю часу
молекула, за якою ведеться спостереження,
зіштовхнеться з усіма молекулами, центри
яких лежать всередині циліндра з висотою
і радіусом
основи
(рис 7.1). Число таких зіткнень молекули,
що рухається, з молекулами,
які перебувають у стані спокою,
буде дорівнювати:
(![]() 7.1)
7.1)
де
– число молекул в одиниці об'єму.
Оскільки в газі рухаються всі молекули,
то можливість зіткнення двох молекул
залежить від їх відносної швидкості.
На основі закону розподілу молекул газу
за швидкостями
Максвелл показав, що відносна середня
швидкість пов'язана
із прийнятою раніше середньою швидкістю
співвідношенням
![]() .
Тоді
середнє число зіткнень кожної молекули
за одиницю
часу буде дорівнювати:
.
Тоді
середнє число зіткнень кожної молекули
за одиницю
часу буде дорівнювати:
(![]() 7.2)
7.2)
де
![]() – так званий ефективний перетин молекули,
що чисельно
дорівнює площі, в яку повинна потрапити
молекула, щоб вона
могла провзаємодіяти з такою самою
іншою молекулою.
– так званий ефективний перетин молекули,
що чисельно
дорівнює площі, в яку повинна потрапити
молекула, щоб вона
могла провзаємодіяти з такою самою
іншою молекулою.
Очевидно,
що у разі досить великої кількості
зіткнень
![]() середня довжина вільного пробігу
молекули буде дорівнювати:
середня довжина вільного пробігу
молекули буде дорівнювати:

(7.3)
Оскільки
тиск газу
пов'язаний з концентрацією його молекул
співвідношенням
![]() ,
то з рівняння (7.3) випливає,
що за постійної температури газу має
місце наступне
співвідношення:
,
то з рівняння (7.3) випливає,
що за постійної температури газу має
місце наступне
співвідношення:
(![]() 7.4)
7.4)
Величину можна визначити експериментально на основі вивчення явищ переносу в газах.
