
Сахарный Диабет
.pdf50 |
Cахарный диабет: патогенез, классификация, диагностика и лечение |
летных мышцах всего организма и в мышцах бедра больных сахарным диабетом типа 2 имело место выраженная инсулинрезистентность, определяемая по поглощению глюкозы (71+6 мкмоль/кг/мин, при норме у здоровых лиц – 96+5 мкмоль/кг/мин), а в мышцах сердца – инсулинрезистентность соответствовала нормальным показателям.
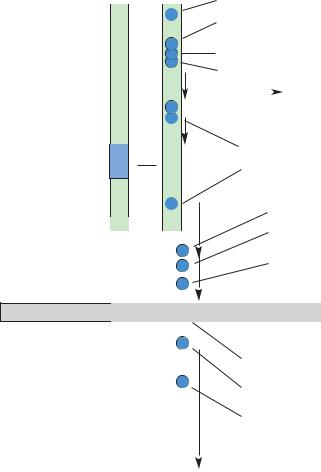
Причиной инсулинрезистентности может быть мутация гена инсулинового рецептора. По мнению S. I. Taylor and D. E. Moller (1993), мутации инсулинового рецептора следует подразделять на V классов:
I – мутации, приводящие к снижению скорости биосинтеза рецептора (схема 3);
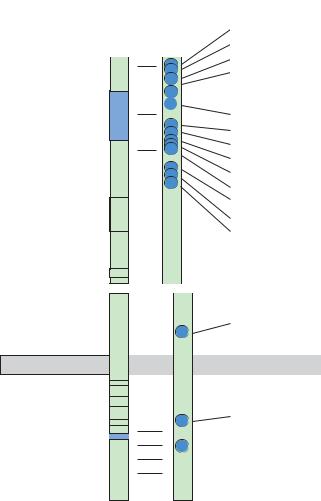
II – мутации, ухудшающие внутриклеточный транспорт и посттрансляционный процессинг (схема 4);
II – мутации, приводящие к дефектам связывания инсулина (схема 5);
IV – мутации, сопровождающиеся снижением рецепторной активности тирозинкиназы (схема 6);
V – мутации, ускоряющие деградацию инсулинового рецептора (схема 7).
К I классу мутаций относятся бессмысленные мутации кодона 897, кодона 672 гена рецептора инсулина, сопровождающиеся значительным снижением уровня мРНК гена инсулинового рецептора. Выявлено более 30 точечных мутаций гена инсулинового рецептора, в том числе относящихся ко II классу и идентифицированных при различных формах диабета, включая сахарный диабет типа 2, сопровождающихся инсулиновой резистентностью. Несколько мутантных рецепторов характеризуются дефектами посттрансляционной модификации. При этом такая мутация может сопровождаться: а) дефектом транспорта рецептора к клеточной поверхности; б) снижением аффиности рецептора или в) никак не отражаться на функциональной активности рецептора. Среди описанных мутаций III класса следует отметить две мутации инсулинового рецептора, сопровождающиеся снижением способности связывания рецептора с инсулином (снижение аффинности) и мутация, приводящая к повышению аффинности инсулинового рецептора. IV класс мутаций, представляют мутации: а) мутации бета-субединицы рецептора, приводящие к снижению инсулинстимулированной рецепторной тирозинкиназы (делеции экзона 17-22, мутации кодона 1109, мутации юкстамембранного домена, мутации, при которых резко снижается фосфорилирование IRS-1 или субстрата-1 инсулинрецепторной киназы и др.); б) мутации внеклеточного домена также сопровождающие ингибированием тирозинкиназной активности; в) киназодефицитные мутации, сопровождающиеся снижением эндоцитоза инсулинрецепторного комплекса и нарушением обратной регуляции «down – regulation»;
Пособие для врачей |
51 |
К мутациям рецептора инсулина 1-й группы относятся:
-мутации, приводящие к снижению скорости биосинтеза рецептора;
-мутации кодона 897, кодона 672;
-гена-рецептора инсулина;
-выявлено более 30 точечных мутаций гена инсулинового рецептора,
втом числе относящиеся ко 2-й группе
L1 Domain (1 – 154)
Cys-rich (155 – 312)
L2 Domian (313 – 428)
Immunogenic domian (450 – 601)
Exon 11 (718 – 729)
Tyr – 972
ATP-Binding (1003 – 1030)
Catalytic Loop (1131 – 1137)
Tyr – 1158, 1162, 1163
Tyr – 1328, 1334
|
|
Exons |
|
|
|
|
|
|
|
|
|
|||
α |
α |
|
∆ 10 bp/ Ex 1 |
|
||||||||||
1 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
R86X |
|
|||
|
2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
K121X |
|
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
W133X |
|
|||
|
3 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
∆ Ex 3 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
AG |
|
|
GC |
|
|
|
|
|
|
|
|
|
|
|||||
4 |
|
|
|
|
|
|
|
(Splice |
acceptor: |
|||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
∆ Ex 5 intron 4) |
||||
5 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
6 |
|
|
|
|
|
|
|
R372X |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
7
8Q672X
|
9 |
|
|
|
|
|
|
|
|
∆ Ex 10 – 13 |
|||
|
10 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
R786X |
||||
|
11 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
∆ 13bp/Ex 13 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
12 |
|
|
|
|
|
|
|
∆ Ex 14 |
||||
|
|
|
|
|
|
|
|
R897X |
|||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||
|
13 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Extracellular |
|
|
14 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16 |
|
|
|
|
|
|
|
|
Intracellular |
||
|
|
|
|
|
|
|
|
|
|||||
|
17 |
|
|
|
|
|
|
|
∆ AG (Codon 955) |
||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
19 |
|
|
|
|
|
|
|
R 1000x |
|||
|
|
|
|
|
|
||||||||
|
20 |
|
|
|
|
|
|
|
|
|
|
||
|
|
21 |
|
|
|
|
|
|
|
∆ G (Codon 1109) |
|||
|
22 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
β |
|
|
|
β |
|
|
|
|
|||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||
Схема 3. Мутация рецептора инсулина 1-й группы
52 |
Cахарный диабет: патогенез, классификация, диагностика и лечение |
К мутациям рецептора инсулина 2-й группы относятся:
-мутации, ухудшающие внутриклеточный транспорт и посттрансляционный процессинг;
-дефекты посттрансляционной модификации;
-деффект транспорта рецептора к клеточной мембране;
-снижение аффинности рецептора.
L1 Domain (1 – 154)
Cys-rich (155 – 312)
L2 Domian (313 – 428)
Immunogenic domian (450 – 601)
Exon 11 (718 – 729)
Tyr – 972
ATP-Binding (1003 – 1030)
Catalytic Loop (1131 – 1137)
Tyr – 1158, 1162, 1163
Tyr – 1328, 1334
α |
|
|
D 15K |
1 |
|
V 28A |
|
|
|
G 31R |
|
|
|
|
L 62P
2
 R 86P
R 86P

 1119I D K121
1119I D K121
3
H 209R
4L 233P
|
|
5 |
|
|
|
|
|
|
|
R 252H |
|
6 |
|
|
|
|
|
|
|
∆ K281 |
|
|
|
|
|
|
|
|
|
|
|
G 366R |
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F 382V |
||
|
8 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
W 412S |
||
|
9 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|
|
T 910M |
||
|
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
|
|
|
|
Extracellular |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
16 |
|
|
|
|
|
|
Intracellular |
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
17 |
|
|
|
|
|
|
A 1135E |
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
19
20 E 1179D
E 1179D
21
 W 1193L
W 1193L
22
β |
β |
Схема 4. Мутация рецептора инсулина 2-й группы
Пособие для врачей |
53 |
К мутациям рецептора инсулина 3-й группы относятся:
-мутации, приводящие к дефектам связывания инсулина;
-снижение аффинности;
-мутация, приводящая к повышению аффинности инсулинового рецептора.
L1
Cys-rich (155 – 312)
L2 Domian (313 – 428)
Immunogenic domian (450 – 601)
Exon 11 (718 – 729)
Tyr – 972
ATP-Binding (1003 – 1030)
Catalytic Loop (1131 – 1137)
Tyr – 1158, 1162, 1163
Tyr – 1328, 1334
Exons
α
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N 15K |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D 59G |
|
|
2 |
|
|
|
|
|
R 86P |
|
|
|
|
|
|
|
|
L 87P |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
D 707 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
11 |
|
|
|
|
|
R 735S |
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Extracellular |
|
|
14 |
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
16 |
|
|
|
|
Intracellular |
||
|
|
|
|
|
|||||
|
17 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
19 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
20 |
|
|
|
|
|
|
|
|
|
21 |
|
|
|
|
|
|
|
|
22 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
β |
|
|
|
|
β |
||||
Схема 5. Мутация рецептора инсулина 3-й группы

54 |
Cахарный диабет: патогенез, классификация, диагностика и лечение |
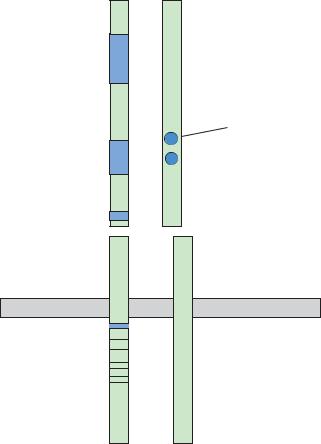
К мутациям рецептора инсулина 4-й группы относятся:
-мутации, сопровождающиеся снижением активности рецепторной тирозинкиназы;
-мутации b-субединицы рецептора, приводящие к снижению инсулинстимулированной рецепторной тирозинкиназы (делеции экзона 17-22), мутации кодона 1109, мутации юкстамембранного домена, мутации, приводящие к снижению фосфорилирования IRS-1, мутации внеклеточного домена со снижением активности тирозинкиназы, киназодефицитные мутации со снижением эндоцитоза инсулинрецепторного комплекса и нарушением «down-regulation».
αExons α
L1 Domain (1 – 154)
Cys-rich (155 – 312)
L2 Domian (313 – 428)
Immunogenic domian (450 – 601)
Exon 11 (718 – 729)
Extracellular
Intracellular
Tyr – 972
ATP-Binding (1003 – 1030)
Catalytic Loop (1131 – 1137)
Tyr – 1158, 1162, 1163
Tyr – 1328, 1334
F 382V
P 986L R 9930 ∆ L999
G 1008V
A 1048D K 1068E
R 1092O/R 1092W

 R 1131Q
R 1131Q
AI 134T
 AI 135E
AI 135E
M 11531
RI 164Q R 1174Q P 1178L
E 1179D/E 1179K WI 193L
W 1200S
β |
β |
Схема 6. Мутация рецептора инсулина 4-й группы
Пособие для врачей |
55 |
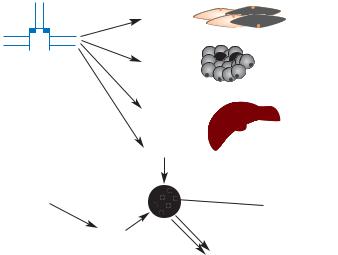
К мутациям рецептора инсулина 5-й группы относятся:
-мутации, ускоряющие деградацию инсулинового рецептора;
-мутации глутамина – 460 (GLU – 460), приводящие к ускорению деградации инсулинового рецептора.
L1 Domain (1 – 154)
Cys-rich (155 – 312)
L2 Domian (313 – 428)
Immunogenic domian (450 – 601)
Exon 11 (718 – 729)
Tyr – 972
ATP-Binding (1003 – 1030)
Catalytic Loop (1131 – 1137)
Tyr – 1158, 1162, 1163
Tyr – 1328, 1334
Exons
αα
K 460E
 N 462S
N 462S
Extracellular
Intracellular
|
|
|
|
|
|
|
|
|
|
β |
β |
Схема 7. Мутация рецептора инсулина 5-й группы
56 |
Cахарный диабет: патогенез, классификация, диагностика и лечение |
г) киназо-дефицитные мутации, приводящие к инсулиновой резистентности. И, наконец, мутации глютамина 460 (GLU460) относят к мутациям V класса, которые сопровождаются ускорением деградации инсулинового рецептора.
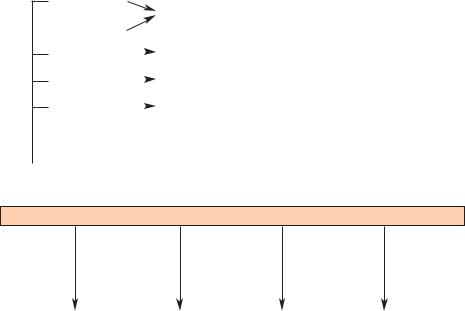
За последние годы получены дополнительные экспериментальные данные, позволяющие уточнить сложные механизмы инсулинрезистентности. Компоненты рецептора инсулина или субстраты инсулинового рецептора (СИР) участвуют в пострецепторных механизмах действия инсулина, что представлено на схеме 8. Y. Terauchi et al. (1997) получили мышей с экспериментальной моделью сахарного диабета типа 2, у которой отсутствует ген СИР-1,что сопровождается инсулинрезистентностью, и ген глюкокиназы, что проявляется снижением секреции инсулина. Такой двойной дефект приводит к развитию сахарного диабета, который характеризуется базальной гиперинсулинемией и снижением секреции инсулина в ответ на нагрузку глюкозой. У животных с таким генотипом СИР-1-/- отмечается гиперплазия β-клеток и признаки диффе-
СИР – 1 |
Мышца |
СИР – 2 |
|
ИР |
|
СИР – 1 |
Жировая ткань |
СИР – 2 |
|
СИР – 1 |
Печень |
СИР – 2 |
|
СИР – 2 |
|
ИФР-1 рецептор |
β-клетки островка |
|
|
Рост |
|
|
Секреция инсулина |
|
(увеличение количества β-клеток, их |
|
рост и выживание) |
ИР – инсулиновый рецептор; |
|
ИФР-1 – инсулиноподобный фактор роста-1; |
|
СИР – субстрат инсулинового рецептора |
|
Схема 8. Схема механизма пострецепторного действия инсулина
Пособие для врачей |
57 |
ренцировки неэндокринных клеток в β-клетки. Эти изменения, по мнению авторов, отражают компенсаторную гиперинсулинемию, вызванную инсулиновой резистентностью, что в какой-то мере отражает имеющее место при сахарном диабете 2 типа у человека взаимоотношения между инсулиновой резистентностью и гиперинсулинемией. Интерпретируя эти результаты исследований, A. B. Jenkins et L. H. Storlien (1997) считают, что нарушение функции СИР-1 у животных приводит к блокаде трансдукции биологического сигнала инсулина, что в свою очередь является причиной гиперинсулинемии и гиперплазии β-клеток. Несомненно, что в ближайщее время при исследованиях на этой экспериментальной модели животных будут получены дополнительные данные по патогенезу инсулинрезистентности и ее роли в развитии сахарного диабета типа 2. Как установлено, субстраты рецептора инсулина (СИР или IRS) экспрессируются не во всех тканях, чем и объясняется избирательность действия инсулина (схема 9).
|
|
|
|
Печень |
|
IRS-1 |
|
|
|
|
|
|
||
|
|
|
Экспрессия во многих тканях |
Мышцы |
|
|
|
||
|
|
|
Жировая ткань |
|
|
IRS-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IRS-3 |
|
Экспрессия только в жировой ткани |
|
|
|
|
||
|
|
|
||
|
|
|
|
|
|
IRS-4 |
|
Экспрессия в тимусе, мозге, почке |
|
|
|
|
||
|
|
|
||
|
|
|
|
|
|
GRB2 |
|
Контроль экспрессии pH белка |
|
|
|
|
||
|
|
|
|
|
ПРЕКСТРИН  транскрипция генов
транскрипция генов

 PI-3 киназа
PI-3 киназа
Фосфолипидзависимые киназы и протеинкиназы В
Транспорт |
Выживание |
Синтез |
Синтез |
глюкозы |
клеток |
гликогена |
белка |
Схема 9. Компоненты рецептора инсулина и их значимость в действии инсулина
58 |
Cахарный диабет: патогенез, классификация, диагностика и лечение |
Как известно, сахароснижающее действие инсулина обусловлено активированием процесса синтеза гликогена в печени и скелетных мышцах. Мышечная гликогенсинтаза является ключевым ферментом неокислительного обмена глюкозы. Нарушение активности фермента сопровождается снижением биологической активности инсулина и инсулиновой резистентностью. Множественные дефекты в активности гликогенсинтазы приводят к снижению синтеза гликогена, что имеет место у больных сахарным диабетом типа 2. Причиной инсулинрезистентности, помимо мутации гена рецептора к инсулину, являются выявляемые также мутации гена гексокиназы 2 типа, гена СИР-1, гена гликогенсинтазы и гена регуляторной субединицы 1 типа.
Активация синтеза гликогена в скелетной мышце в ответ на инсулин является результатом ингибирования активности киназы-3 гликогенсинтазы и одновременным активированием протеинфосфатазы-1, в результате чего изменяется соотношение между неактивным фосфорилированным состоянием гликогенсинтазы и активным дефосфорилированным состоянием. Киназа-3 гликогенсинтазы является важным регулятором синтеза гликогена в скелетной мышце, которая у человека, как и некоторых млекопитающих, представлена двумя различными изоформами этого белка: киназа-3 и киназа-гликогенсин- таза. Установлено, что ген киназы-3 гликогенсинтазы локализуется на хромосоме 19q13.1-q13.2, а ген киназы-3 гликогенсинтазы на хромосоме 3q13.3-q21 и естественно мутация генов, контролирующих синтез киназы-3 будет сопровождаться инсулиновой резистентностью, гиперинсулинемией и нарушением синтеза гликогена. Инсулинрезистентность и связанная с ней компенсаторная гиперинсулинемия у больных сахарным диабетом типа 2 может быть обусловлена снижением активности киназы 3 или 3 гликогенсинтазы, а также непосредственно гликогенсинтазы или протеинфосфатазы 1 типа.
Скорость образования глюкозы печенью является основным фактором, поддерживающим гомеостаз глюкозы в организме. Этот процесс поддерживается содержанием инсулина и глюкагона в крови, поступающей в печень. Глюкагон повышает распад гликогена и стимулирует процессы неоглюкогенеза, тогда как инсулин ингибирует как гликогенолиз, так и глюконеогенез. Содержание инсулина в синусоидах печени определяет скорость образования глюкозы. Помимо прямого влияния на скорость продукции глюкозы печенью, инсулин оказывает и опосредованное действие. На уровне клеток островка поджелудочной железы инсулин, как известно, ингибирует секрецию глюкагона, а последний, в свою очередь, изменяет гликогенолиз в печени. В жировой ткани инсулин угнетает липолиз и соответственно концентрацию глицерина и НЭЖК в крови, поступающей в печень, что также приводит к снижению глюконеогенеза. Перечисленное необходимо учитывать,
Пособие для врачей |
59 |
при рассмотрении роли печени в поддержании гликемии при сахарном диабете типа 2.
До последнего времени практически всеми диабетологами считалось, что постабсорбционная гипергликемия у больных сахарным диабетом типа 2 является следствием снижения утилизации глюкозы в печени и повышением скорости эндогенного образования глюкозы, что рассматривалось как результат ускоренного глюконеогенеза, повышенного поступления в печень субстратов, необходимых для этого процесса. Это предположение базировалось на экспериментальных косвенных данных, которые не подвергались ревизии в течение десятков лет. Внедрение в клиническую практику новых методов исследования позволило непосредственно изучить скорость окисления жирных кислот в печени, которые являются донаторами субстратов, необходимых для процесса глюконеогенеза. F. Diraison et al. (1998) изучали скорость глюконеогенеза у больных сахарным диабетом типа 2 и практически здоровых лиц, используя неинвазивный метод с применением в постабсорбционном периоде инфузии [6,6-2H2] глюкозы (в течение 150 мин.) и [3-13C] лактата (в течение 6 час.). Активность и соотношение ферментов, участвующих в процессе глюконеогенеза, пируваткарбоксилазы и пируватдегидрогеназы у больных сахарным диабетом типа 2 и контрольных (здоровых) лиц практически не отличались в обеих группах (12,1+2,6 против 11,2+1,4). Окисление жирных кислот в печени больных сахарным диабетом типа 2 также не было повышенным (1,8+0,4 против 1,6+0,1 мкмоль/кг/мин). Исследования показали, что у больных сахарным диабетом типа 2, несмотря на повышение скорости обмена лактата и умеренное повышение скорости обмена глюкозы, абсолютная скорость глюкогенеза, как и окисления жирных кислот, при этом не увеличена.
У подавляющего количества больных сахарным диабетом типа 2 имеется ожирение различной степени выраженности, наличие которого является одним из факторов, участвующих в патогенезе заболевания. Показателями избыточной массы тела служат индекс массы тела (кг/м2), который в норме у мужчин равен 20-25, а у женщин – 19-24. Вторым критерием ожирения является индекс отношения талия/бедро, которое в норме у мужчин составляет 0,8- 1,0, а у женщин – 0,7-0,85. На долю жировой ткани в организме женщины приходится 20-30% массы тела, а мужчины – 10-20%.
Жировая ткань является основным «хранилищем» запасов энергии в организме. Из всей энергии, поступающей в организм с пищей, около 75% расходуется на поддержание основного обмена, 10-15% в процессе работы и другой физической активности и 10-15% – на поддержание постоянной температуры тела, т. е. термогенез. Помимо избыточного количества жировой ткани риском для развития диабета является ее распределение, т. е. тип ожирения. Преиму-
