
- •Казахская головная
- •Оглавление
- •Предисловие
- •Лекция № 1 «Общие сведения о предмете»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 2 «Законы термодинамики» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция № 3 Продолжение темы: «Законы термодинамики» Краткое содержание лекции
- •Сабақтын қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература:
- •Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 5 «Коллоидные системы»
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Список литературы
- •Лекция № 6 «Получение коллоидно-дисперсных систем» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Лекция № 7 «Строение лиофобных золей» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 8 «Коллоидно-химическая теория схватывания и твердения вяжущих веществ»
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Cабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №10 «Фазовые равновесия в однокомпонентных системах» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция №11 «Фазовые равновесия в двухкомпонентных системах. Диаграмма состояний двухкомпонентной системы с эвтектикой без твердых растворов и химических соединений» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы:
- •Литература
- •Лекция №12 « Диаграмма состояния двухкомпонентной системы с химическим соединением»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 13 «Основы аналитической химии» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 14 «Количественная характеристика растворов» Краткое содержание лекции
- •Лекцияның қысқаша мазмұны
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 15 «Методы качественного анализа» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №17 «Непредельные углеводороды» Краткое содержание лекции
- •Диеновые углеводороды (алкадиены, или диолефины)
- •Непредельные углеводороды ряда ацетилена (алкины)
- •Cабактың кыскаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 18 «Производные ациклических углеводородов. Галогенопроизводные»
- •Лекция № 29 «Полимерные композиции»
- •Лекцияның қысқаша мазмұны
- •Задание наСрс
- •Задание наСрсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 30 «Поверхностно-активные вещества» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Контрольные вопросы
- •Глоссарий
- •Литература
Глоссарий
|
№ |
Русс/каз/англ. |
Пояснение |
|
1 |
Изобарный процесс |
Процесс, протекающий при постоянном давлении |
|
Изобарлық процесс | ||
|
Isobar process | ||
|
2 |
Теплота сгорания |
Тепловой эффект реакции окисления |
|
Жану жылуы | ||
|
Combustion heat | ||
|
3 |
Теплота образования |
Тепловые эффекты реакция образования 1 моля соединения из простых веществ |
|
Түзілу жылуы | ||
|
Formation heat | ||
|
4 |
Энтальпия |
Функция состояния |
|
Энтальпия | ||
|
Enthalpy | ||
|
5 |
Интенсивные параметры |
Независящие от количества вещества |
|
Интенсивтік параметрлер | ||
|
Intensive parameters | ||
|
6 |
Термохимия |
Изучает теплоту химических реакций |
|
Термохимия | ||
|
Thermalchemistry | ||
|
7 |
Экстенсивные параметры |
Пропорциональны количеству вещества системы |
|
Экстенсивтік параметрлер | ||
|
Extensive parameters |
Литература
Основная
2. Пащенко А.А. Физ. химия силикатов. – М.: «Высшая школа», 1986. – 368 с.
Дополнительная
2. Киреев В.А. Краткий курс физической химии. – М.: «Химия», 1978. – 622с.
Лекция № 3 Продолжение темы: «Законы термодинамики» Краткое содержание лекции
Критерии осуществимости процесса в том или ином направлении устанавливаются вторым законом термодинамики. Второй закон определяет, какие из процессов в рассматриваемой системе при заданных температуре, давлении, концентрацияхмогут протекать самопроизвольно, каково количество работы, которая может быть получена при этом, и каков предел возможного самопроизвольного течения процессов, т.е. каково состояние равновесия в данных условиях. Второй закон дает возможность определить далее, какими должны быть внешние условия, чтобы интересующий нас процесс мог происходить в нужном нам направлении и в требуемой степени. С помощью второго закона можно определить количество работы, необходимой для проведения процесса, и зависимость этого количества от внешних условий.
Все это имеет большое значение как для исследования теоретических проблем физической химии, так и для решения различных задач прикладного характера.
Второй закон (начало, принцип) термодинамики, как и первый, был установлен как постулат, обоснованный опытным материалом, накопленным человечеством; доказательством второго закона служит то, что свойства термодинамических систем не находятся в противоречии ни с ним самим, ни с каким-либо из следствий, строго вытекающих из него. Второй закон был изложен в работах Клаузиуса (1850) и В. Томсона (Кельвин) (1851). Можно дать разные формулировки второго закона, по существу равноценные.
В качестве исходного постулата можно принять следующее утверждение:“теплота не может переходить сама собой от более холодноготела к более теплому”,высказанное в несколько иной форме М. В. Ломоносовым еще в 1747 г. Постулатом может служить и утверждение, чтоневозможен процесс, единственным результатом которого было бы превращение теплоты в работу,или утверждение, чтоневозможно построить такую машину (такой вечный двигатель второго рода), все действие которой сводилось бы к производству работы и соответствующему охлаждению теплового источника.
Следует пояснить смысл этих утверждений. Вообще переход теплоты в работу, конечно, возможен. Работа может получаться при переходе теплоты от тела с более высокой температурой к телу с более низкой температурой, так как такой процесс может совершаться самопроизвольно. Это осуществляется при работе любойтепловой машины, т.е. машины, производящей работу за счет теплоты поглощаемой от какого-то тела (теплоотдатчика). Но в этом случае (рис. 2) не вся теплота q1
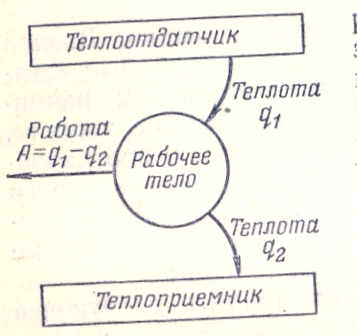
Рис.2. Схема перехода теплоты в работу.
получаемая рабочим телом, превращается в работу, а лишь некоторая часть ее А = q1— q2. Другая же часть теплоты q2 переходит к телу, имеющему более низкую температуру (теплоприемнику). Таким образом, работа такой машины заключается не только в получении теплоты q1 от теплоотдатчика и совершении работы А, но и в одновременной передаче некоторого количества теплоты q2 теплоприемнику с более низкой температурой. Если бы это не было необходимым, то можно было бы использовать для производства работы колоссальные природные запасы энергии, которые заключаются, например, в воде океанов. Однако необходимость располагать для этого теплоприемником с температурой более низкой, чем температура воды в океане, естественно, ограничивает такую возможность.
Отношение количества произведенной работы А к количеству теплоты q1, полученной рабочим телом от теплоотдатчика
η= А1 /q1 = (q1— q2)/q1 (1.5)
называется термодинамическим коэффициентом полезного действия (сокращенно — к.п.д.). Пользуясь этой величиной, можно дать второму началу формулировку:
наибольший коэффициент полезного действия тепловой машины не зависит or природы и вида тел и веществ, участвующих в работе машины, а только от температур теплоотдатчика и теплоприемника.
Второй закон термодинамики дает возможность показать вполне строго, что коэффициент полезного действия основного термодинамического цикла равен
η=(Т1-Т2)/Т1
Он однозначно определяется температурами теплоприемника и теплоотдатчика и не зависит от вида вещества. Используя это соотношение, как показал В.Томсон (Кельвин), можно построить температурную шкалу, не зависящую от вида какого-нибудь термометрического вещества, Она практически совпадает со шкалой, построенной на основе законов идеальных газов.
Энтропия.
Теплоту, как и работу, можно определять двумя величинами — фактором интенсивности и фактором емкости. Фактором интенсивности в процессах перехода теплоты является температура, так как возможность и направление самопроизвольного перехода теплоты от одного тела к другому зависят только от соотношения их температур. Для процессов, происходящих при постоянной температуре, количество передаваемой теплоты q должно равняться произведению фактора интенсивности (температуры Т) на фактор емкости, который, очевидно, может быть выражен величиной q/T (эту величину называют приведенной теплотой). Для обратимых процессов эта величина не зависит от пути перехода и всецело определяется начальным и конечным состоянием системы.
В середине XIX века Клаузиус на основе второго закона термодинамики показал, что существует такая величина (такая термодинамическая функция), которая является функцией состояния и изменение которой для обратимого изотермического перехода теплоты равно приведенной теплоте процесса. Эта величина получила название энтропии и обозначается буквой S. Согласно предыдущему, для обратимого изотермического процесса перехода теплоты
ΔS=q/T (1.6)
и для обратимого перехода бесконечно малого количества теплоты δq
dS=δq/T (1.7)
Энтропия является функцией состояния, следовательно, бесконечно малое изменение выражается полным дифференциалом dS.
Изменение энтропии в каком-нибудь процессе зависит только от начального и конечного состояний и не зависит от пути перехода.
Для перехода из какого-нибудь состояния 1 в состояние 2 изменение ее ΔS определяется уравнением
ΔS=S2-S1 (1.8)
Мы видели, что в уравнении первого начала (1.3)
δq = dU + δA
δq и δA не являются полными дифференциалами. Разделив это выражение на Т, для обратимых процессов получим
δq/Т=dS=( dU + δA)/T (1.9)
в котором dS является полным дифференциалом. Следовательно, абсолютная температура служит интегрирующим делителем уравнения. Из уравнения (1.9) можно получить:
dU=TdS - δA
Это уравнение служит аналитическим выражением первого и второго закона для обратимых процессов. Так как dU и dS являются полными дифференциалами, то и δA здесь (т.е. в обратимых условиях) от пути не зависит.
Наиболее просто ΔS определяется для обратимых изотермических процессов. Согласно уравнению (1.6), в обратимых изотермических процессах изменение энтропии равняется тепловому эффекту процесса, деленному на абсолютную температуру. Так, зная, что при 0°С теплота плавления льда Lпл.= 1436,3 кал/моль, легко определить, что возрастание энтропии при плавлении льда при этой температуре ΔS = 1436,3/273,15 = 5,2583 кал/(°С·моль). (В физико-химических работах энтропия обычно выражается в кал/(°С·моль); эту единицу сокращенно часто называют энтропийной единицей и обозначают э.е.)
Необратимые процессы.
Как было указано, обратимые процессы протекают последовательно через ряд состояний равновесия. Самопроизвольное же течение процесса всегда связано с его необратимостью. Необратимыми в термодинамическом смысле называются такие процессы, после протекания которых систему уже нельзя вернуть в начальное состояние без того, чтобы не осталось каких-нибудь изменений в ней самой или в окружающей среде. Так, переход теплоты от более горячего тела к более холодному является процессом необратимым, и нельзя провести его в обратном направлении, не затрачивая на это работы.
Для некоторых простых необратимых процессов легко показать, что в изолированных системах течение их сопровождается возрастанием энтропии системы. Покажем, например, что переход теплоты от горячего тела к холодному сопровождается возрастанием энтропии.
Рассмотрим изолированную систему из двух тел А и В, обладающих различной температурой (ТА и ТВ); допустим, что ТА>ТВ. Приведем эти тела в соприкосновение между собой, и пусть некоторое количество q теплоты перешло от тела А к телу В, причем никаких других изменений в системе не произошло. Пусть это количество теплоты q настолько мало, что температуры обоих тел остаются практически постоянными. Для тела А этот переход вызвал изменение его энтропии, равное S2,А - S1,А= - q/ТА, а для тела В — изменение энтропии, равное S2,В — S1,В = q/ТВ. Общее изменение энтропии системы равно сумме этих изменений, т.е.
S2,А— S1,А+ S2,В — S1,В= q/ТВ—q/ТА= q( ТВ— ТА)/ ТА ТВ
Так как по условию ТА>ТВ , то правая часть уравнения, а следовательно, и левая его часть больше нуля. Левую часть уравнения можно написать в виде (S2,А+ S2,В)—(S1,А+S1,В), т.е. она представляет общее изменение энтропии системы, равное разности между энтропией системы из тел А и В после процесса (S2,А+ S2,В) и энтропией (S1,А+S1,В) той же системы до процесса. Следовательно, переход теплоты от более горячего тела к холодному в изолированных системах сопровождается возрастанием энтропии системы.
Можно показать, что и переход газа из сосуда с большим давлением в сосуд с меньшим давлением и другие необратимые процессы при протекании их в изолированных системах всегда сопровождаются возрастанием энтропии системы.
Второй закон термодинамики устанавливает, что в любом цикле, включающем необратимые процессы
∫δq/Т<0 (1.10)
Из этого отнюдь следует, что изменение энтропии в цикле, включающем необратимые процессы, не равно нулю. Энтропия является функцией состояния, и изменение ее не зависит от условий проведения процесса и, в частности, от его обратимости. Если система вернулась в исходное состояние, а это является условием кругового процесса, то ее энтропия всегда принимает исходное значение, и, следовательно, изменение энтропии равно нулю. Но теплота процесса зависит от условий его проведения, и неравенство ∫δq/Т<0, означает что при необратимом процессе становится неприменимым равенство dS=δq/T и вместо него будет справедливо неравенство dS>δq/T.
Характеристические функции и термодинамические потенциалы.
Характеристической функцией называется такая функция состояния системы, посредством которой или ее производных могут быть выражены в явной форме термодинамические свойства системы. Наиболее широко в термодинамике используются следующие пять характеристических функций: изобарно-изотермический потенциал, изохорно-изотермический потенциал, внутренняя энергия, энтальпия и энтропия.
Первые четыре из них объединяются также общим названием термодинамических потенциалов. Впрочем, этот термин применяют нередко и в более узком смысле, обозначая им только оба изотермических потенциала или даже только первый из них.
Для процессов, происходящих при постоянной температуре, можно получить для конечного изменения:
А![]() =T(S2-S1)-(U2-U1)
=T(S2-S1)-(U2-U1)
или
А![]() =(U1-ТS1)-(U2-ТS2)
(1.11)
=(U1-ТS1)-(U2-ТS2)
(1.11)
Здесь, как и прежде, знак равенства относится к обратимому процессу и определяет, следовательно, максимальную работу АМ. Последнее соотношение показывает, что в изотермических условиях максимальная работа процесса АМ может рассматриваться как разность значений функции (U — TS) в начальном и в конечном состояниях системы.
Функция (U — TS) играет большую роль при изучении равновесия в изотермических процессах. Ее называют изохорно-изотермическим потенциалом (сокращенно — просто изохорным потенциалом) или энергией Гельмгольца. Мы будем обозначать ее через F:
F=U-TS (1.12)
При этом для всякого изотермического процесса
dF=dU-TdS
ΔF=ΔU-TΔS (1.13)
и максимальная работа в изотермическом процессе
АМ= –ΔF (1.14)
Изменения энтропии, как мы видели, определяют направление и предел течения самопроизвольных процессов для изолированных систем. Подобно этому наша новая функция определяет их для систем, находящихся при постоянных температуре и объёме.
Близкой к изохорному потенциалу является функция, определяющая направление и предел самопроизвольного протекания процессов для систем, находящихся при постоянных температуре и давлении. Эта функция называется изобарно-изотермическим потенциалом (сокращенно — изобарным потенциалом), или энергией Гиббса, обозначается через G и определяется как
G=H-TS (1.15)
Или
G=U-TS+pV (1.16)
а также
G=F+pV (1.17)
т.е. G находится в таком же отношении к функции F, как энтальпии Н к внутренней энергии U.
Для любого процесса ΔG=ΔF+Δ(pV).
Для изобарного процесса отсюда следует:
ΔG=ΔF+pΔV (1.18)
Для всякого изотермического процесса
dG=dH-TdS
ΔG=ΔH-TΔS (1.19)
Максимальной полезной работой АМ′ изотермического процесса называют величину
АМ′=–ΔG (1.20)
Согласно уравнениям (1.14 и 1.18):
АМ′= АМ– pΔV (1.21)
т.е. максимальная полезная работа АМ′ равна максимальной работе АМ за вычетом работы против внешнего давления.
Ввиду полной аналогии в свойствах обоих изотермических потенциалов F и G в дальнейшем мы будем их рассматривать параллельно.
Полные дифференциалы этих функций определяются соотношениями:
dF=dU-TdS-SdT (1.22)
dG=dU-TdS-SdT+pdV+Vdp (1.23)
Подставив в них выражение dU, получим:
dF![]() –SdT–pdV
(1.24)
–SdT–pdV
(1.24)
dG![]() –SdT+Vpd
(1.25)
–SdT+Vpd
(1.25)
Здесь, как и раньше, знак равенства относится к равновесиям и к обратимым процессам, а неравенства — к необратимым. Эти соотношения показывают, что для изохорно-изотермических процессов, т. е. при dV=0 и dT=0
dF![]() 0
(1.26)
0
(1.26)
а для изобарно-изотермических процессов, т.е. при dp=0 и dT=0
dG![]() 0
(1.27)
0
(1.27)
Следовательно, в системах, находящихся при постоянных температуре и объеме, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением F, причем пределом их протекания, т.е. условием равновесия, является достижение некоторого минимального для данных условий значения функции F, т.е. условие
dF=0
d2F>0 (1.28)
В системах же, находящихся при постоянных температуре и давлении, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением G, причем пределом их протекания, т.е. условием равновесия служит достижение некоторого минимального для данных условий значения функции G, т.е. условие
dG=0
d2G>0 (1.29)
Все это не означает, конечно, что процессы, сопровождающиеся возрастанием G, не могут происходить при постоянной температуре и давлении. Но такие процессы происходят лишь по мере получения работы извне, например путем электролиза или с помощью электрического разряда в газах (что требует затраты и обоих случаях электрической энергии) или действием света в фотохимических реакциях. В частности, так происходит фотосинтез в растениях.
Возможность самопроизвольного течения процесса и состояние равновесия в системах, находящихся при других условиях, определяются изменением других термодинамических величин.
