
- •Казахская головная
- •Оглавление
- •Предисловие
- •Лекция № 1 «Общие сведения о предмете»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 2 «Законы термодинамики» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция № 3 Продолжение темы: «Законы термодинамики» Краткое содержание лекции
- •Сабақтын қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература:
- •Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 5 «Коллоидные системы»
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Список литературы
- •Лекция № 6 «Получение коллоидно-дисперсных систем» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Лекция № 7 «Строение лиофобных золей» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 8 «Коллоидно-химическая теория схватывания и твердения вяжущих веществ»
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Cабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №10 «Фазовые равновесия в однокомпонентных системах» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция №11 «Фазовые равновесия в двухкомпонентных системах. Диаграмма состояний двухкомпонентной системы с эвтектикой без твердых растворов и химических соединений» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы:
- •Литература
- •Лекция №12 « Диаграмма состояния двухкомпонентной системы с химическим соединением»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 13 «Основы аналитической химии» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 14 «Количественная характеристика растворов» Краткое содержание лекции
- •Лекцияның қысқаша мазмұны
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 15 «Методы качественного анализа» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №17 «Непредельные углеводороды» Краткое содержание лекции
- •Диеновые углеводороды (алкадиены, или диолефины)
- •Непредельные углеводороды ряда ацетилена (алкины)
- •Cабактың кыскаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 18 «Производные ациклических углеводородов. Галогенопроизводные»
- •Лекция № 29 «Полимерные композиции»
- •Лекцияның қысқаша мазмұны
- •Задание наСрс
- •Задание наСрсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 30 «Поверхностно-активные вещества» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Контрольные вопросы
- •Глоссарий
- •Литература
Лекция № 7 «Строение лиофобных золей» Краткое содержание лекции
Своим происхождением заряды коллоидных частиц обязаны адсорбционным процессам: заряд появляется у частицы вследствие того, что частица данного коллоида преимущественно адсорбирует из раствора того или иного вида в зависимости природы коллоидного вещества от условий опыта.
Из находящихся в растворе ионов электролита частицы коллоида предпочтительно адсорбируют ионы одного вида и вследствие этого приобретают определенный по знаку заряд. Так как весь этот комплекс, состоящий из частиц дисперсной фазы вместе с адсорбированными ими ионами и частью связанных с ними противоионов (т. е. ионов противоположного знака), передвигается в растворе как единое целое, то этот комплекс принято называть частицей (или гранулой), а ту часть его, на которой адсорбируются ионы, — ядром частицы.
Противоионы, находясь в окружающем объеме раствора, притягиваются заряженной частицей и в той или другой степени концентрируются около нее. При этом, как указывалось, часть их, находящаяся в непосредственной близости к ядру, притягивается сильнее и удерживается частицей при ее передвижении по раствору. Все сочетание из частицы и остающейся части противоионов называется мицеллой.
Рассмотрим строение мицеллы. Пусть имеется золь кремневого ангидрида (иначе называемый также золем кремниевой кислоты). Ядро каждой частицы этого золя состоит из ангидрида кремневой кислоты SiO2, причем число молекул, содержащихся в каждом ядре, очень велико. Обозначим через m среднее число молекул в ядрах золя. Поверхность ядра, реагируя с окружающей водой, образует молекулы кремниевой кислоты H2SiО3. Пусть образуется n таких молекул, причем n во много раз меньше, чем m. Практически все анионы этой кислоты SiO3- - (х ионов) и все недиссоциированные молекулы H2SiO3 (n-х молекул), адсорбированные ядром, образуют совместно с ним частицу, а 2х иона водорода находятся в растворе, окружающем частицу, концентрируясь вокруг нее.
Строение мицеллы рассматриваемого золя мы могли бы представить формулой:
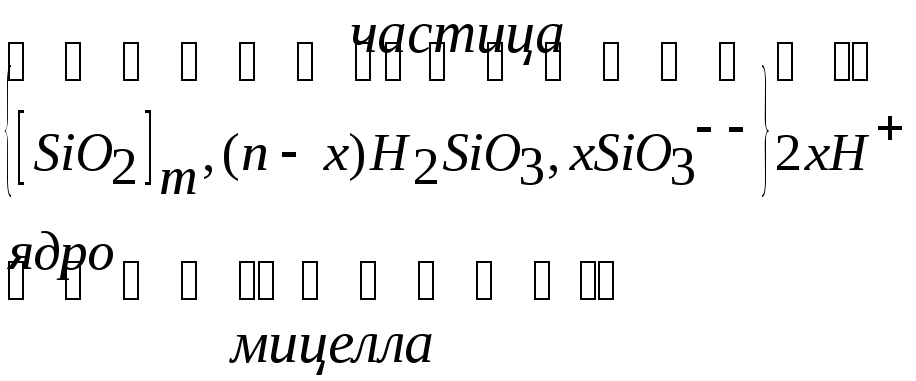
Иногда условно допускают, что все молекулы H2SiO3 диссоциированы на ионы, что все n ионов SiO3- - адсорбированы ядром и что часть ионов водорода в количестве 2(n-x) входит в адсорбционный слой, а следовательно, и в состав частицы, не связываясь, однако, с определенными ионами, а 2х ионов водорода находятся в растворе. Строение мицеллы, отвечающие этой модели, представлено на рис. 4 на котором ядро ограничено малой

Рис. 4. Строение мицеллы
окружностью, а частица –второй, большой окружностью. Мы видим, что ионы SiO3- - и Н+ содержащиеся в адсорбционном слое, располагаются в пространстве закономерно, образуя так называемый двойной электрический слой.
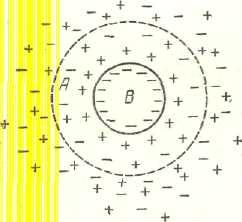
Рис.5. Двойной диффузный слой.
Противоионы концентрируются вокруг частицы, образуя диффузный слой как показано на рис. 5. При перемещении частицы по объему дисперсионной среды или при перемещении последней относительно частицы некоторая часть противоионов вместе с прилегающим небольшим объемом А дисперсионной среды остаются связанные с частицей; остальные же противоионы перемещаются вместе с дисперсионной средой.
Сольватация частиц лиофобных золей в основном обусловлена наличием у них заряда подобно тому, как в растворах электролитов заряд ионов является одной из основных причин их сольватации. При этом большая величина заряда частиц приводит к более сильной поляризации связываемых молекул и соответствующему изменению других свойств их. В водных растворах такие дополнительно поляризованные молекулы воды способны сильнее связывать другие молекулы воды, в некоторой степени усиливая и их поляризацию. Конечно, сольватация зависит не только от зарядов частицы, но и от их химического состава.
