
- •Казахская головная
- •Оглавление
- •Предисловие
- •Лекция № 1 «Общие сведения о предмете»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 2 «Законы термодинамики» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция № 3 Продолжение темы: «Законы термодинамики» Краткое содержание лекции
- •Сабақтын қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература:
- •Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 5 «Коллоидные системы»
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Список литературы
- •Лекция № 6 «Получение коллоидно-дисперсных систем» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Лекция № 7 «Строение лиофобных золей» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 8 «Коллоидно-химическая теория схватывания и твердения вяжущих веществ»
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Cабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №10 «Фазовые равновесия в однокомпонентных системах» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция №11 «Фазовые равновесия в двухкомпонентных системах. Диаграмма состояний двухкомпонентной системы с эвтектикой без твердых растворов и химических соединений» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы:
- •Литература
- •Лекция №12 « Диаграмма состояния двухкомпонентной системы с химическим соединением»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 13 «Основы аналитической химии» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 14 «Количественная характеристика растворов» Краткое содержание лекции
- •Лекцияның қысқаша мазмұны
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 15 «Методы качественного анализа» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №17 «Непредельные углеводороды» Краткое содержание лекции
- •Диеновые углеводороды (алкадиены, или диолефины)
- •Непредельные углеводороды ряда ацетилена (алкины)
- •Cабактың кыскаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 18 «Производные ациклических углеводородов. Галогенопроизводные»
- •Лекция № 29 «Полимерные композиции»
- •Лекцияның қысқаша мазмұны
- •Задание наСрс
- •Задание наСрсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 30 «Поверхностно-активные вещества» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Контрольные вопросы
- •Глоссарий
- •Литература
Глоссарий
|
№ |
Русс/каз/англ. |
Пояснение |
|
1 |
Алканы |
Алифатические предельные углеводороды, в молекулах которых атомы углерода связаны между собой одинарной δ-связью |
|
Алкандар | ||
|
Alkanes | ||
|
2 |
Гомологический ряд |
Ряд родственных органических соединений с близкими химическими и закономерно изменяющимися физическими свойствами |
|
Гомологтар қатары | ||
|
Homologous series | ||
|
3 |
Изомеры |
Это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение и поэтому обладают разными свойствами |
|
Изомерлер | ||
|
Isomers | ||
|
4 |
Нефть |
Один из основных видов природного органического сырья |
|
Мұнай | ||
|
Petroleum | ||
|
5 |
Электронные спектры |
Спектры поглощения в УФ и видимой областях связанные электронными переходами |
|
Электрондық спектрлер | ||
|
Electronic spectrums | ||
|
6 |
Углеводороды |
Органические соединения, молекулы которых построены только из двух элементов – углерода и водорода |
|
Көмірсутектер | ||
|
Hydrocarbons |
Литература
Основная:
1. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003. – 605 с.
Дополнительная:
3. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 1987. – 430 с.
Лекция №17 «Непредельные углеводороды» Краткое содержание лекции
Значение и применение полимеров непредельных углеводородов в различных отраслях промышленности очень важно.
Алкены, или олефины* - алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в соей молекуле меньшее количество водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельнымиилиненасыщенными.
Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4. строение его молекулы можно выразить структурной формулой:
Н Н
\ /
С = С
/ \
Н Н
В молекуле этилена, в отличие от молекул предельных углеводородов, атом углерода находится во втором валентном состоянии, т.е. в состоянии sp2-гибридизации. В этом случае одна из трехsp2-гибридных орбиталей перекрывается с такой же орбиталью второго углеродного атома. В результате образуется углерод-углеродная σ-связь. Две другие гибридные орбитали углеродных атомов, перекрываясь с 1s-орбиталями атомов водорода, образуют четыре σ-связи С-Н. Они расположены относительно друг от друга под углом 120°. В то же время каждый из углеродных атомов в состоянииsp2-гибридизации сохраняет еще по одной неизменной (негибридизованной) 2р- орбитали. Их оси расположены перпендикулярно плоскости гибридных орбиталей (рис. 12). Перекрываясь друг с другом, эти орбитали образуют качественно новую связь – π-связь.
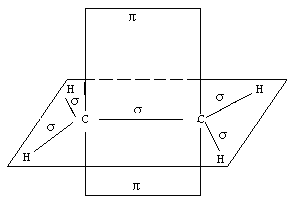
Рис. 12. Схема расположения σ- и π-связей в молекуле этилена
Номенклатура.По систематической номенклатуре родовое название этиленовых углеводородов –алкены. Названия отдельных гомологов по этой номенклатуре производят заменой суффикса–анв соответствующих алканах на суффикс–ен(этан – этен, пропан – пропен, бутан – бутен и т.д.). выбор главной цепи и порядок названия сохраняются те же, что и для алканов. Однако в состав цепи должна обязательно включатся двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
5 4 3 2 1 4
Н3С – СН – СН = СН – СН3Н3С
| \3 2 1
СН3СН – С = СН2
/ |
Н3С СН3
4-метилпентен-2 2,3-диметилбутен-1
Получение. Из лабораторных способов получения можно отметить следующие:
Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи (реакция элиминирования)
Н2С – СН2→ Н2С = СН2+ КСl+H2O
| |
Н
НО
Cl
K
-
Гидрирование ацетилена в присутствии катализатора (Pd)
H – C ≡C – H + H2
![]() Н2С = СН2
Н2С = СН2
Дегидратация спиртов. В качестве катализатора используют кислоты (серную или фосфорную) или Al2O3при нагревании (350 – 400 °C)
![]()
| |
Н
ОН
этиловый спирт
Химические свойства.Алкены в отличии от алканов обладают высокой химической активностью. Их свойства определяются двойной углерод-углеродной связью, состоящей из σ-и π-связей. π-Связь как наименее прочная и более доступная при действии реагента разрывается, а освободившиеся валентности атомов углерода затрачиваются на присоединение атомов, из которых состоит молекула реагента:
σ σ
\ / \ /
С = С + А – В → С – С
π
А В
Из этой схемы видно, что двойная связь разрывается как бы наполовину: σ-связь сохраняется, а π-связь переходит в две одинарные σ-связи (С-А и С-В). Таким образом, для алкенов наиболее типичны реакции присоединения. Алкены вступают также в реакции полимеризации и окисления.
