
- •Казахская головная
- •Оглавление
- •Предисловие
- •Лекция № 1 «Общие сведения о предмете»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 2 «Законы термодинамики» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция № 3 Продолжение темы: «Законы термодинамики» Краткое содержание лекции
- •Сабақтын қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература:
- •Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 5 «Коллоидные системы»
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Список литературы
- •Лекция № 6 «Получение коллоидно-дисперсных систем» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Лекция № 7 «Строение лиофобных золей» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 8 «Коллоидно-химическая теория схватывания и твердения вяжущих веществ»
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Cабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №10 «Фазовые равновесия в однокомпонентных системах» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция №11 «Фазовые равновесия в двухкомпонентных системах. Диаграмма состояний двухкомпонентной системы с эвтектикой без твердых растворов и химических соединений» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы:
- •Литература
- •Лекция №12 « Диаграмма состояния двухкомпонентной системы с химическим соединением»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 13 «Основы аналитической химии» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 14 «Количественная характеристика растворов» Краткое содержание лекции
- •Лекцияның қысқаша мазмұны
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 15 «Методы качественного анализа» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №17 «Непредельные углеводороды» Краткое содержание лекции
- •Диеновые углеводороды (алкадиены, или диолефины)
- •Непредельные углеводороды ряда ацетилена (алкины)
- •Cабактың кыскаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 18 «Производные ациклических углеводородов. Галогенопроизводные»
- •Лекция № 29 «Полимерные композиции»
- •Лекцияның қысқаша мазмұны
- •Задание наСрс
- •Задание наСрсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 30 «Поверхностно-активные вещества» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Контрольные вопросы
- •Глоссарий
- •Литература
Литература
Основная:
2. Пащенко А.Л. Физ. химия силикатов. – М.: «Высшая школа», 1986. – 368 с.
Дополнительная:
4. Горшков В.С. и др. Физическая химия силикатов и других тугоплавких соединений. – М.: «Высшая школа», 1988. – 336 с.
2. Киреев В.А. Краткий курс физической химии. – М.: «Химия», 1978. – 622 с.
Лекция №11 «Фазовые равновесия в двухкомпонентных системах. Диаграмма состояний двухкомпонентной системы с эвтектикой без твердых растворов и химических соединений» Краткое содержание лекции
Фазовые равновесия в двухкомпонентных системах
Для двухкомпонентной конденсированных систем, без учета давления как переменного параметра, правило фаз приобретает следующий вид:
F+n=2+1=3
В инвариантной точке приF = 0в равновесии будет находиться три фазы; при минимальном числе фазn = 1число степеней свободы равно двум. В качестве этих независимых переменных принимают температуру и концентрацию одного из компонентов. Диаграмму состояния можно изобразить на плоскости: на вертикальной оси откладывается температура, на горизонтальной – масс. доля, % (рис. 7). Один конец горизонтальной оси соответствует 100 % одного компонента, другой – 100 % второго компонента. Промежуточные точки на горизонтальной оси выражают любые соотношения двух компонентов. На вертикальные оси, соответствующие содержанию 100 % компонентов, наносят их температуры плавленияtA и tB(рис. 8).
Если к чистому веществу А добавлять возрастающие количества вещества В, то в соответствии с законом Рауля – Вант-Гоффа будет наблюдаться прогрессирующее понижение плавления смесей. Это же будет происходить и при добавлении вещества А к веществу В. В связи с этим простейшая диаграмма состояния двухкомпонентной системы имеет вид, представленный на рис. 8. кривые tA ЕАВ и tBЕАВ– кривые л и к в и д у с а, показывающие, при какой температуре и при каком составе расплава начинается кристаллизация компонентов А и В в зависимости от состава исходного расплава. Состав, соответствующий точке Е, называется б и н а р н о й (д в о й н о й) э в т е к т и к о й, которая характеризуется наиболее низкой температурой кристаллизации и представляет собой механическую смесь мелких кристаллов компонентов А и В определенного состава. Кристаллы эвтектики выпадают при кристаллизации всех исходных расплавов, содержащих компоненты А и В, поэтому на диаграмме имеется линияE1EABtE– э в т е к т и ч е с к а я г о р и з о н т а л ь (л и н и я с о л и д у с а), показывающая, при какой температуре происходит кристаллизация эвтектики.
Рассмотрим последовательность фазовых изменений при охлаждении исходного расплава состава m, нагретого до температурыt1(фигуративная точкаm1, рис. 8).

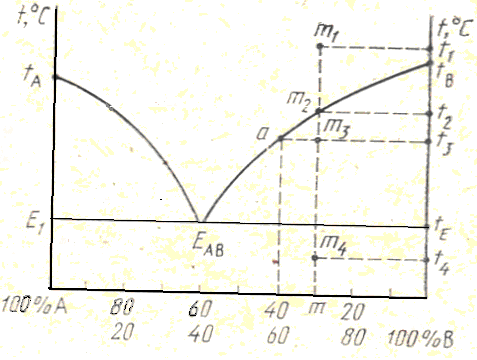
Рис.7. Диаграмма зависимости Рис.8. Диаграмма состояния
температура – концентрация двухкомпонентной системы с эвтектикой без твердых химических соединений растворов и
При температуре
t1исходная
смесь составаmпредставляет собой расплав, следовательно,
в системе имеется одна фаза. В соответствии
с правилом фаз![]() система обладает двумя степенями
свободы – можно изменять состав исходной
смеси и его температуру, число фаз при
этом не изменится. При охлаждении
исходного расплава до температурыt2(точкаm2)
выпадут первые кристаллы компонента
В; при дальнейшем охлаждении количество
выпавших кристаллов В будет увеличиваться,
а состав остающегося расплава будет
изменяться в сторону обогащения
компонентом А.Так, при температуреt3(точкаm3)
система будет состоять из двух фаз:
кристаллов В и остатков расплава. В
соответствии с правилом фаз
система обладает двумя степенями
свободы – можно изменять состав исходной
смеси и его температуру, число фаз при
этом не изменится. При охлаждении
исходного расплава до температурыt2(точкаm2)
выпадут первые кристаллы компонента
В; при дальнейшем охлаждении количество
выпавших кристаллов В будет увеличиваться,
а состав остающегося расплава будет
изменяться в сторону обогащения
компонентом А.Так, при температуреt3(точкаm3)
система будет состоять из двух фаз:
кристаллов В и остатков расплава. В
соответствии с правилом фаз![]() система имеет одну степень свободы и
при произвольном понижении температуры
строго определенным образом должен
изменяться состав остающегося расплава.
система имеет одну степень свободы и
при произвольном понижении температуры
строго определенным образом должен
изменяться состав остающегося расплава.
Горизонтальная
линия, проведенная при данной температуре
(например, t3)
от линии ликвидуса до вертикали выпадающей
твердой фазы (В), называется к о н н о д
о й. Концы конноды указывают точки
составов двух равновесных при данной
температуре фаз, следовательно, исходный
состав расплаваmпри
температуреt3(точкаm3)
распадается на кристаллы компонента В
и расплав состава точкиа.Следовательно,
при дальнейшем охлаждении системы по
мере выпадения кристаллов компонента
В состав расплава будет меняться по
кривой ликвидуса и при достижении
температурыtЕ
и эвтектического состава остаточного
расплава начнут выпадать кристаллы
двойной эвтектикиЕАВ . В связи
с наличием в системе трех фаз (кристаллы
В, кристаллы А и расплав) согласно правилу
фаз![]() ,
система становится нонвариантной и
кристаллизация эвтектики протекает
при строго определенной температуре и
составе расплава. По окончании
кристаллизации эвтектики в системе
исчезает расплав и она становится
моновариантной:
,
система становится нонвариантной и
кристаллизация эвтектики протекает
при строго определенной температуре и
составе расплава. По окончании
кристаллизации эвтектики в системе
исчезает расплав и она становится
моновариантной:![]() .
Следовательно, можно, например,
произвольно понижать температуру (рис.
8, точкаm4)
системы, число фаз при этом не изменится.
.
Следовательно, можно, например,
произвольно понижать температуру (рис.
8, точкаm4)
системы, число фаз при этом не изменится.
Итак, если фигуративная точка исходной смеси располагается выше линии ликвидуса, система представляет собой одну фазу – расплав, если фигуративная точка располагается в полях tА ЕАВ Е1 иtВ ЕАВ tЕ, то система состоит из одной твердой (А или В соответственно) и жидкой фаз; ниже линии ликвидуса система состоит из двух твердых фаз – кристаллов А и кристаллов В. Кристаллы компонентов А и В, выпавшие первоначально в поляхtА ЕАВ Е1 иtВ ЕАВ tЕ, имеют более крупные размеры, чем кристаллы А и В, выпавшие в эвтектике. Таким образом, видно, что кристаллизация (и плавление) любой смеси исходного составаm(кроме отвечающей составу эвтектики) происходит в интервале температур соответствующих точек на кривых ликвидуса и солидуса.
Диаграмма состояния двухкомпонентных систем позволяет определить не только температуры фазовых превращений и составы соответствующих фаз, но и их относительное содержание при любой температуре.
