
- •Казахская головная
- •Оглавление
- •Предисловие
- •Лекция № 1 «Общие сведения о предмете»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 2 «Законы термодинамики» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция № 3 Продолжение темы: «Законы термодинамики» Краткое содержание лекции
- •Сабақтын қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература:
- •Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 5 «Коллоидные системы»
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Список литературы
- •Лекция № 6 «Получение коллоидно-дисперсных систем» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Лекция № 7 «Строение лиофобных золей» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 8 «Коллоидно-химическая теория схватывания и твердения вяжущих веществ»
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Cабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №10 «Фазовые равновесия в однокомпонентных системах» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция №11 «Фазовые равновесия в двухкомпонентных системах. Диаграмма состояний двухкомпонентной системы с эвтектикой без твердых растворов и химических соединений» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы:
- •Литература
- •Лекция №12 « Диаграмма состояния двухкомпонентной системы с химическим соединением»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 13 «Основы аналитической химии» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 14 «Количественная характеристика растворов» Краткое содержание лекции
- •Лекцияның қысқаша мазмұны
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 15 «Методы качественного анализа» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №17 «Непредельные углеводороды» Краткое содержание лекции
- •Диеновые углеводороды (алкадиены, или диолефины)
- •Непредельные углеводороды ряда ацетилена (алкины)
- •Cабактың кыскаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 18 «Производные ациклических углеводородов. Галогенопроизводные»
- •Лекция № 29 «Полимерные композиции»
- •Лекцияның қысқаша мазмұны
- •Задание наСрс
- •Задание наСрсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 30 «Поверхностно-активные вещества» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Контрольные вопросы
- •Глоссарий
- •Литература
Литература
Основная
1. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003. – 605 с.
Дополнительная
2. Киреев В.А. Краткий курс физической химии. – М.: «Химия», 1978. – 622 с.
3. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 1987. – 430 с.
Лекция № 2 «Законы термодинамики» Краткое содержание лекции
В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям и рассматриваются главным образом:
Тепловые балансы процессов;
Фазовые равновесия для индивидуальных веществ и смесей;
Химическое равновесие.
Тепловые балансы составляются на основе первого закона (начала) термодинамики. Фазовые и химические равновесия анализируются на основе второго и третьего законов (начал) термодинамики.
Всякий объект термодинамического изучения называется системой. Совокупность тел, могущих обмениваться между собой или с другими телами энергией и веществом, называется термодинамической системой.
Первый закон термодинамики. Первый закон термодинамики непосредственно связан с законом сохранения энергии, который устанавливает эквивалентность различных форм ее. Первый закон устанавливает связь между количеством теплоты, полученной или выделенной в процессе, количеством произведенной или полученной работы и изменением внутренней энергии системы.
Ряд следствий, вытекающих из него, имеет большое значение для физической химии и для решения различных производственных задач. Расчеты энергетического и, в частности, теплового баланса, расчеты тепловых эффектов различных процессов могут быть осуществлены с помощью этого закона. Первый закон термодинамики является постулатом: он не может быть по существу доказан логическим путем, а вытекает из суммы всего человеческого опыта.
Справедливость этого закона доказывается тем, что ни одно из следствий, к которым он приводит, не находится в противоречии с опытом.
В установлении современной формы выражения первого закона термодинамики большую роль сыграли работы Г.И.Гесса (1840), Р.Майера (1842), Джоуля (1847), Гельмгольца (1847) и др.
Можно дать несколько формулировок первого закона, которые по существу равноценны одна другой. Закон сохранения энергии в применении его к термодинамическим процессам является одним из таких выражений первого закона термодинамики. Как известно, закон сохранения энергии устанавливает, что
если в каком-нибудь процессе энергия одного вида исчезает, то вместо нее появляется энергия в другой форме в количестве, строго эквивалентном первому.
Любые переходы энергии соответствуют закону эквивалентности, т.е.
разные формы энергии переходят друг в друга в строго эквивалентных, всегда одинаковых соотношениях.
Отсюда вытекает, что
в любой изолированной системе общий запас энергии сохраняется постоянным.
Так как все виды энергии являются соответствующими формами движения материи, то закон сохранения энергии выражает неуничтожаемость движения.
Поскольку работа представляет собой одну из форм перехода энергии, то из указанных положений следует невозможность создания вечного двигателя (perpetuum mobile) первого рода, т.е. такого механизма (машины), который бы давал возможность получить работу, не затрачивая на это соответствующего количества энергии. Иначе говоря,
вечный двигатель первого рода невозможен
Большое значение имеет следующая формулировка первого закона, непосредственно вытекающая из постоянства запаса внутренней энергии изолированной системы:
В
любом процессе приращение внутренней
энергии
![]() какой-нибудь системы
равно количеству q
сообщенной системе теплоты минус
количество А работы, совершённой системой
какой-нибудь системы
равно количеству q
сообщенной системе теплоты минус
количество А работы, совершённой системой
ΔU = q-A (1.2)
(все величины, разумеется, должны быть выражены в одинаковых единицах измерения). Это соотношение следует рассматривать как математическое выражение первого начала термодинамики. Пользуясь им, можно дать термодинамическое определение понятия внутренней энергии как величины, приращение которой в процессе равно сообщенной системе теплоте, сложенной с работой, совершенной над системой внешними по отношению к ней силами.
Из трех величин, входящих в соотношение (1.2), только одна — изменение внутренней энергии ΔU — однозначно определяется начальным и конечным состояниями системы и не зависит от пути перехода. Остальные же две таким свойством не обладают. Каждая из них в отдельности зависит от способа совершения процесса, хотя разность их от этого не зависит.
Для процессов, связанных лишь с бесконечно малыми применениями, ур (1.2) удобно придать вид:
dU=
![]() (1.3)
(1.3)
Закон Гесса.
Г.И.Гесс (1840) описал закон, получивший его имя и являющийся основным законом термохимии. Закон Гесса устанавливает, чтоесли из данных исходных веществ можно различными путями получить заданные конечные продукты, то независимо от путей получения, т.е. от вида промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же.
Иначе говоря,тепловой эффект химических реакций зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Закон Гесса является вполне строгим только для процессов, протекающих при постоянном объеме (когда тепловой эффект равен ΔU) или при постоянном давлении (когда тепловой эффект равен ΔН). Для этих процессов он легко выводится из общего уравнения первого начала (закон Гесса был установлен раньше, чем было введено уравнение первого начала).
Для большей наглядности в качестве исходных веществ возьмем кислород и уголь (считая его чистым углеродом), а в качествеконечного продукта СО2 (рис.1). Переход от исходных веществ к конечному можно осуществить, непосредственно сжигая уголь до СО2. Но можно также провести процесс в две стадии, получая в первой из них СО и сжигая затем СО во второй стадии до СО2. (При работе газогенераторного двигателя, например в газогенераторном автомобиле, горючее сжигается в генераторе до СО, а уже СО сгорает до СО2 в цилиндрах мотора).
Все эти три процесса находят широкое применение в практике. Закон Гесса позволяет связать тепловые эффекты этих трех процессов простым уравнением:
ΔН1=ΔН2+ΔН3
пользуясь которым легко определить один из них, если другие два известны. В нашем случае можно сравнительно легко измерить тепловые эффекты первого и третьего процессов, но сжигание угля до окиси углерода при невысоких температурах затруднительно. Поэтому возможность определить его тепловой эффект расчетным путем является весьма ценной. Из предыдущего получаем:
ΔН2=ΔН1 -ΔН3 (1.4)
Численные значения ΔН1и ΔН2 зависят от вида применяемого угля. Величина ΔН3 с этим, очевидно, не связана. Количество теплоты, выделяющейся при сгорании одного моля СО при постоянном давлении, составляет 67,636 ккал (при 25°С).
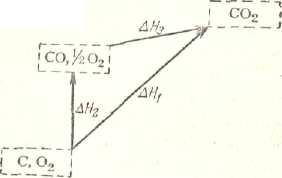
Рис.1. Схема, иллюстрирующая закон Гесса в приложении к реакции окисления угля до СО2
Пусть, например, нас интересует величина ΔН2 при 25 °С для угля, для которого при этой температуре ΔН1 равно —94,0 ккал/моль. Согласно уравнению, определяем:
ΔН2= — 94,0 + 67,6 = — 26,4 ккал/моль
Закон Гесса широко применяется при различных термохимических расчетах; он дает возможность вычислить тепловые эффекты процессов, для которых экспериментальные данные отсутствуют, а во многих случаях - и для таких, для которых они не могут быть измерены в нужных условиях, или когда процессы еще не осуществлялись. Это относится как к химическим реакциям, так и к процессам растворения, испарения, кристаллизации, адсорбции и др. Однако, применяя данный закон, следует строго соблюдать условия, лежащие в его основе.
Прежде всего необходимо, чтобы в обоих процессах были действительно одинаковы начальные состояния и действительно одинаковы конечные состояния. При этом одинаковыми должны быть не только химические составы продуктов, но и условия их существования (температура, давление и пр.) и агрегатное состояние, а для кристаллических веществ – также и кристаллическая модификация. Так, образование одного моля газообразной и одного моля жидкой Н2О из Н2 и О2 при 25 °С сопровождается выделением соответственно 57,798 и 68,317 ккал; разность составляет 10,519 ккал и равна теплоте испарения моля воды в этих условиях. При точных расчетах в случае, если какие-либо из веществ, участвующих в реакциях, находятся в высокодисперсном (т. е. сильно раздробленном) состоянии, существенной оказывается иногда даже и одинаковость степени дисперсности веществ и пр.
Очевидно, тепловой эффект будет различен также в зависимости от того, будут ли получаемые или исходные вещества находиться в чистом состоянии или в растворе, отличаясь на величину теплоты растворения.
Опытное определение тепловых эффектов.
Для определения тепловых эффектов, сопровождающих химические реакции, применяются специальные приборы, называемые калориметрами. Калориметрическое определение ведется так, чтобы вся химическая энергия выделялась в виде теплоты или частично затрачивалась па совершение внешней работы расширения газа, которая может быть учтена. Химическая реакция ведется в сосуде Дьюара. Он представляет собой стеклянный сосуд с посеребренными изнутри двойными стенками, из пространства между которыми выкачан воздух, вследствие чего стенки сосуда почти не проводят теплоты. Для более равномерного теплообмена с окружающей средой сосуд все же помещают обычно в большой термостат, наполненный водой. Во время опыта температура термостата поддерживается постоянной. Сосуд покрыт медной крышкой с тремя отверстиями: для термометра, мешалки и для пробирки. В сосуд и пробирку помещают навески реагирующих веществ, где они находятся до тех пор, пока не уравняется температура всех частей прибора. Определив температуру реагирующих веществ до начала реакции, проводят реакцию и определяют температуру в калориметре после реакции.
Зная теплоемкость системы (которая определяется предварительно), можно вычислить количество тепла, приобретенного содержимым калориметра по время реакции, и отсюда — тепловой эффект реакции.
При экспериментальном определении тепловых эффектов химических реакций возникают ошибки и неточности, обусловленные главным образом теплообменом прибора с внешней средой. Чтобы уменьшить теплообмен, ведут реакцию возможно быстрее и температуру калориметра в начале опыта поддерживают по возможности равной температуре воздуха и лаборатории. При определении изменения температуры тоже может появиться ряд неточностей. Большей частью для измерения температуры пользуются специальными калориметрическими термометрами. Кроме того, так как не весь столбик ртути находится при тойтемпературе, какая имеется в калориметре, необходимо делать поправку на «выступающий столбик». Об этих поправках, а также о предосторожностях, которые необходимо соблюдать, чтобы получить верные результаты, сказано подробно в специальных руководствах по практическому проведению термохимических измерений.
На основе калориметрических определений накоплено много данных о тепловых эффектах различных химических реакций, процессов растворения, плавления, испарения и пр.
Расчеты тепловых эффектов химических реакций.
При расчетах тепловых эффектов различных химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов — теплота образования и теплота сгорания.
Теплотой образования называется тепловой эффект реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию рассматриваемого элемента при данной температуре. Например, теплота образования 1 моль СаС03 равна тепловому эффекту реакции образования карбоната кальция в данной его кристаллической модификации из металлического кальция, углерода (в виде графита) и газообразного кислорода;
Са (м) + С (гр.) + 1½О2(г) = СаСОэ (кр)
Тепловые эффекты реакции зависят от условий проведения реакций (температуры, давления и пр.).
В настоящее время различные справочные значения тепловых эффектов и других величин относят обычно к стандартному состоянию веществ.
В
качестве стандартного состояния
индивидуальных жидких и твердых
веществ принимают состояние их при
данной температуре и
при давлении, равном 1 бар, а для
индивидуальных газов — такое
их состояние (большей частью гипотетическое),
когда при данной
температуре и давлении, равном 1 бар,
они обладают свойствами идеального
газа. Все величины, относящиеся к
стандартному состоянию веществ,
отмечают верхним индексом ° (![]() и.т.д.)
и
называют стандартными (стандартная
теплота образования, стандартная
энтальпия). В области обычных
давлений изменение давления слабо
влияет на тепловые эффекты
реакций и энтальпию веществ, так как
внутренняя энергия идеального
газа не зависит от давления, а в
конденсированном состоянии
сжимаемость веществ мала. Однако многие
другие величины,
как, например, энтропия газов, сильно
зависят от давления.
и.т.д.)
и
называют стандартными (стандартная
теплота образования, стандартная
энтальпия). В области обычных
давлений изменение давления слабо
влияет на тепловые эффекты
реакций и энтальпию веществ, так как
внутренняя энергия идеального
газа не зависит от давления, а в
конденсированном состоянии
сжимаемость веществ мала. Однако многие
другие величины,
как, например, энтропия газов, сильно
зависят от давления.
Для облегчения расчетов справочные данные относят в первую очередь к одной температуре 25,00 °С (298,15 К), принимаемой в качестве стандартной температуры. (В индексах при тех или других величинах эта температура сокращенно указывается 298.) Конечно, справочные данные даются и для других температур. Условие о стандартной температуре вполне не зависит от условия о стандартных состояниях.
Пользуясь значениями стандартных теплообразования, можно легко рассчитать тепловой эффект любой химической реакции, если известны теплоты образования всех веществ, участвующих в реакции.
Из закона Гесса следует, что тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования всех веществ, указанных в левой части уравнения (взятых, разумеется, с коэффициентами, равными коэффициентам перед формулами этих веществ в уравнении самой реакции).
Второй закон термодинамики.
Все многообразные процессы, происходящие в окружающем нас мире — в природе, в производственных и других условиях, можно разделить на 3 группы.
Процессы, для совершения которых требуется затрата работы извне в количестве, прямо пропорциональном производимому изменению.
Процессы, для течения которых не требуется затраты работы извне и в результате которых не может быть получена работа против внешних сил.
Процессы, которые могут протекать самопроизвольно, т.е. без затраты работы извне, причем в результате их может быть получена работа против внешних сил в количестве, пропорциональном происшедшему изменению.
Примерами процессов первой группы могут служить поднятие какого-нибудь тела на более высокий уровень, разложение воды действием электрического тока и т. д.
Примерами процессов второй группы являются передвижение шара по строго горизонтальной плоскости или качание маятника без трения.
К третьей группе принадлежат такие процессы, как опускание груза па более низкий уровень, взаимная нейтрализация сильной кислоты и сильного основания, любая реакция, используемая в работающем гальваническом элементе, сгорание горючего, взрыв взрывчатого вещества, ржавление железа, кристаллизация переохлажденной или вскипание перегретой жидкости, переход вещества из стеклообразного состояния в кристаллическое и др. Процессы этой группы называют положительными, в отличие от процессов первой группы, требующих затраты работы, которые называют отрицательными.
Основными положениями первого закона, как мы видели, являются утверждения о постоянстве количества внутреннейэнергии, содержащейся в какой-нибудь изолированной системе, и об эквивалентности различных форм энергии, а также соотношение, связывающее изменение внутренней энергии системы с количествами поступившей теплоты и произведенной работы. При этом первый закон не касается характера, возможности и направления тех процессов, при которых могут или будут происходить те или иные превращения энергии.
Второй закон определяет прежде всего, какие из процессов в рассматриваемой системе при заданных температуре, давлении, концентрациях и пр. могут протекать самопроизвольно (т.е. без затраты работы извне), каково количество работы, которая может быть получена при этом, и каков предел возможного самопроизвольного течения процессов, т.е. каково состояние равновесия в данных условиях.
Второй закон дает возможность определить далее, какими должны быть внешние условия, чтобы интересующий нас процесс мог происходить в нужном нам направлении и в требуемой степени. Для процессов, требующих затраты работы, с помощью второго закона можно определить количество работы, необходимой для проведения процесса, и зависимость этого количества от внешних условий.
Все это имеет очень большое значение, как для исследования теоретических проблем физической химии, так и для решения различных задач прикладного характера.
В отличие от первого закона термодинамики, второй закон обладает более ограниченной областью применения. Он носит статистический характер и применим, поэтому лишь к системам из большого числа частиц, т.е. таким, поведение которых может быть выражено законами статистики.
Существуют два термодинамических метода рассмотрения возможности и направления самопроизвольного протекания процессов, и они строго связанны между собой. Первый метод основан на том, что не только величина работы, но и величины различных форм энергии или перехода ее могут рассматриваться как произведение двух величин — фактора интенсивности и фактора емкости (или экстенсивности). Фактор интенсивности характеризует напряжение или потенциал данного вида энергии, как, например, давление газа, температура тела, потенциал электрического заряда. Для факторов интенсивности характерно, что они не зависят от количества вещества, количества электричества, объема и т. д., носящих общее название факторов емкости. Возможность, направление и предел самопроизвольного протекания процессов перехода энергии или вещества от одной части системы к другой зависят только от соотношения факторов интенсивности.
Этот метод может быть выражен следующим положением: самопроизвольное протекание процессов взаимодействия между .различными частями системы возможно только в направлении выравнивания фактора интенсивности (температуры, давления, электрического потенциала, химического потенциала и др.) для всех частей системы; достижение одинакового значения этого фактора является пределом самопроизвольного течения процесса в данных условиях и, следовательно, условием равновесия.
Этот метод неприменим к системам однородным или вообще к процессам, протекание которых не вызывается неоднородностью системы, он неприменим, в частности, к гомогенным химическим реакциям.
Второй метод является более общим, так как применим и к процессам, совершающимся в однородных системах. Он выражается следующим положением, тоже вытекающим из второго закона термодинамики: для любой термодинамической системы при данных условиях ее существования всегда имеется некоторый общий критерий, которым характеризуется возможность, направление и предел самопроизвольного протекания термодинамических процессов. Для других условий существуют другие подобные критерии. Этими критериями служат некоторые термодинамические параметры веществ, образующих данную систему и системы в целом. Например, для изолированных систем таким критерием служит термодинамический параметр, получивший название энтропии S. Для систем, находящихся при других условиях, существуют другие термодинамические параметры. Второй закон термодинамики устанавливает, что в изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно только до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Например, переход теплоты, переход газа, смешение газов также удовлетворяют этому, являясь лишь частным случаем возможных процессов. Так, переход теплоты от более горячего тела к более холодному сопровождается возрастанием суммарной энтропии взаимодействующих тел, которая достигает максимального значения, когда температуры обоих тел выравниваются.
