
- •Глава 7. Вещества, экстрагируемые органическими растворителями из щелочной среды
- •7.1.Общая характеристика веществ основного характера.
- •7.2. Физико-химические свойства алкалоидов.
- •7.3. Факторы, влияющие на степень экстракции алкалоидов.
- •7.4. Общие методы анализа алкалоидов.
- •7.5. Подтверждающие методы анализа алкалоидов и синтетических азотистых оснований.
- •7.6. Количественное определение алкалоидов.
- •7.7. Классификация алкалоидов.
- •Глава 8. Химико-токсикологический анализ алкалоидов и синтетических лекарственных веществ основного характера.
- •8.1. Производные тропана.
- •8.2. Производные фенотиазина.
- •8.3. Алкалоиды, производные морфинана (фенантренизохиналина) и их синтетические аналоги.
- •8.4. Промедол.
- •8.5. Хинин.
- •8.6. Папаверин.
- •8.7. Стрихнин.
- •8.8. Эфедрин.
- •8.9. Пахикарпин.
- •8.10. Анабазин
- •8.11. Никотин.
- •8.12. Новокаин и новокаинамид.
- •Глава 9. . Тсх- скрининг лекарственных соединений
- •9.1. Общая схема обнаружения неизвестного яда.
- •Подтверждающие исследования
- •9.2. Исследования веществ кислотного и слабоосновного характера в общих системах растворителей.
- •9.4. Исследование веществ основного характера в общих системах растворителей.
- •Глава 10. Группа веществ, изолируемых из биологического материала неполярными растворителями (ядохимикаты).
- •10.1. Классификации ядохимикатов
- •10.2. Общая характеристика ядохимикатов
- •10.3. Схема систематического анализа биологических жидкостей на основные группы пестицидов
- •10.4. Схемы изолирования некоторых групп пестицидов из биологических тканей
- •10.5. Извлечение пестицидов из биологических тканей
- •10.6. Методы определения пестицидов, выделенных из биоматериала или экологических проб
- •10.7. Фосфорсодержащие пестициды. Общая характеристика, свойства, токсикологическое значение, изолирование, анализ.
- •10.8. Хлорорганические соединения. Экологические аспекты, пробоподготовка, особенности метаболизма.
- •10.9. Карбамилы.
- •10.10. Синтетические пиретроиды. Токсикологическое значение, особенности строения, изолирования и анализа
- •10.11. Полихлорированные бифенилы
- •Глава 11. Вещества, изолируемые настаиванием исследуемых объектов с водой.
- •11.1. Серная кислота.
- •11.2. Азотная кислота.
- •11.3. Хлороводородная кислота.
- •11.4. Щелочи и аммиак.
- •11.5. Соли щелочных металлов.
- •Глава 12. Вещества, требующие особых методов изолирования.
- •12.1. Фториды.
- •12.2. Кремнефториды.
- •Глава 13 вещества, определяемые непосредственно в биоматериале.
- •13.1.Отравления монооксидом углерода.
- •13.2. Методы обнаружения и количественного определения монооксида углерода.
- •Глава 14. Методы лабораторной диагностики острых отравлений.
- •14.1. Общая характеристика методов.
- •14.3. Хроматографические методы.
- •Глава 15. Анализ питьевых, сточных вод и пищевых продуктов.
- •15.1. Особенности анализа сточных вод.
- •15.2. Методы концентрирования микропримесей.
- •15.3. Отбор и консервирование проб.
- •15.4. Основные показатели качества вод.
- •15.5. Химическое и биохимическое потребление кислорода.
- •15.6. Определение металлов.
- •15.7. Определение органических веществ.
- •15.8. Анализ пищевых продуктов.
- •Литература
- •Вопросы тестового контроля знаний студентов по токсикологической химии
- •Оглавление
- •Токсикологическая химия
- •210602, Витебск, Фрунзе 27
- •210602, Витебск, Фрунзе 27
8.2. Производные фенотиазина.
В основе химической структуры производных фенотиазина лежит шестичленный цикл с двумя гетероатомами, называемый тиазином.
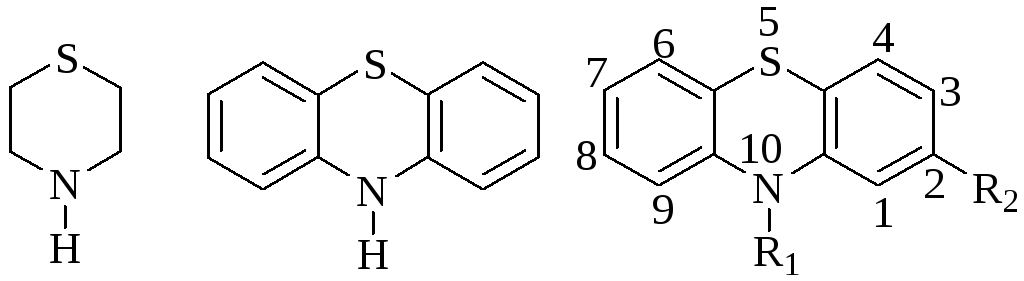
Токсикологический интерес представляет не сам тиазин, а его дибензилпроизводное - фенотиазин. Препараты фенотиазинового ряда широко применяются в медицине для лечения психических, сердечно-сосудистых и ряда других заболеваний (алкоголизм, паразитарные заболевания). Используются отдельные производные фенотиазина в качестве пестицидов, в ветеринарии и пчеловодстве.
Номенклатура применяемых за рубежом препаратов этого ряда превышает 50 наименований. Из них в нашей стране используется более 20 соединений.
Наряду с ростом потребления производных фенотиазина растет и число отравлений соединениями этого ряда - аминазином, дипразином, левомепромазином, этаперазином, адреналином и др. Отмечаются комбинированные отравления производными фенотиазина и производными барбитуровой кислоты, мепробаматом, производными 1,4- бензодиазепина. Количество отравлений производными фенотиазина достигают ежегодно 1-2% от общего числа отравлений.
При пероральном введении производные фенотиазина быстро всасываются из ЖКТ и их действие проявляется через 30-60 минут, а при парентеральном введении - через 15-20 минут. Максимум концентрации в крови наблюдается через 2-4 часа при пероральном введении и через 1-2 час – при внутривенном. Производные фенотиазина всасываются преимущественно из кишечника. Гидрофобный характер фенотиазинов способствует взаимодействию их с белками (95 –99% для аминазина). Кажущийся объем распределения для аминазина составляет 8л/кг (у левомепромазина – 30 л/кг), что указывает на локализацию производных фенотиазина в тканях органов (печень, почки, мозг). Производные фенотиазина легко проникают через гематоэнцефалический барьер.
При отравлениях производными фенотиазина наблюдаются сухость слизистых полости рта, тахикардия, падение АД, нарушение формулы крови. Летальный исход наступает от паралича центра дыхания и циркуляторной недостаточности. Секционная картина нехарактерна и в ряде случаев существенную роль играют осложнения: тяжелый бронхит, жировая дистрофия печени. Следует отметить, что производные фенотиазина проникают через плаценту и воздействуют на плод.
Количество принятых с целью самоубийства препаратов составляет, как правило, 3-5 г. Смерть наступала в период от 4 часов до 5 дней. Токсические концентрации производных фенотиазина для взрослого человека варьируют от 15 до 150 мг/кг в зависимости от структуры, возраста, пола. Наиболее чувствительны к этой группе соединений дети. Так, наблюдались случаи смерти детей до 2-3,5 лет после приема 0,025-0,125 г аминазина и дипразина.
Различают 10- алкилпроизводные, т.е. к N10 присоединена группа, состоящая из 2 – 3 углеродных атомов и диалкиламиногруппа (аминазин, дипразин, левомепромазин), ядро пиперидина (тиоридазин) – это, в основном, нейролептики (для дипразина характерна сильная противогистаминная активность). 10 – ацилпроизводные – к N10 присоединена ацильная группа и диалкиламиногруппа (этмозин, этаперазин).
Физико-химические свойства. Основания не растворяются в воде, растворяются в хлороформе, этаноле, эфире. Соли растворяются в хлороформе, воде, этаноле, но не растворяются в эфире и бензоле. Величина константы распределения основания аминазина для CHCl3/вода равна 12,3, а для соли (хлороводородной) – 16,6.
Основной характер производных фенотиазина обусловлен наличием гетероциклического атома азота (рКвн+ = 4) и третичного атома азота в алифатическом радикале (рКвн+ = 9,1 – 9,8).
Изолирование производных фенотиазина традиционными методами подкисленной водой или спиртом приводит к значительным потерям. Так, по методу А.А. Васильевой из биоматериала извлекается около 15%, а по методу В.Ф. Крамаренко только около 1,5% производных фенотиазина.
В основе современного метода изолирования фенотиазинов из биоматериала лежит модифицированный Е.М. Саломатиным метод Стаса-Отто. Выход анализируемых соединений составляет около 50%.
Производные фенотиазина изолируют из биоматериала (желудок, печень, почки) спиртом, подкисленным щавелевой кислотой. Эфиром экстрагируют примеси из кислой среды, водную фазу подщелачивают до рН 13 и экстрагируют производные фенотиазина (эфиром). Вместо спирта можно использовать ацетонитрил, что позволяет ускорить в 5-6 раз изолирование.
Для обнаружения производных фенотиазина в моче и крови 2-5 мл их подщелачивают 50% NaOH до рН=13 и смесь кипятят 10 минут. Полученный гидролизат охлаждают и экстрагируют н-гептаном, содержащим 3% изоамилового спирта. Гептановые извлечения объединяют и промывают водой, насыщенной гептаном, после чего исследуют.
В качестве предварительного теста при обнаружении фенотиазинов в моче используется реактив FPN (смесь 5% раствора FeCl3, 20% раствора HClO4 и 50% раствора HNO3 в соотношении 5:45:50). При этом 1 мл мочи смешивают с 1 мл реактива и наблюдают красное или красно-фиолетовое окрашивание (реакцию дают также салицилаты и желчные кислоты). При отрицательном результате пробы дальнейшие исследования не проводятся.
Наиболее чувствительными осадительными реактивами для производных фенотиазина являются реактив Драгендорфа и фосфорномолибденовая кислота.
Для идентификации производных фенотиазина в настоящее время широко используются физико-химические методы анализа. Наиболее доступными из них являются спектрофотометрия в УФ- и видимой областях спектра.
Хотя УФ-спектры производных фенотиазина подобны, тем не менее, они могут быть использованы для дифференцирования этих соединений. УФ- спектры производных фенотиазина характеризуются двумя максимумами: 250 – 265 нм и 300 – 315 нм. Если производные во 2-м положении не содержат заместителя или содержат метоксигруппу (дипразин, левомепромазин) максимумы наблюдаются при 250-254 нм; при наличии Cl во 2-м положении (аминазин, этаперазин, френолон) - при 255-256 нм; если во 2-м положении имеется метилмеркаптогруппа (тиоридазин) максимум наблюдается при 263 нм.
Основными метаболитами фенотиазинов являются сульфоксиды, спектральные характеристики которых в УФ-области более информативны, т.к. в отличие от нативных соединений, они имеют по 3-4 максимума абсорбции.
Так, например, УФ-спектр сульфоксида аминазина имеет 4 максимума абсорбции при =238, 274, 299 и 340 нм.
Cульфоксиды получают окислением соответствующих фенотиазинов смесью H2O2 и CH3COOH при 60С. Спектроскопия производных фенотиазина и их сульфоксидов в УФ-области позволяет идентифицировать их и дифференцировать от других групп токсикологически важных веществ.
Для целей судебно-химического исследования вещественных доказательств, биологических жидкостей и тканей человека особое значение имеют наиболее быстрые и специфические методы анализа - ТСХ и ГЖХ. Они позволяют одновременно проводить очистку, идентификацию и количественное определение исследуемых соединений.
ТСХ производных фенотиазина проводят на пластинке с закрепленным (или незакрепленным) слоем силикагеля в различных системах растворителей (метанол : н-бутанол =6 : 4; бензол : диоксан : 25% раствор аммиака = 70:25:5). Для проявления хроматограмм используют смесь 50% серной кислоты и этанола (1:1). Чувствительность реагента - 0,5-1 мкг в пятне.
В тех случаях, когда ТСХ не позволяет разделить близкие по физико-химическим свойствам производные фенотиазина наиболее оптимальным становится использование ГЖХ.
Ниже приведены наиболее характерные реакции окрашивания с производными фенотиазина. В основе реакций окрашивания лежат процессы окисления (FeCl3, HClO4 + NaNO2, реактивы Фреде, Манделина), конденсации с альдегидами в присутствии водоотнимающих средств (реактив Марки) и др. Окраска продуктов окисления зависит от радикала R2: аминазин и дипразин с окислителями дают малиновое окрашивание, левомепромазин – фиолетовое, тиоридазин – зеленое или голубое. Окраска обусловлена образованием катион-радикалов. Наиболее устойчивая окраска наблюдается в сильнокислых сернокислых растворах.
Аминазин (Хлорпромазин)
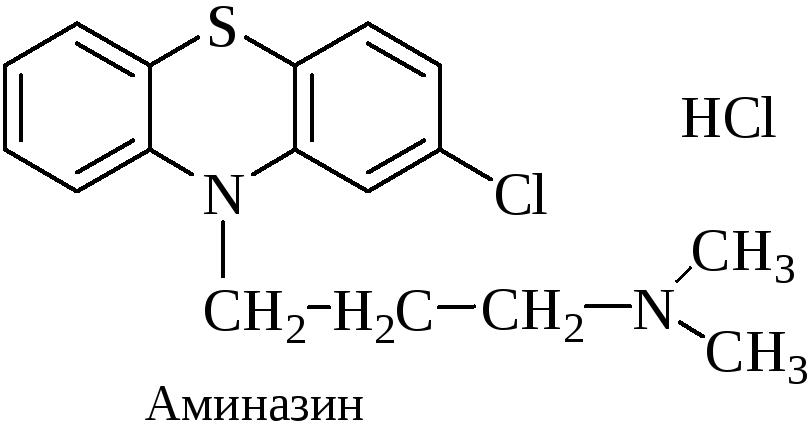
Реакции обнаружения:
С реактивом Марки (бледно-пурпурное окрашивание).
С конц. HNO3 (фиолетовое, переходящее в пурпурное и далее в красное окрашивание).
С 2% раствором FeCl3 (малиновое окрашивание).
Реакция Витали-Морена (пурпурное с фиолетовым оттенком окрашивание).
С реактивом Манделина (темно-пурпурное, быстро исчезающее окрашивание).
Дипразин (Пипольфен)
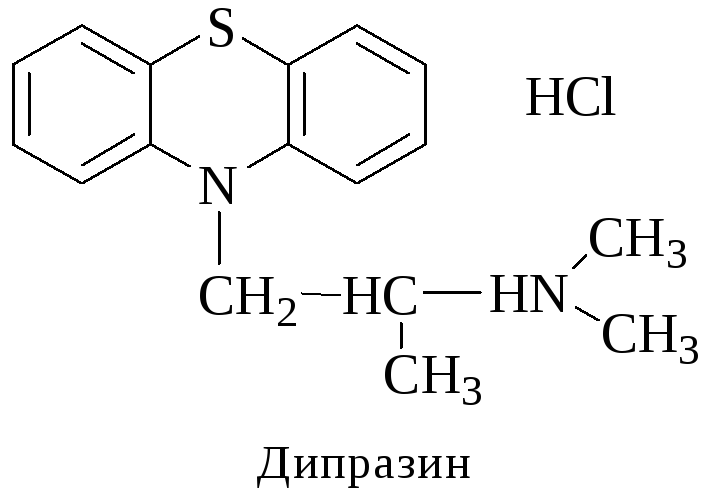
Реакции обнаружения:
С реактивом Марки (бледно-пурпурное окрашивание).
С конц. HNO3 (красно-желтое окрашивание).
С 2% раствором FeCl3 (грязно-сиреневое окрашивание).
Реакция Витали-Морена (пурпурно-фиолетовое окрашивание).
С реактивом Манделина (темно-пурпурное окрашивание).
Левомепромазин (Тизерцин)
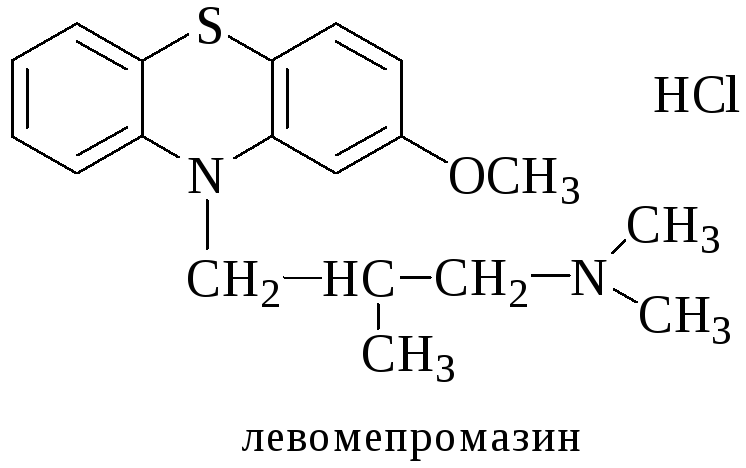
Реакции обнаружения:
С конц. H2SO4 (фиолетовое или розово-фиолетовое окрашивание).
С HClO4 и NaNO2 (фиолетовое окрашивание).
С H2PtCl6 (ярко-зеленое окрашивание).
С 2% раствором FeCl3 (розово-фиолетовое окрашивание).
С реактивом Марки (фиолетовое или розово-фиолетовое окрашивание).
Реакция Витали-Морена (красно-оранжевое окрашивание).
Тиоридазин (Сонапакс)
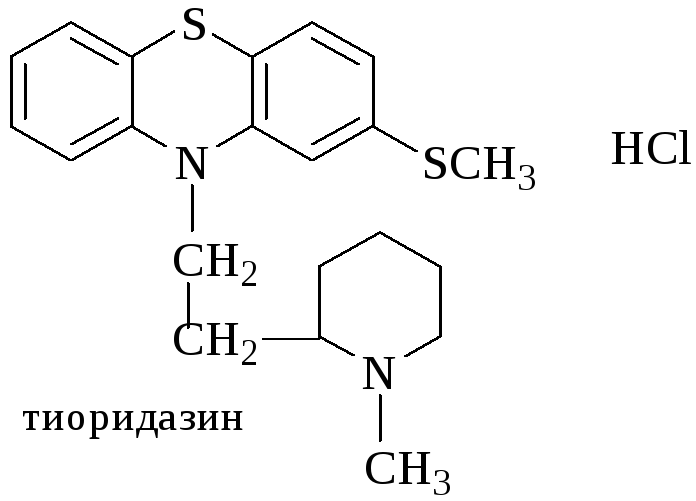
Реакции обнаружения:
С конц. H2SO4 (голубое окрашивание).
С HClO4 и NaNO2 (зелено-голубое окрашивание).
С реактивом Марки (окрашивание цвета морской волны).
С H2PtCl6 (бледно-сиреневое окрашивание).
С 2% раствором FeCl3 (голубовато-зеленое окрашивание).
Реакция Витали-Морена (пурпурное окрашивание).
Количественное определение проводят физико-химическими методами: спектроскопические (УФ- спектрофотометрия, фотометрия в видимой области спектра) и хроматографические. Для УФ- спектрофотометрического определения требуется высокая степень очистки от соэкстрактивных веществ (измерение оптической плотности проводят при 250 – 255 нм в 0,5н растворе серной кислоты).
В качестве окислителей для образования окрашенных соединений применяют концентрированную серную кислоту (при наличии соэкстрактивных веществ происходит их обугливание), реактив Манделина и конц. серная кислота; 18 % раствор HCl и 1М раствор мышьяковой кислоты (в этом способе не происходит обугливание соэкстрактивных веществ).
Для газохроматографического определения производных фенотиазина используются среднеполярные НЖФ ОV –225 (содержит 25% метильных, фенильных, цианопропильных групп), стеклянные микроколонки при 200 – 2500 С, температура инжектора – 250 – 3000С. Для регистрации наиболее подходящими являются селективные азотно-фосфорные детекторы и электронно-захватные (для хлорсодержащих соединений) детекторы. Внутренний стандарт – имизин. Одновременно метод ГЖХ позволяет проводить качественное обнаружение и количественное определение.
Метаболизм производных фенотиазина.
1.Окисление атома серы в фенотиазиновом ядре (до моно- и дисульфоксида).
2. Трансформация в радикалах R1 и R2.
В зависимости от строения радикала R2 для левомепромазина характерно О- деметилирование, а для тиоридазина – S- деметилирование.
В составе R1 тиоридазина содержится N- метилпиперидиновый цикл и в этом случае происходит N- деметилирование. Кроме того, для всех производных фенотиазина, имеющих в составе R1 диалкиламиногруппу, характерно N- деметилирование с образованием аминопроизводных, которые в последующем подвергаются дезаминированию.
3. Ароматическое гидроксилирование в положениях 3 и 7 с последующим образованием коньюгатов с глюкуроновой кислотой. Образование гидроксипроизводных зависит от радикала R2: аминазин в результате окисления образует 7- гидроксипроизводное, а левомепромазин и тиоридазин – 3,7- гидроксипроизводные.
Основные количества производных фенотиазина выводятся с мочой в виде метаболитов. Период полувыведения составляет 10 – 30 час.
