
- •В.И. Гребенькова, н.Г. Осипенкова, Голубская и.Э., Козлова е.Е. Методические указания к лабораторному практикуму по курсу «Химия»
- •Работа № 1 свойства неорганических соединений различных классов
- •Названия кислотных остатков различных кислот
- •Опыт 1. Изучение окраски индикаторов в различных средах
- •Опыт 2. Оксиды и гидроксиды активных металлов
- •Опыт 3. Оксиды и гидроксиды неметаллов
- •Опыт 3. Изучение свойств оксидов и гидроксидов металлов
- •Опыт 3а). Изучение свойств оксида меди.
- •Опыт 3б. Получение и разложение гидроксида меди
- •Опыт 4. Изучение свойств гидроксидов металлов
- •Опыт 5. Изучение химической активности кислот
- •Опыт 6. Получение малорастворимых кислот и оснований
- •Опыт 7. Получение слабодиссоциирующих оснований и кислот
- •Примеры сильных и слабых оснований
- •Опыт 8. Реакция нейтрализации
- •Опыт 9. Свойства солей
- •Опыт 9а) Взаимодействие солей с кислотами
- •Опыт 10а). Получение солей методом нейтрализации и их взаимодействия
- •Опыт 10б). Получение малорастворимых солей
- •Опыт 11. Качественные реакции на хлорид-, сульфат- и фосфат-ионы
- •Опыт 12. Исследование окраски некоторых катионов и анионов
- •Работа № 2 скорость химических реакций.
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Влияние температуры на скорость химической реакции
- •Опыт 3. Влияние катализатора на скорость химической реакции
- •Работа № 3 Химическое равновесие
- •Опыт 1. Равновесие в растворе хлорида меди
- •Смещение химического равновесия
- •Опыт 2. Влияние концентрации веществ на смещение равновесия обратимой реакции
- •Опыт 3. Влияние температуры на химическое равновесие
- •Опыт 4. Влияние реакции среды на смещение химического равновесия.
- •Бихромат-ион (оранжевый)
- •Работа № 4 Процессы, протекающие при образовании растворов
- •Опыт 1. Изменение температуры при растворении
- •Опыт 2. Изменение объема при растворении
- •Опыт 3. Изменение окраски при растворении
- •Опыт 4.Влияние типа растворителя на процесс растворения.
- •Опыт 5. Зависимость растворимости солей от температуры. Получение пересыщенных растворов
- •При сдаче лабораторной работы ответьте на следующие вопросы
- •Работа № 5 Приготовление растворов заданной концентрации
- •Опыт 1. Приготовление раствора бихромата калия k2Cr2o7 с определенной массовой долей
- •Опыт 2. Приготовление растворов серной кислоты заданной молярной и нормальной концентраций
- •Опыт 3. Определение концентрации кислоты методом титрования
- •Работа № 6 Свойства растворов электролитов
- •Опыт 1. Исследование электропроводности растворов различных веществ
- •Опыт 2. Изучение зависимости степени диссоциации веществ в растворах от их концентрации
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Работа №7 гидролиз
- •Опыт 1. Гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 2. Ступенчатый гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 3. Гидролиз солей, образованных слабым основанием и слабой летучей кислотой. Полный необратимый гидролиз
- •Количественные характеристики процесса гидролиза
- •Факторы, влияющие на степень гидролиза
- •Работа № 8 окислительно–восстановительные процессы
- •Опыт 1. Сравнительная характеристика окислительных свойств галогенов и восстановительной способности галогенидов
- •Опыт 2. Окислительно–восстановительные свойства соединений, содержащих элементы в различных степенях окисления.
- •Опыт 3. Окислительно–восстановительные свойства пероксида водорода.
- •Опыт 4б. Влияние концентрации кислоты на процесс окисления цинка серной кислотой
- •Опыт 5. Окисление меди разбавленной и концентрированной азотной кислотой
- •Опыт 6. Влияние среды на протекание окислительно–восстановительных реакций.
- •Типы овр
- •Опыт 8. Каталитическое диспропорционирование пероксида водорода.
- •Опыт 9. Реакция внутримолекулярного окисления–восстановления перманганата калия.
- •Опыт 10. Реакция межмолекулярного окисления восстановления между иодидом и иодатом калия.
- •Контрольные задания
- •Работа № 9 электрохимические процессы Химические источники тока. Опыт 1. Изготовление гальванического элемента и расчет его эдс.
- •Коррозия металлов.
- •Опыт 2. Влияние образования гальванических пар на течение химических процессов.
- •Опыт 3. Коррозия оцинкованного и луженого железа.
- •Электролиз водных растворов солей
- •Опыт 4. Электролиз раствора сульфата натрия.
- •Опыт 5. Электролиз раствора иодида калия.
- •Опыт 6. Электролиз раствора хлорида олова.
- •Опыт 7. Электролиз раствора сульфата меди.
- •Опыт 8. Электролиз раствора сульфата меди с активным (медным) анодом.
- •Работа № 10 получение комплексных соединений, изучение их свойств и методов разрушения
- •Опыт 1. Зависимость окраски аквакомплексов от типа комплексообразователя
- •Опыт 2. Зависимость окраски комплексов кобальта от типа лигандов
- •Опыт з. Ступенчатая диссоциация бромидных комплексов меди(II)
- •Получение комплексных соединений. Написание уравнений комплексообразования. Названия.
- •Опыт 4. Получение аммиаката никеля
- •Опыт 6. Получение соединения, содержащего комплексные катион и анион
- •Опыт 7. Влияние природы d–элемента на комплексообразование
- •Устойчивость комплексных соединений
- •Константы нестойкости некоторых комплексных ионов
- •Опыт 8. Влияние концентрации раствора на устойчивость комплексных соединений
- •Опыт 9. Сравнительная устойчивость хлоридных комплексов цинка и кобальта
- •Опыт 10. Сравнительная устойчивость роданидного и фторидного комплексов железа
- •Опыт 11. Разрушение комплексов
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Плотность водных растворов k2Cr2o7
- •Константы диссоциации воды и некоторых слабых кислот и оснований в водных растворах при 18 c
- •Области перехода некоторых индикаторов
- •Степень гидролиза солей (в 0,1 м растворах при 25c)
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Приборы и реактивы
- •Содержание
Опыт 1. Исследование электропроводности растворов различных веществ
Электропроводность растворов зависит от присутствия в них ионов и их концентрации. В нашем опыте она определяется по наличию свечения нити лампы накаливания и интенсивности свечения.
Выполнение опыта. Собрать установку, состоящую из двух последовательно соединенных угольных электродов, электрической лампочки и штепсельной вилки. Подготовить три стакана (емкостью 50 мл) с небольшими количествами (закрыть дно стаканов) соответственно дистиллированной воды, сахара и поваренной соли. Вставить электроды в стакан с дистиллированной водой, а вилку в штепсель (рис). Отметить, загорается ли лампочка, проводит ли вода электрический ток. Затем перенести электроды сначала в стакан с сахаром, а затем в стакан с солью. Отметить, проводят ли сухие сахар и соль ток. Далее в стаканы с сахаром и солью добавить по 20 - 30 мл воды с последующим погружением в них электродов. Отметить, загорается ли лампочка в обоих случаях. Объяснить наблюдаемые отличия.

Рис. Установка для наблюдения электропроводности растворов
Повторить опыт с 0,1 н. растворами соляной кислоты, гидроксида натрия, уксусной кислоты и гидроксида аммония (после каждого опыта промывать электроды!). Следить за изменением накала нити лампочки и сделать вывод о степени диссоциации веществ. Вылить раствор гидроксида аммония в стакан с раствором уксусной кислоты, опустить в смесь электроды, отметить изменение накала лампочки. Объяснить результаты эксперимента.
Результаты наблюдений внести в таблицу:
|
Вещество |
Результаты наблюдений |
Выводы (неэлектролит/слабый электролит/сильный электролит) | |
|
Наличие свечения (да/нет) |
Интенсивность свечения (слабое/сильное) | ||
|
Вода |
|
|
|
|
сахар |
|
|
|
|
соль |
|
|
|
|
Р-р сахара |
|
|
|
|
Р-р соли |
|
|
|
|
Р-р HCl |
|
|
|
|
Р-р NaOH |
|
|
|
|
Р-р NH4OH |
|
|
|
|
Р-р CH3COOH |
|
|
|
|
Смесь р-ров NH4OH и CH3COOH |
|
|
|
Опыт 2. Изучение зависимости степени диссоциации веществ в растворах от их концентрации
Степень диссоциации электролитов зависит от природы электролита, температуры и концентрации раствора. Для слабых бинарных электролитов зависимость от концентрации подчиняется закону разбавления Оствальда:
![]() ,
,
то есть, чем более разбавлен раствор, тем больше степень диссоциации и, соответственно, больше электропроводность раствора. Для подтверждения этой зависимости провести следующий опыт.
Выполнение опыта. В стакан налить вначале ледяную (концентрированную) уксусную кислоту, отметить отсутствие тока в системе. Затем прибавлять постепенно воду и наблюдать отклонение стрелки прибора.
Опыт повторить с серной кислотой, для чего в четыре стакана налить одинаковые примерно до половины объемы растворов серной кислоты различной концентрации: в первый – концентрированный, во второй – разбавленный водой в 25, в третий – в 50, в четвертый – в 250 раз. Собрать установку, состоящую из источника тока (2 - 4 В), амперметра (3 - 5 А) и угольных электродов (рис. 6). По очереди определить электропроводность всех четырех растворов, начиная с наиболее разбавленного.
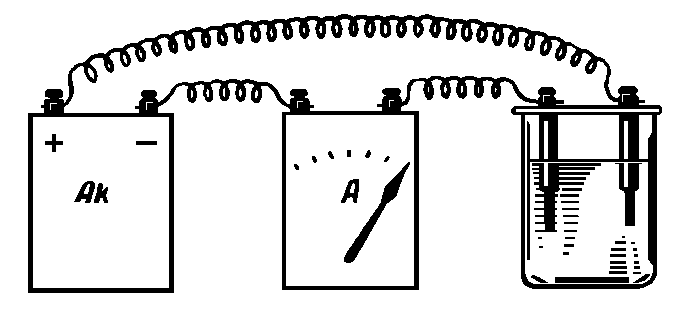
Рис. Установка для сравнения электропроводности растворов
Записать результаты опыта в виде таблицы:
|
Степень разбавления раствора серной кислоты |
показания амперметра, А |
Выводы |
|
Без разбавления |
|
|
|
1:25 |
|
|
|
1:50 |
|
|
|
1:250 |
|
|
Построить график зависимости электропроводности раствора от концентрации раствора.
