
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
6.3. Цепные реакции

Молекула A↑↓Bс ковалентной связью между атомамиАиВв активированном состоянии может распадаться на ионы:


A↑↓B→A++ ↑↓B-(а),
а также и атомы (или свободные радикалы):



A ↑↓B→A ↑ + ↓B(б)
В реакции (а)разрыв связи называетсягетеролическимили ионным, в реакции(б)гомолитическимили радикальным.
Существует два типа цепных реакций; с неразветвленными и разветвленными цепями. Примером с разветвленными цепями может служить фотохимический синтез хлорида водорода, который протекает со взрывом при облучении смеси водорода и хлора солнечным светом. Для цепных реакций характерны три стадии;
а) стадия зарождения цепи
C
 l2
+ h
l2
+ h![]() →Cl ↓ + ↑
Cl
→Cl ↓ + ↑
Cl
б) стадия развития цепи

 Cl↓ +H2
→HCl + ↓H
Cl↓ +H2
→HCl + ↓H


H↓ +Cl2 →HCl+ ↓Clи т. д.
в) стадия обрыва цепи (столкновения двух атомов)


H↓ + ↑H→H2


Cl↓ + ↑Cl→Cl2


H↓ + ↑Cl→HCl
Цепные реакции с разветвленными цепями протекают так, что каждая активная частица порождает не одну, как в неразветвленной цепи, а минимум две новые активные частицы.
Примером реакции с разветвленными цепями может служить окисление водорода, протекающее при определенных условиях по цепному механизму.
Если пропустить
через смесь равных объемов водорода и
кислорода электрический заряд (h![]() ),
то произойдет образование двух свободных
радикалов
),
то произойдет образование двух свободных
радикалов

H2 + O2 → 2 HO↓ ,
каждый из которых характеризуется высокой активностью.
Новый акт взаимодействия протекает самопроизвольно:


HO ↓ +H2→H2O+H↓ ,
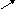

И
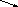
 далееH
↓ +O2
далееH
↓ +O2
 HO
↓ + H2
HO
↓ + H2

 H2O
H2O
H

 ↓ + O2
↓ + O2
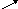


 H
↓ + O2
H
↓ + O2


 ↓O ↓ + H2
↓O ↓ + H2
 HO
↓ + H2
HO
↓ + H2
По цепному механизму протекают многие химические реакции, например, крекинг и полимеризация, образование смога в атмосфере и др.
6.4. Фазовые равновесия
Гетерогенные
равновесия, связанные с переходом
вещества из одной фазы в другую без
изменения химического состава, называются
фазовыми.К их числу можно отнести
равновесия в процессах испарения,
плавления, конденсации. Для фазовых
равновесий справедлив принципЛе
Шателье.Например,H2O(ж)
![]() H2O
(г)
H2O
(г)
Одним из наиболее общих законов гетерогенных (в том числе и фазовых) равновесий является правило фаз.Согласно этому правилу в равновесной системе число фазФ, число независимых компонентовКи число степеней свободы связаны соотношением:
С + Ф = К + n,
где n- число внешних факторов, влияющих на равновесие системы. Внешними факторами чаще всего бывают температура и давление, тогдаn = 2и уравнение принимает вид:
С + Ф = К + 2
Число термодинамических степеней свободы Сравно числу условий (T,PиС), произвольное которых в известных пределах не меняет числа и вида фаз системы.
По числу степеней свободы системы делят на инвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и поливариантные (С > 2).
К- число компонентов, равно общему числу видов молекул минус число независимых химических реакций.
Пример 1.В гетерогенной системе медь - кислород два компонента. Она состоит из четырех различных веществ:Cu, CuO, Cu2O, O2,т. е. из четырех фаз реакции:
2Cu + O2
![]() 2CuO
2CuO
4Cu + O2
![]() 2Cu2O
2Cu2O
Итак, в этой системе имеют место две реакции и число компонентов K = 4 – 2 = 2. Число степеней свободы по графику фазC = 2 + 2 – 4 = 0. Такая система существует при строго определенной температуре давления кислорода. Система инвариантна (рис.52).

Рис. 52. Схема гетерогенного равновесия
окисления меди кислородом
Пример 2.В системе из диссоциирующего карбоната кальция три фазы и два компонента:
CaCO3 → CaO (Т) + CO2 (Г)

Рис. 53. Схема обратимой реакции
диссоциации карбоната кальция
За степень свободы можно принять или температуру, или давление, т. к. эти параметры функционально связанны:
P![]() =
f1 (T);
T =f2
(P
=
f1 (T);
T =f2
(P![]() )
)
Если
![]() является только температурной функцией,
то его можно принять за константу
равновесия.
является только температурной функцией,
то его можно принять за константу
равновесия.
Пример 3.Равновесная система из твердого углерода, оксида и диоксида углерода имеет две фазы и два компонента (K = 3 – 1 = 2):
C(Г)+ CO2(Г)
![]() 2CO
(Г)
2CO
(Г)
Число степеней свободы по правилу фаз C = 2 + 2 – 2 = 2. Система бивариантная. В данной системе давлениеСО2 зависит от температуры и давления или от концентрацииСО(рис. 54).

Рис. 54. Схема равновесия между твердым
углеродом, CO иCO2
При изучении фазовых равновесий широко применяется графический метод построения диаграмм состояния.

Рис. 55. PT- диаграмма состояния воды
Например, на рис. 55 представлена диаграмма для воды в координатах Р-Т. ЛинииАОиОВограничивают область пара, линииОВиОС- область жидкости и линииАОиОС- область твердой фазы. Эта диаграмма описывает фазовые равновесия только при низком давлении.
В любой области однофазной системы С = K + 2 – Ф = 1 + 2 – 1 = 2, т. е. в таких системах можно произвольно изменять два параметра (РиТ) в некоторых пределах без изменения числа фаз. Это бивариантные системы. Для любой точки на одной из линий -ОА, ОВ, ОС, которые соответствуют равновесию двух фаз число степеней свободыС = 1 + 2 – 2 = 1. Это
моновариантные
системы в которых можно изменять один
параметр (РилиТ). При наибольшем
возможном числе фаз, равном 3, в системе
в условиях, определяющих тройную точкуО, не остается ни одной степени
свободы (С = 0). Это нонвариантная
система. Для воды тройная точка отвечаетТ = 0,00760 СиР=4,58 мм.
рт. ст. При насыщении воды воздухом с
давлением 1 атм. Равновесие воды льда и
пара наступает при00 С.
Из рис. 55 видно, что с повышением давления
температура плавления льда снижается
( линияОСнаклонена влево). Это
является следствием большей плотности
воды по сравнению с плотностью льда при
равновесии. По принципу Ле Шателье
равновесие лед![]() вода -6,1 кДж/мольпри увеличении
давления смешается в сторону воды,
имеющей меньший объем. Если теперь при
повышенном давлении повышать температуру,
то равновесие должно смещаться в сторону
льда (с выделением теплоты).
вода -6,1 кДж/мольпри увеличении
давления смешается в сторону воды,
имеющей меньший объем. Если теперь при
повышенном давлении повышать температуру,
то равновесие должно смещаться в сторону
льда (с выделением теплоты).
