
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
3.6. Свойства ковалентной связи
Особенностью ковалентной химической связи является ее насыщаемость, направленность и полярность.
Насыщаемость связи. Из приведенных выше примеров следует, что молекулы существуют в устойчивом состоянии
строго определенного состава H2, CH4, BF3, BH4-, BH3и т.д., но неH3, CH5и т.д. Таким образом, при образовании ковалентной связи происходит ее насыщение. Объяснить это можно следующим образом: пара электронов (H2, CH4) образующих связь всегда будут отталкивать неспаренный электрон приближающегося третьего атома, т.к. в электронной паре(H2)представлены обе возможности ориентации спина. Кроме того, насыщаемость ковалентной связи можно объяснить тем, что для образования химической связи необходимо оптимальное накопление электронной плотности между ядрами, а ее избыток или недостаток приводит к повышению полной энергии системы.
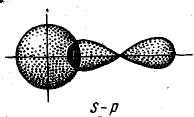
Направленность связи.Наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определенную форму, то их максимальное перекрывание возможно при определенной пространственной ориентации. Направленность – важнейшее свойство ковалентной связи, зависящее от типа взаимодействующих электронов и числа атомов. Направленность связи объясняется тем, что электронные облака различной формы имеют определенное пространственное направление.s –облако имеет форму сферы,p –облако – форму гантели, расположенные вдоль трех осей (px py pz).
, и - связи.В зависимости от направления перекрывания атомных орбиталей различают, и -связи.
- связьвозникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов. Простейший случай -связи наблюдается у молекулыH2, образуется за счет перекрыванияs –орбиталей атомов водорода (рис. 10,а); -связь может возникнуть также при перекрыванииsиp– орбиталей(б); двухp –орбиталей(в); двухd –орбиталей(г);dиs –орбиталей;dиp –орбиталей
а б


![]()
в г
Рис. 10. Схема перекрывания орбиталей
при образовании -связи
- связьосуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двухp –орбиталей, расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания (рис. 11). Соответственно -связь характеризуется двумя областями перекрывания, расположенными по обе стороны, соединяющей ядра атомов.
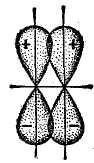
Рис. 11. Схема перекрывания p –орбиталей
при образовании - связи
Например, рассмотрим строение молекулы N2
![]()
 Связь
осуществляется за счет перекрывания 3
- p –электронных
облаков вдоль осиx,
yиz
Связь
осуществляется за счет перекрывания 3
- p –электронных
облаков вдоль осиx,
yиz
Рис. 12. Образование -связи в молекулеN2
Перекрывание электронных облаков происходит вдоль линии, соединяющей центры атомов, а также перпендикулярно линии, соединяющей центры

Рис. 13. Образование -связей в молекулеN2
Как видно, в молекуле N2 между атомами азота осуществляется одна -связь (рис. 12) и две -связи (рис. 13).

Рис. 14. Схема образования -связи
- связьвозникает при перекрывании двухd –атомных орбиталей, расположенных в параллельных плоскостях, четырьмя лепестками (рис. 14).
Таким образом, s–электроны могут участвовать лишь в образовании -связи,p–электроны – в образованиии -связей, аd–электроны – как в образованиии -связей, так и -связей.
-и -связи налагаются на -связи, вследствие чего образуются двойные и тройные, как, например, в молекуле азота.Количество связей, образующих между атомами, называется кратностью (порядком) связи.С увеличением кратности связи изменяются длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это вызвано тем, что энергия -связи меньше, чем энергия -связей; -связь менее прочная, чем -связь и разрушается при химических взаимодействиях в первую очередь.
Гибридизация атомных орбиталей.При образовании нескольких химических связей иногда участвуют различные атомные орбитали одного и того же атома. Например, в молекуле метана четыре химические связи образованы путем перекрывания трехp и однойs –орбитали атома углерода с четырьмяs –орбиталями атомов водорода. Так как энергия и формаsиp –орбиталей различны, то можно было бы ожидать, что одна из четырех связей в молекуле метана будет отличать-
ся от других связей по прочности и по характеру направленно-
сти. Однако эксперименты показали, что все четыре связи в молекуле метана равноценны. Этот и другие подобные факты удалось объяснить при помощи теории гибридизации. Согласно этой теории при образовании молекул происходит изменение формы и энергии атомные орбиталей. Вместо неравноценных, например, s иp –орбиталей образуются равноценные гибридные орбитали, имеющие одинаковую форму и энергию, т.е. происходит гибридизация (смешение) атомных орбиталей. При образовании химических связей с участием гибридных орбиталей выделяется больше энергии, чем при образовании связей с участием отдельныхs иp –орбиталей, поэтому гибридизация атомных орбиталей приводит к большему понижению энергии системы и соответственно повышению устойчивости молекулы.

Рис. 15. Форма sp –гибридной орбитали
Гибридная орбиталь по форме отличается от атомных орбиталей. Так, гибридная s иp –орбиталь отличается большей вытянутостью по одну сторону от ядра, чем по другую (рис. 15).
Электронная плотность в области перекрывания гибридного электронного облака будет больше электронной плотности в области перекрывания отдельно s иp –орбиталей. Поэтому связь, образованная электронами гибридной орбитали характеризуется большей прочностью, чем связь, образованная электронами отдельноs -илиp -орбитали.
Типы гибридизации s- и p- электронных облаков. Пространственная конфигурация молекул.
1) sp – илиq2 –гибридизация характерна, когда в образовании связи участвует1 sи1 p-электрон.
![]()
 апример,
рассмотрим строение молекулыBeCl2
апример,
рассмотрим строение молекулыBeCl2
При возбуждении атома образуются две гибридных орбитали расположенные под углом 1800относительно друг друга (рис. 16)

Рис. 16. Схема sp –гибридизации
Молекула имеет линейное строение типа AB2.
2) sp2 –илиq3 –гибридизация. Гибридные облака располагаются под углом 1200в одной плоскости (рис. 17).
При образовании гибридного облака участвует один s и

 2
pэлектрона.
2
pэлектрона.
Рис. 17. Схема sp2 -гибридизации
Например, молекула BCl3
Молекула имеет форму плоского треугольника.
3) sp3 – q4 –гибридизация осуществляется за счет одногоs и трехp –электронных облаков. Облака при этом типе гибридизации располагаются пол углом 109028(рис. 18). 4 гибридных облака направлены из центра правильного тетраэдра к его вершинам. Примером такой молекулы может бытьCH4, CCl4.

![]()

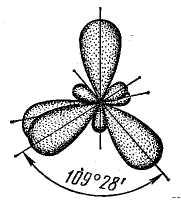 Рис.
18. Схема sp3– гибридизации
Рис.
18. Схема sp3– гибридизации
Кроме рассмотренных возможны и другие типы гибридизации валентных орбиталей и отвечающие им типы пространственной конфигурации молекул. Комбинация одной s –трехp– и однойd –орбиталей приводит кsp3d –гибридизации. Это соответствует ориентации пятиsp3d –гибридных орбиталей к вершинам тригональной бипирамиды. В случаеsp3d2– гибридизации шестьsp3d2гибридных орбиталей ориентируются к вершинам октаэдра. Ориентация семи орбиталей к вершинам пентагональной бипирамиды соответствуетsp3d3 (илиsp3d2f) – гибридизации валентных орбиталей центрального атома молекулы.
Таким образом, направленность химических связей определяет пространственную конфигурацию молекул.
Рассмотрим еще возможные типы возникающих молекул.
Молекулы типа
AA или AB.
К этому типу относятся молекулы,
образованные двумя одинаковыми или
различными атомами, между которыми
возникает одна одинарная (
- сигма) связь, последняя может быть
образована за счет взаимодействия двухs –электронов,
по одному от каждого атома (s
- s),
двухp –электронов
(p
- p)
или двух электронов смешанного типа
(s
- p)
(рис. 19). Такие связи возникают между
атомами элементов, имеющих одинs
–илиp –электрон: водород, элементы группыIA(щелочные металлы) и группыVIIA(галогены). Молекулы этого типа имеют
линейную форму, например,H 2,
F2, Cl2,
Br2, J2,
Zi2, Na2,
K2, HClи др.
2,
F2, Cl2,
Br2, J2,
Zi2, Na2,
K2, HClи др.
Рис. 19. Перекрывание s-иp-орбиталей
с образованием -связи
Молекулы типа AB2, AB3.Они образуются за счет взаимодействия двухp –электронов атомаВиs –электронов двух атомовA. Два непарныхp-электрона характерны для атомов элементовVI Агруппы, т.е. для кислорода и его аналогов (халькогенов).
Электронные облака p-электронов располагаются относительно друг другу под углом 900по координатным осямxиy.
 Рис.
20. Перекрывание орбиталей в молекуле
воды
Рис.
20. Перекрывание орбиталей в молекуле
воды
Например, в молекуле H2O(рис. 20) перекрывание облаковs –электронов с облакамиp –электронов происходит в месте, обозначенном штриховкой, а потому химические связи должны быть направлены под углом 90º. Такие молекулы называютсяугловыми.Однако согласно экспериментальным данным значительного чаще встречаются молекулы с иным значением валентного угла. Например, у молекулы воды валентный угол составляет 104,5º.одной из причин этого явления, согласно теории валентных связей является наличие у центрального атома несвязывающих электронных пар. Искажение валентных углов в этом случае вызывается взаимным отталкиванием связывающих и несвязывающих электронных пар центрального атома. При этом следует учесть, что облако связывающей электронной пары (локализованной между двумя атомами) занимает меньше места, чем облако несвязывающей электронной пары, поэтому в наибольшей степени отталкивание проявляется между несвязывающими парами, несколько меньше эффект отталкивания между несвязывающей и связывающей парой и, наконец, меньшее отталкивание между связывающими электронными парами. Это видно на примере строения молекул метана, аммиака и воды. Центральные атомы этих молекул образуют химические связи за счет электроновs p3 - гибридные орбитали приходится четыре электрона

Это определяет образование четырех связей C – Hи расположение атомов водорода молекулы метанаCH4в вершинах тетраэдра (рис. 21)

Рис. 21. Перекрывание орбиталей в молекуле метана

Следовательно, одна пара электронов оказывается несвязывающей и занимает одну из sp3 – орбиталей, направленных к вершинам тетраэдра. Вследствие отталкивающего действия несвязывающей электронной пары валентный угол в молекуле аммиакаH3Nоказывается меньше тетраэдрического и составляет< HNH = 107,3º.
Теперь уже ясно, что при рассмотрении молекулы воды угол валентный должен быть еще меньше, т.е. у атома кислорода на 4 sp3 – гибридные орбитали приходится шесть электронов т.е. двеsp3–гибридные орбитали занимают несвязывающие электронные пары. Отталкивающие действия двух

несвязывающих пар проявляется в большей степени. Поэтому валентный угол искажается против тетраэдрического еще сильнее и в молекуле воды H2Oсоставляет< HOH = 104º,5. С увеличением числа несвязывающих электронов центрального атома изменяется и пространственная конфигурация молекул (табл. 7). Так, если молекула имеет форму правильного тетраэдра с атомом углерода в центре, то в случае молекулыH3Nможно считать, что одна из вершин тетраэдра занята несвязывающей электронной парой и молекула имеет форму тригональной пирамиды. В молекулеH2Oдве вершины тетраэдра заняты электронными парами, а сама молекула имеет угловуюV-образную форму.

тетраэдр тригональная угловая
тип АВ4 пирамида типАВ2 (А2В)
СН4 типАВ3 NH3 H2O
Полярности связи.Связь между атомами разных электронов всегда более или менее полярна. Это обусловливается различием размеров и электроотрицательностей атомов. Например, в молекуле хлорида водородаHCl связывающее электронное облако смещено в сторону более электроотрицательного атома хлора. Вследствие этого заряд ядра водорода уже не компенсируется, а на атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра.
Таблица 7
Пространственная конфигурация молекул ABn
|
Тип гибри-диза-ции |
Число электронных пар атома A |
Тип моле-кулы |
Пространст-венная конфигу- рация |
Примеры | |
|
Связыва-ющих |
Несвязывающих | ||||
|
sp |
2 |
0 |
AB2 |
линейная |
BeCl2 (г) CO2 |
|
sp2 |
3
2 |
0
1 |
AB3
AB2 |
треугольная
угловая |
BCl3,
CO
O3 |
|
sp3 |
4
|
0
|
AB4 |
тетраэдрическая |
CCl4,
BH |
|
|
3
2 |
1
2 |
AB3
AB2 |
тригональнопермидальная угловая |
H3N, H3P
H2O |
|
sp3d1 |
5 |
0 |
AB5 |
тригонально-бипирамидальная |
PF5, SbCl5 |
Иными словами, атом водорода в HClполяризован положительно, а атом хлора отрицательно; на атоме водорода возникает положительный заряд, а на атоме хлора – отрицательный. Этот заряд -называют эффективным, его можно установить экспериментально. Согласно имеющимся данным, эф-
фективный заряд на атоме водорода молекулы HClсоставляетH = +0,2, а на атоме хлораCl = -0,2абсолютного заряда электрона.
Таким образом, по степени смещения (поляризации) связующего электронного облака связь может быть неполярной, полярнойилиионной.Неполярная и ионная связи представляют собой крайние случаи полярной связи.
Неполярные и полярные молекулы.В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. Полярные молекулы являются диполями, т.е. системами, состоящими из двух равных по величине и противоположных по знаку зарядов (+qи–q), находящихся на некотором расстоянииlдруг от друга, которое называется длинной диполя. Полярность молекулы, как и полярность связи оценивают величиной ее дипольного момента обозначаемого
= l· q,
где l– длина диполя,q– величина электрического заряда.
l имеет значение порядка диаметра атома, т.е.10-8 см, а заряд электрона4,8∙10-10эл. ст. ед., поэтомувыражается величиной порядка10-18эл. ст. ед.∙см. Эту величину называют единицей Дебая и образуют буквойD. В системе единиц СИизмеряется в кулон - метрах (К∙м);1 D = 0,33∙10-29К∙м.
Значения дипольного момента ковалентных молекул лежат в пределах 0-4D, ионных4-11D.
Дипольный момент молекулы представляет собой векторную сумму дипольных моментов всех связей и несвязанных электронных пар в молекуле. Результат сложения зависит от структуры молекулы. Например, молекула CO2, за счетspгибридизации орбиталей атома углерода, имеет симметрическое линейное строение.

Поэтому хотя связи C = Оимеют сильно полярный характер ( CO= 2,7 D), вследствие взаимной компенсации их дипольных моментов молекулаCO2в целом неполярна
( CO2 = 0).
Напротив, в угловой молекуле H2Oполярные связиO - Hрасполагаются под углом 104,5º. Поэтому их моменты взаимно не компенсируются и молекула оказывается полярной

Отсутствие дипольного момента свидетельствует о высоко симметричной структуре молекулы, наличие дипольного момента и его величина определяют несимметричность молекулы.
Поляризуемость связи.Для характеристики реакционной способности молекул важно знать не только исходное распределение электронной плотности, но и легкость, с которой оно изменится. Мерой последней служитполяризуемость связи– ее способность становиться полярной (или более полярной) в результате действия на нее электрического поля.
В результате поляризации может произойти полный разрыв связи с переходом связывающей электронной пары к одному из атомов с образованием отрицательного и положительного ионов. Асимметричный разрыв связи с образованием разноименных ионов называется гетеролитическим.
![]()
гомолитический гетеролитический
разрыв разрыв
(диссоциация) (ионизация)
Гетеролитический разрыв отличается от разрушения связи при распаде молекулы на атомы и радикалы. В последнем случае разрушается связывающая электронная пара и процесс называется гомолитическим.В соответствии со сказанным следует различать процесс диссоциации и процесс ионизации; в случаеHClпервый наблюдается при его термическом распаде на атомы, второй – при распаде на ионы в растворе.
Под действием внешнего электрического поля молекула поляризуется, т.е. в ней происходит перераспределение зарядов и молекула приобретает новое значение дипольного момента. При этом неполярные молекулы могут превратиться в полярные, а полярные становятся еще более полярными. Иначе говоря, под действием внешнего электрического поля в молекулах индуцируется диполь, называемый наведенным или индуцированным, которые существуют лишь при действии внешнего электрического поля.
