
- •Биологическая химия Руководство к самостоятельной работе студентов
- •Введение
- •Правила работы с тестами
- •Модуль 1 «Белки. Ферменты»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Графологическая структура
- •3.1. Реагенты, позволяющие определить n-концевую аминокислоту -
- •3.2. Реагенты позволяющие определить с-концевую аминокислоту -
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Фотоэлектроколориметр
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Методы осаждения белка»
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Выделение и очистка белков»
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Общие свойства ферментов»
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Основы иммуноферментного анализа
- •Клинико-диагностическое значение ифа
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Контрольные вопросы к модулю «Белки. Ферменты»
- •Примеры заданий тестового контроля знаний
- •Эталоны ответов
- •Модуль 2. «Биохимия питания. Общие пути катаболизма. Биоэнергетика»
- •Рекомендуемые темы реферативных сообщений
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Основные характеристики пищеварительных соков
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •2.1. Анилиновая проба на витамин д.
- •2.2. Реакция с серной кислотой.
- •5.1. Реакция с гидросульфитом натрия.
- •5.2. Реакция с раствором уксусно-кислой меди.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Количественное определение витаминов.
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Вид 1. Выберите один наиболее правильный ответ.
- •Самостоятельная работа
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестовых заданий контроля исходного уровня знаний Вид 1. Выбор одного наиболее верного ответа
- •Вид 2. Установить соответствие.
- •Примеры ситуационных задач
- •Задача 2. В эксперименте с изолированными митохондриями в качестве субстрата дыхания используется изоцитрат. Определите:
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры заданий тестового контроля знаний
- •Ответы на тесты
- •Модуль 3 «Структура и обмен углеводов»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Модуль 4. «Структура и обмен липидов»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Занятие № 4. Обмен сложных белков – нуклеопротеинов и хромопротеинов.
- •Методические указания к самоподготовке
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Примеры тестовых заданий
- •Эталоны ответов на тесты:
- •Модуль 6. «Взаимосвязь и регуляция обмена веществ. Гормоны»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Ситуационные задачи
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Современные методы определения количества гормонов
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы к зачетному занятию
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Модуль 7. «Биохимия органов и тканей»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Занятие № 3. Биохимия мышечной и нервной тканей.
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •1. Качественное определение белка.
- •2. Качественное определение сахара в моче с помощью реактива Фелинга.
- •3. Качественное обнаружение сахара в моче при помощи индикаторной бумаги «Глюкотест».
- •4. Количественное определение белка в моче по методу Робертса-Стольникова.
- •5. Качественное определение кетоновых тел.
- •6. Качественная реакция на кровяные пигменты.
- •7. Качественное определение желчных пигментов.
- •8. Проба Петенкофера на желчные кислоты.
- •9. Проба Яффе на уробилин.
- •10. Качественное определение индикана в моче.
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тестовых заданий
- •Эталоны ответов к тестовым заданиям
- •Графологическая структура модуля «Белки. Ферменты»
- •Рекомендуемая литература
- •Журналы по биохимии
- •Некоторые референтные значения биохимических показателей жидких сред организма
- •Некоторые референтные значения биохимических показателей жидких сред организма у детей
- •Оглавление
Примеры ситуационных задач
Задача 1. При добавлении в среду 0,002 мкмоль кристаллического фермента лактатдегидрогеназы наблюдается превращение субстрата со скоростью 9,6 мкмоль в минуту. Подсчитайте молярную активность (число оборотов) фермента.
Задача 2. Сколько граммов субстрата с молекулярной массой 672 г/моль может преобразовать фермент, если его активность составляет 5нКат, а время инкубации – 20 сек.
Задача 3. В приемное отделение больницы доставлен больной с подозрением на инфаркт миокарда. Определение активности каких ферментов помогут в подтверждения диагноза?
Методы количественного определения
активности некоторых ферментов
Работа № 1. Определение активности амилазы ротовой жидкости
по Вольгемуту.
Амилаза - фермент, осуществляющий гидролитическое расщепление полисахаридов до декстринов и мальтозы (химизм реакции см. занятие№6). Конечные продукты действия амилазы не дают цветной реакции с йодом. Наиболее богаты амилазой слюнные и поджелудочная железы.
Клинико-диагностическое значение имеет определение активности амилазы в крови, куда она попадает из поджелудочной железы (40%) и слюнных желез (60%). Амилазная активность крови по Вольгемуту в норме составляет 25-125 Ед/л. При остром панкреатите в первые сутки заболевания активность амилазы крови возрастает в десятки раз, а затем постепенно возвращается к норме. Амилазная активность крови увеличивается также при паротите (воспалении слюнных желез). Амилаза имеет небольшую молекулярную массу – 45 000, поэтому легко проходит почечный фильтр и попадает в мочу. В связи с меньшей инвазивностью определение амилазной активности мочи (диастазный тест) широко используется в клинике для диагностики состояния поджелудочной железы (см. УИРС).
Принцип метода. Метод основан на том, что слюну разводят в определенной последовательности, после чего приливают одно и тоже количество раствора крахмала и находят наименьшее содержание фермента, которое полностью расщепляет все количество добавленного крахмала. Затем производят перерасчет активности фермента на 1 мл слюны.
Амилазная активность слюны или амилокластичекая сила слюны выражается количеством 0,1% раствора крахмала в мл, которое может расщепляться 1 мл слюны при температуре 380 в течении 30 мин.
В норме амилазная активность слюны составляет 160-320ед.
Ход работы. В 10 пронумерованных пробирок наливают по 1 мл воды. Затем в первую пробирку добавляют 1 мл слюны, разведенной в 10 раз. Содержимое первой пробирки перемешивают и 1 мл раствора (суммарное разведение в 20 раз) переносят из 1-й пробирки во вторую, перемешивают( рслюна разведена в 40 раз). Затем 1 мл разведенной слюны из второй переносят в третью и.т.д. - из предыдущей пробирки в следующую. Из 10 пробирки 1 мл смеси выливают. Таким образом, получается ряд разведенной слюны, в котором в каждой последующей пробирки содержание фермента вдвое меньше, чем в предыдущей.
Во все пробирки добавляют по 1 мл воды и по 2 мл 0,1% раствора крахмала, перемешивают и помещают пробирки в термостат на 30 мин при температуре 380.
Через 30 минут пробирки вынимают, охлаждают, добавляют по 1-2 капле 1% раствора йода и перемешивают. Жидкость в пробирках в зависимости от степени расщепления крахмала может окрашиваться в желтый, розовый, красный и фиолетовый цвет. Раствор желтого цвета свидетельствует о полном расщеплении крахмала, фиолетовый – о том, что крахмал в растворе еще сохранился.
Работу необходимо оформить в виде таблицы.
|
Разведение слюны
|
№ пробирки | ||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | ||
|
20 |
40 |
80 |
160 |
320 |
640 |
1280 |
2560 |
5120 |
10240 | ||
|
Кол-во 0,1% крахмала
|
|
|
|
|
|
|
|
|
|
| |
|
Окрашивание йодом
|
|
|
|
|
|
|
|
|
|
| |
|
Амилокластическая активность слюны |
|
|
|
|
|
|
|
|
|
| |
Расчет. Берется количество слюны в последней пробирке с желтой окраской. Если это четвертая пробирка, то разведение слюны в ней – 160 раз. Составляется пропорция: 1). 160 мл слюны расщепляет 2 мл 0,1% р-ра крахмала; 2) 1 мл слюны расщепляет Х мл 0,1% р-ра крахмала, т.е. амилокластическая активность слюны составляет 320 ед.
Работа № 2. Фотоколориметрический метод исследования активности лактатдегидрогеназы в сыворотке крови по Севелу и Товареку.
Принцип метода. Метод основан на определении скорости образования пирувата в ходе окисления лактата с участием лактатдегидрогеназы сыворотки крови. Пируват с 2,4- динитрофенилгидразином (2,4-ДНФГ) образует соответствующий гидразон, имеющий красно-бурое окрашивание в щелочной среде, интенсивность которого прямо пропорциональна содержанию кетокислоты:
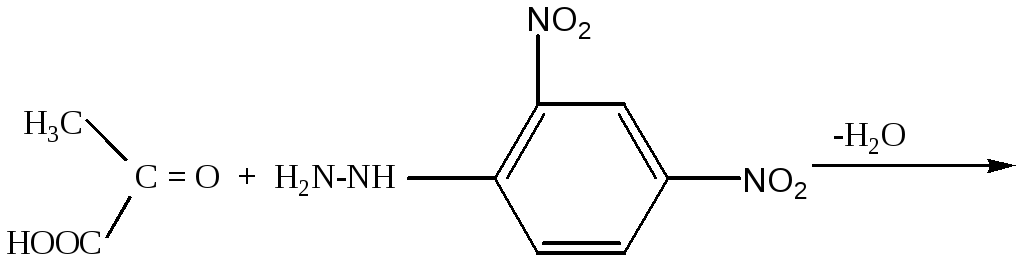
ПВК 2,4-динитрофенолгидразин
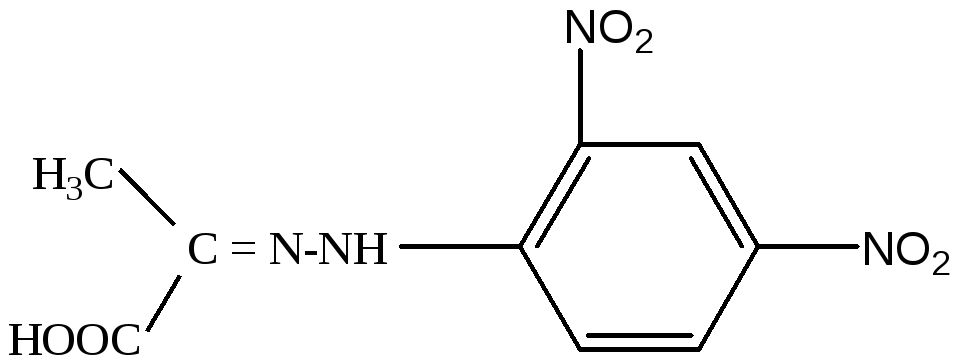
2,4-динитрофенилгидразон ПВК
Ход определения. Сыворотку крови разводят в 3 раза дистиллированной водой. Вносят в пробирку 0,1 мл разведенной сыворотки, 0,3 мл раствора НАД + и ставят на 5 мин в водяную баню при 370С (для прогревания смеси).
Во вторую пробирку добавляют 0,8 мл раствора пирофосфата натрия и 0,2 мл раствора лактата натрия и нагревают на водяной бане при 370С.
Выливают содержимое второй пробирки в первую, быстро перемешивают стеклянной палочкой, не вынимая пробирки из бани, и отмечают время начала инкубации. Через 25 мин реакцию останавливают, прибавляя 0,5 мл раствора 2,4-ДНФГ, и оставляют пробирку на 20 мин при комнатной температуре (для образования гидразона).
К смеси приливают 5 мл раствора NaOH, содержимое перемешивают стеклянной палочкой и через 10 мин (после развития окраски) измеряют экстинкцию опытной пробы против контрольной на ФЭКе при длине волны 520-560 нм (светофильтр зеленый) в кювете с толщиной слоя 1см. Контрольную пробу готовят как опытную, но разведенную сыворотку добавляют после инкубации.
Расчет. Активность фермента рассчитывают по калибровочному графику.
Оформление работы. Рассчитать активность фермента в исследуемой сыворотке крови, сделать вывод о возможных причинах изменений активности фермента.
Практическое значение работы. Определение активности лактатдегидрогеназы используется в клинико-биохимических лабораториях для диагностики и установления прогноза заболевания. В норме активность фермента составляет 0,8- 4,0 ммоль/ (ч л) и возрастает, как правило, у больных с повреждением миокарда, скелетных мышц, почек, а также при анемиях, опухолевых поражениях, остром гепатите и т.д.
Работа № 3. Разделение изоферментов лактатдегидрогеназы сыворотки крови методом электрофореза в полиакриламидном геле
Использование в качестве среды геля полиакриламида позволяет добиться высокого разрешения при электрофорезе белков и ферментов, поскольку этот гель играет роль молекулярного сита, что обеспечивает дополнительное разделение частиц по молекулярной массе.
Метод основанна разной электрофоретической подвижности изоферментов ЛДГ, положение которых на столбиках полиакриламидного геля выявляется с помощью веществ, переносящих водород от лактата через феназинметасульфат на нитротетразолиевый синий. В результате в месте нахождения фракции ЛДГ выпадает фиолетово-синий осадок диформазана.
Ход определения. Для полимеризации геля берут сухие чистые стеклянные трубочки, закрывают их с одного конца резиновыми колпачками, устанавливают в штативе строго перпендикулярно и вносят в них каплю раствора сахарозы. Затем готовят полимеризующую смесь, состоящую из растворов №1, №2, персульфата аммония и дистиллированной воды в соотношении 1:2:4:1. смеси готовят из расчета 2 мл на одну трубочку.
Приготовленную полимеризующую смесь разливают в стеклянные трубочки, используя по 2 мл на каждую. Затем на поверхность этого раствора осторожно наслаивают 0,2-0,3 мл дистиллированной воды пипеткой с тонким оттянутым концом (это улучшает полимеризацию геля в трубочках, которая протекает без доступа кислорода воздуха, и формирует гладкую поверхность геля). Через 30 мин обычно полимеризация завершается, о чем свидетельствует ясно различимая граница между полиакриламидным гелем и водой. После этого переворачивают трубочки и осторожно стряхивают с геля наслоенную воду, а остатки воды удаляют из трубочки с помощью фильтровальной бумаги.
Стеклянные трубочки с заполимеризованным гелем закрепляют в гнездах верхней камеры для электрофореза. На поверхность геля в трубочке наносят сначала 0,1 мл сыворотки крови, затем такой же объем раствора сахарозы и перемешивают нанесенные жидкости стеклянной палочкой. Осторожно наслаивают на эту жидкость разведенный в 10 раз электродный буфер, заполняя им пространство до верхнего края трубочки.
Нижнюю камеру аппарата заливают тем же электродным буфером, устанавливают верхнюю камеру над нижней так, чтобы нижние концы трубочек были погружены в электродный буфер. Затем верхнюю камеру тоже заполняют электродным буфером.
Аппарат для электрофореза ставят в холодильник. Электроды подключают к источнику постоянного напряжения: нижний электрод к аноду, верхний - к катоду. В течение первых 10 мин электрофорез проводят при силе тока 2мА на каждую трубочку. Затем силу тока увеличивают до 4мА. Длительность электрофореза около 90 мин.
Пока идет электрофорез, для выявления изоферментов ЛДГ готовят в колбе инкубационную смесь следующего состава: растворы лактата натрия, хлорида натрия, хлорида магния, НАД – по 1 мл, фосфатного буфера и НС- по 2,5 мл и ФМС – 0,25 мл, перемешивают содержимое колбочки.
По окончании электрофореза гели извлекают из трубочек. Для этого используют шприц на 10-20 мл с тонкой длинной иглой. Вводят иглу между стенкой трубочки и гелем. Круговыми движениями отслаивают гель, постоянно выдавливая воду из шприца и продвигая иглу к противоположному концу трубки. При этом столбик геля легко выскакивает из трубки.
Столбик геля помещают в пробирки диаметром 7-8мм и наливают в них инкубационную смесь так, чтобы весь столбик геля был погружен в проявляющуюся жидкость. Пробирки ставят в термостат при 370 С на 40-60 мин. Изоферменты ЛДГ выявляются в виде сине-фиолетовых колец на столбике геля.
По истечении инкубации столбики геля промывают водой, переносят в пробирки содержащие раствор уксусной кислоты, и хранят в темноте.
Количественную обработку гелевых изоэнзимограмм проводят спектрофотометрическим методом или посредством денситометрии. В первом случае лезвием вырезают окрашенные участки геля, помещают их в пробирки и заливают 1 мл подогретого до +80-850С раствора диметилформамида. Затем окрашенную жидкость сливают в микрокюветы и измеряют экстинкцию на спектрофотометре или ФЭКе при 540 нм против раствора диметилформамида.
Второй способ обработки заключается в сканировании гелей на микроденситометре. Денситограммы подвергаются количественной обработке.
Расчет. Относительную активность каждого изофермента х (%) выражают в процентах от суммы экстинкций всех изоферментов ЛДГ:
Х=ЕА×100%
∑Е , где Е- экстинкция элюата изофермента из зоны геля, относящейся к данному изоферменту; ∑ Е- сумма экстинкций всех изоферментов; А- активность ЛДГ сыворотки крови, ммоль/(ч·л).
Оформление работы. Зарисовать полученную изоэнзимограмму и рассчитать относительную активность изоферментов ЛДГ (в %). Сделать вывод о сдвигах спектра изоферментов ЛДГ в исследуемой сыворотке и указать на вероятные причины этого явления.
Клинико-диагностическое значение. Состав изоферментов ЛДГ имеет внутриклеточную, тканевую и видовую специфичность. Тканевые различия изоферментого спектра ЛДГ явились предпосылкой для использования его в диагностике и прогнозе ряда заболеваний, сопровождающихся некрозом тканей и органов. Известно, что в сердечной мышце, нервной ткани, почках высокая активность ЛДГ1 и ЛДГ2 (изоферменты Н-типа), в поджелудочной железе и легочной ткани преобладает ЛДГ3, а в скелетной мышце и печени-ЛДГ4 и ЛДГ5 (изоферменты М-типа). При некрозе этих тканей находящиеся в них изоферменты поступают в кровь и изменяют ее нормальный спектр. В норме сыворотка крови имеет примерно следующие соотношения изоферментов (в % от общей активности): ЛДГ1-31, ЛДГ2-47, ЛДГ3-12, ЛДГ4-5, ЛДГ5- 4. При инфаркте миокарда увеличивается доля ЛДГ1 и ЛДГ2 (спектр смещается в сторону изоферментов Н-типа), причем этот сдвиг определяется размерами очага некроза в сердце. Заживление сопровождается нормализацией состава изоферментов в сыворотке крови.
При инфекционном гепатите повышена относительная активность ЛДГ4 и ЛДГ5. Если она сохраняется при клиническом выздоровлении, то это свидетельствует о незавершенности восстановительных процессов в печени.
При поражении поджелудочной железы (панкреатит), легочной ткани увеличивается относительная активность ЛДГ3 в сыворотке крови. Увеличение активности изоферментов средней зоны ЛДГ3 и ЛДГ4 наблюдается также при массивном разрушении тромбоцитов (эмболии легочной артерии, массивные гемотрансфузии) и вовлечении в патологический процесс лимфатической системы.
УИРС. Исследование амилазной активности мочи.
Исследование амилазной активности мочи по Вольгемуту производится аналогично методике приведенной выше для определения активности амилазы слюны). Амилазная активность мочи также отражает и величину клубочковой фильтрации. Снижение активности этого фермента в моче наблюдается при почечной недостаточности. В норме амилазная активность мочи по Вольгемуту составляет от 16 до 64 Е.
Для определения активности амилазы можно использовать также модификацию Бюхнера. По данному методу амилазная активность мочи выражается количеством фермента, расщепляющим 2 мг крахмала за 15 мин.
Ход работы. На сухую чашку Петри заранее капают в разных местах по 1 капле раствора Люголя (всего 8-10 капель). В пробирку вносят 2 мл 0,1% р-ра крахмала (2 мг крахмала), 1 мл физиологического р-ра и помещают пробирку на водяную баню при 37°С на 2 мин. Через 2 мин, не вынимая пробирку из бани, добавляют в нее 05 мл мочи, перемешивают и отмечают время начала реакции. Затем каждые 2-3 мин переносят каплю реакционной смеси на чашку Петри в раствор Люголя до тех пор, пока не произойдет полное разложение крахмала, т.е. до появления желтого цвета
Активность амилазы рассчитывают по формуле:
Хед=15/Т×0,5 ,
где х- активность амилазы в 1 мл мочи;
15 – время, необходимое для полного расщепления 2 мг крахмала;
0,5 – количество мочи, взятое на анализ, мл;
Т- время реакции, мин.
В норме активность амилазы мочи по Бюхнеру составляет 1-2 ЕД.
