
- •ВВЕДЕНИЕ
- •СПИСОК ОСНОВНЫХ СОКРАЩЕНИЙ
- •1. ИСТОРИЯ ВОЗНИКНОВЕНИЯ И РАЗВИТИЯ ФИЗИОЛОГИИ
- •1.1. НАБЛЮДАТЕЛЬНЫЙ ЭТАП СТАНОВЛЕНИЯ ФИЗИОЛОГИИ
- •1.2. ЭКСПЕРИМЕНТАЛЬНЫЙ ЭТАП РАЗВИТИЯ ФИЗИОЛОГИИ
- •1.3. КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНЫЙ ЭТАП РАЗВИТИЯ ФИЗИОЛОГИИ
- •1.4. ФИЗИОЛОГИЯ В XXI ВЕКЕ
- •2. ФИЗИОЛОГИЯ КАК НАУКА
- •2.1. ПРЕДМЕТ И ЗАДАЧИ ФИЗИОЛОГИИ
- •2.2. СВЯЗЬ ФИЗИОЛОГИИ С ТЕХНИЧЕСКИМИ НАУКАМИ
- •2.3. ПОНЯТИЯ О ФИЗИОЛОГИЧЕСКОЙ ФУНКЦИИ, ФИЗИОЛОГИЧЕСКОЙ РЕАКЦИИ И ФИЗИОЛОГИЧЕСКОМ ПРОЦЕССЕ
- •2.4. ДИАЛЕКТИКО-МАТЕРИАЛИСТИЧЕСКИЕ ОСНОВЫ ФИЗИОЛОГИИ
- •3. ФИЗИОЛОГИЯ КЛЕТКИ
- •3.1. СТРУКТУРА КЛЕТКИ
- •3.2. ХАРАКТЕРИСТИКА ФУНКЦИЙ КЛЕТОК
- •3.3. ТРАНСПОРТНАЯ ФУНКЦИЯ КЛЕТОЧНОЙ МЕМБРАНЫ И ЕЁ МЕСТО В ЖИЗНЕДЕЯТЕЛЬНОСТИ КЛЕТОК
- •3.4. ЖИЗНЕННЫЙ ПУТЬ КЛЕТКИ
- •3.5. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ФИЗИОЛОГИИ КЛЕТКИ
- •4.1. ОБЩАЯ ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ТКАНИ
- •4.2. ОБЩАЯ ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ОРГАНОВ И ОРГАНИЗМА
- •5. ФУНКЦИОНАЛЬНЫЕ СИСТЕМЫ. СИСТЕМОГЕНЕЗ. ГОМЕОСТАЗ
- •5.1. УЧЕНИЕ О ФУНКЦИОНАЛЬНЫХ СИСТЕМАХ П.К. АНОХИНА. СИСТЕМОГЕНЕЗ
- •5.2. ОБЩИЕ КИБЕРНЕТИЧЕСКИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ГОМЕОСТАЗА
- •6. ОБЩАЯ ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ
- •6.1. ПОНЯТИЕ О ВОЗБУДИМОСТИ И ВОЗБУЖДЕНИИ
- •6.4. ЛОКАЛЬНЫЙ ОТВЕТ (ПРЕПОТЕНЦИАЛ)
- •6.5. МЕХАНИЗМ ФОРМИРОВАНИЯ ПОТЕНЦИАЛА ДЕЙСТВИЯ
- •6.6. ПОТЕНЦИАЛ ДЕЙСТВИЯ И ВОЗБУДИМОСТЬ КЛЕТКИ
- •7. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ РАЗДРАЖЕНИЯ ВОЗБУДИМЫХ ТКАНЕЙ
- •7.1. КЛАССИФИКАЦИЯ И ХАРАКТЕРИСТИКА РАЗДРАЖИТЕЛЕЙ
- •7.2. РОЛЬ ДЛИТЕЛЬНОСТИ ДЕЙСТВИЯ РАЗДРАЖИТЕЛЯ
- •8. НЕЙРОН КАК СТРУКТУРНО-ФУНКЦИОНАЛЬНАЛЬНАЯ ЕДИНИЦА НЕРВНОЙ СИСТЕМЫ
- •9.1. РЕФЛЕКТОРНЫЙ ПРИНЦИП ДЕЯТЕЛЬНОСТИ НЕРВНОЙ СИСТЕМЫ
- •9.2. ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА НЕРВНЫХ ЦЕНТРОВ
- •10.1. ОСНОВНЫЕ ПРИНЦИПЫ КООРДИНИРУЮЩЕЙ ДЕЯТЕЛЬНОСТИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
- •10.2. ОСНОВНЫЕ ПРИНЦИПЫ ИНТЕГРАТИВНОЙ ДЕЯТЕЛЬНОСТИ ЦНС
- •10.3. МЕТОДЫ ИССЛЕДОВАНИЯ ФУНКЦИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
- •11. ЧАСТНАЯ ФИЗИОЛОГИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
- •11.1. ОБЩАЯ АНАТОМО-ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА КОРЫ ГОЛОВНОГО МОЗГА
- •11.2. ПОНЯТИЕ О ФУНКЦИОНАЛЬНОЙ АСИММЕТРИИ ПОЛУШАРИЙ ЧЕЛОВЕКА
- •11.3. АНАТОМО-ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА КОРЫ СТВОЛА МОЗГА
- •11.4. АНАТОМО-ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ПРОМЕЖУТОЧНОГО МОЗГА И МОЗЖЕЧКА
- •11.5. АНАТОМО-ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ЛИМБИЧЕСКОЙ СИСТЕМЫ
- •11.6. ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА
- •12. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА
- •12.2. СИМПАТИЧЕСКИЙ ОТДЕЛ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ
- •12.3. ПАРАСИМПАТИЧЕСКИЙ ОТДЕЛ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ
- •12.4. МЕТАСИМПАТИЧЕСКИЙ ОТДЕЛ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ
- •12.5. СОВРЕМЕННЫЕ КОНЦЕПЦИИ ВЗАИМОДЕЙСТВИЯ ОТДЕЛОВ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ
- •13. ОБЩАЯ ФИЗИОЛОГИЯ ЭНДОКРИННОЙ СИСТЕМЫ
- •13.1. КРАТКАЯ ХАРАКТЕРИСТИКА ДЕЙСТВИЯ И МЕТАБОЛИЗМА ГОРМОНОВ В ОРГАНИЗМЕ
- •13.2. РЕГУЛЯЦИЯ ЭНДОКРИННОЙ ФУНКЦИИ
- •13.3. ФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ГОРМОНОВ
- •14. ФИЗИОЛОГИЯ МЫШЦ
- •14.1. ФИЗИОЛОГИЯ СКЕЛЕТНЫХ МЫШЦ
- •14.2. ХИМИЧЕСКИЕ И ТЕПЛОВЫЕ ПРОЦЕССЫ ПРИ СОКРАЩЕНИИ МЫШЦЫ
- •14.3. ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ СОКРАЩЕНИЯ ПОПЕРЕЧНО-ПОЛОСАТЫХ МЫШЦ
- •14.4. ХАРАКТЕРИСТИКА МЫШЕЧНЫХ СОКРАЩЕНИЙ. ТЕТАНУС
- •14.5. ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА СИЛЫ И РАБОТЫ МЫШЦ
- •14.6. ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ГЛАДКИХ МЫШЦ
- •15.1. КРАТКАЯ ХАРАКТЕРИСТИКА СОСТАВНЫХ КОМПОНЕНТОВ ДВИГАТЕЛЬНОГО АКТА
- •15.2. СПИНАЛЬНЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ МЫШЕЧНОГО ТОНУСА И ФАЗНЫХ ДВИЖЕНИЙ
- •15.3. РОЛЬ МОЗГОВЫХ СТРУКТУР В РЕГУЛЯЦИИ ДВИЖЕНИЙ
- •ЗАКЛЮЧЕНИЕ
- •СПИСОК ЛИТЕРАТУРЫ

Критический уровень деполяризации (КУД) – это величина МП, при котором деполяризация мембраны принимает самоусиливающийся характер, свидетельствующий о развитии потенциала действия (ПД). Формирование КУД начинается, когда входящий в клетку поток ионов Na+ сравнивается с выходящим из клетки потоком ионов К+ и формируется электрическая нестабильность мембраны возбудимой клетки. Раздражитель, деполяризующий мембрану до достижения КУД, называется пороговым раздражителем, тогда как разность по-
тенциалов между КУД и МП называется пороговым потенциалом
(ПП = КУД – МП), который характеризует возбудимость клетки: чем меньше ПП, тем больше возбудимость и наоборот.
6.5. МЕХАНИЗМ ФОРМИРОВАНИЯ ПОТЕНЦИАЛА ДЕЙСТВИЯ
Потенциал действия (ПД) – электрический компонент возбуждения нервных и мышечных клеток, представляющий собой бы-
стрые колебания их мембранного потенциала, сопровождающие, как правило, перезарядкой мембраны. Главное условие возникно-
вения ПД – это действие раздражителя пороговой или сверхпороговой силы в электровозбудимых участках мембраны. В процессе формирования ПД проходит несколько фаз (рис. 6.2): деполяризация и реполяризация.
Рис. 6.2. Схема потенциала действия
(По В.Н. Яковлеву с соавт., 2005)
66
Фаза деполяризации (восходящая фаза ПД) состоит из нескольких этапов:
Первый этап. Это продолжающийся после достижения КУД сдвиг МП в позитивную сторону, который достигается резким преобладанием входящего в клетку Na+-тока над выходящим из неё К+-током. Следствием этого является продолжающаяся деполяризация клеточной мембраны. На данном этапе деполяризация имеет самоусиливающийся характер (пример положительной обратной связи), чем обеспечивает стандартную величину ПД как при пороговых, так и сверхпороговых раздражителях.
Второй этап. Начинается после того, как входящий в клетку Na+-ток доводит МП до нуля. С этого момента происходит перезарядка мембраны и величина МП становится положительной около +20 мВ (см. рис. 6.2). Этот второй этап первой фазы ПД называется овершутом. Овершут приводит к тому, что электродвижущая сила ионов Na+ резко уменьшается. Одновременно с этим начинается закрытие Na+-каналов, в результате чего входящий Na+-ток сравнивается с выходящим К+-током. Как следствие, общий ионный ток через мембрану становится равным нулю.
Фаза реполяризации ПД (нисходящая фаза ПД) начинается в фазу деполяризации, когда открываются потенциалзависимые К+-каналы. Но поскольку кинетика воротных механизмов этих каналов более медленная, чем Na+-каналов, реальное повышение калиевого тока наступает только тогда, когда он вместе с током утечки начинает преобладать над входящим натриевым током (на рис. 6.2 – это после вершины спайка). Возникающее с началом реполяризации закрытие быстрых ворот в Na+-каналах вызывает прогрессирующее снижение Na+-тока, облегчая, наряду с выходящим К+-током возвращение МП к исходному уровню. При приближении МП к состоянию покоя скорость реполяризации снижается. В основе этого лежит снижение калиевого тока по механизму обратной связи и формируется следовая деполяризация (см. рис. 6.2).
В связи с тем, что после спайка повышенная проницаемость мембраны клетки для К+ сохраняется, и накоплением Na+ внутри клетки активируется электрогенная деятельность К+,Na+-насоса, возможно формирование следовой гиперполяризации после завершения ПД (см. рис. 6.2). Поскольку ПД сопровождается небольшим нарушением ионных градиентов клетки, то он является довольно экономичным процессом. Функциональная роль ПД: в нервной ткани – в передаче информации, в мышечной ткани – это пусковой механизм сокращения мышечных клеток.
67

6.6. ПОТЕНЦИАЛ ДЕЙСТВИЯ И ВОЗБУДИМОСТЬ КЛЕТКИ
Показателем возбудимости клетки является величина ПП и сила порогового раздражителя. В свою очередь величина ПП зависит от КУД и МП. Сдвиг КУД в позитивную сторону и(или) МП в негативную сторону увеличивают ПП и снижают возбудимость; противоположные сдвиги – снижают ПП и увеличивают возбудимость. Из этого следует, что факторы, влияющие на формирование КУД, будут определять и степень возбудимости клетки. Если учесть, что формирование КУД детерминировано входящим током Na+, то вещества, влияющие на этот процесс, будут изменять КУД, и как следствие, возбудимость клетки. Одним из таких факторов может служить изменение концентрации внутриклеточного Са++ (рис. 6.3).
Изменение концентрации Nа+ во внеклеточной среде также изменяет КУД, и как следствие, снижает возбудимость. В частности, снижение концентрации Nа+ вне клетки, снижая входящий Nа+-ток, требует более сильной пороговой деполяризации (КУД сдигается в позитивную сторону) и характеризует снижение возбудимости. Пример: мы-
шечная слабость при бессолевой диете и чрезмерном употреблении дистиллированной воды. Увеличение концентрации внеклеточного Nа+ оказывает противоположный эффект. Пример: гипертонус глад-
ких мышц сосудистой стенки при задержке натрия в организме.
Са Са
|
активация |
|
|
m-ворота Na+-каналов |
|
Возбудимость |
Возбудимость |
|
миоцитов |
||
миоцитов |
||
увеличивается |
||
снижается |
||
|
Тетаническое
судорожное
сокращение скелетных мышц
Рис. 6.3. Снижение концентрации внутриклеточного кальция активирует m-ворота Nа+-каналов мышечных клеток, что повышает их возбудимость, создавая условия для развития их судорожных сокращений
68

Рис. 6.4. Кривая изменения возбудимости (Б)
в течение потенциала действия:
(А) МПП – мембранный потенциал покоя; КУД – критический уровень деполяризации; 1 – абсолютная рефрактерность;
2 – относительная рефрактерность; 3 – супернормальная возбудимость; 4 – субнормальная возбудимость (По В.Н. Яковлеву с соавт., 2005)
В течение восходящей фазы ПД возбудимость клетки утрачивается, так как натриевые каналы, участвуя в самоусиливающейся деполяризации, не могут ответить на новый раздражитель (рис. 6.4). Это фаза абсолютной рефрактерности. Она продолжается и в нисходящей фазе ПД до тех пор, пока МП в процессе реполяризации не достигнет уровня на 20 мВ позитивнее КУД.
Основная роль фазы абсолютной рефрактерности заключается в обеспечении прерывистого характера возбуждения (например, импульсная активность нейрона), и какие бы сильные раздражители не действовали, новый ПД возникнет только после развития спайка предыдущего ПД. Абсолютная рефрактерность лимитирует лабильность (функциональную подвижность) клетки.
Лабильность – максимальное число ПД, которое возбудимая
структура способна генерировать в полном соответствии с ритмом раздражителя (Н.Д. Введенский, 1892). Лабильность вычисляется по формуле Л = 1/АР, где АР – абсолютная рефрактерность, выраженная в секундах. В течение ПД абсолютная рефрактерность переходит в
фазу относительной рефрактерности, когда, несмотря на то, что воз-
будимость снижена, ПД может возникнуть при действии сверхпорогового раздражителя. Эта фаза соответствует интервалу времени, в течение которого МП в фазе реполяризации достигает КУД. В это время уровень инактивации Nа+-каналов меньше 50%, но на 20% больше нормальной. В связи с этим Nа+-ток при действии нового раздражите-
69
ля меньше как по скорости нарастания, так и по силе, а возникающий ПД имеет меньшую амплитуду и более продолжительный спайк.
Если в ПД формируется следовая деполяризация, то фаза относительной рерактерности переходит в фазу супернормальной возбудимости, так как ПП в это время снижен. В этот период возникновение ПД возможно при действии подпорогового раздражителя. Формирование следовой деполяризации связано с резким снижением повышенного К+-тока по механизму отрицательной обратной связи.
Если в ПД формируется следовая гиперполяризация, то формиру-
ется фаза субнормальной возбудимости, что связано с увеличением ПП. В эту фазу генерация ПД также возможна, но только при действии сверхпороговых раздражителей. Благодаря этой фазе клетка может работать в медленном режиме импульсации, если на неё не действуют сильные раздражители. Формирование следовой гиперполяризации связано с длительным небольшим избытком К+-тока и электрогенной деятельностью К+,Nа-насоса.
Проведение потенциала действия. В отличие от локального от-
вета потенциал действия (ПД) может распространяться на любые расстояния по всей длине возбудимой структуры без уменьшения своей амплитуды. При этом проведение ПД возбудимой клеткой может осуществляться двумя способами:
а) пассивно (электротонически) с использованием кабельных свойств клетки;
б) активно с использованием регенеративной деполяризации и формирования ПД.
Электротоническое распространение биопотенциалов связано с развитием электротонического потенциала (деполяризации) без участия в его формировании потенциалуправляемых ионных каналов. Его формирование происходит в результате создания разности биопотенциалов между возбуждённым и соседним невозбужденным участками клеточной мембраны. Если распространяющийся электротонически биопотенциал деполяризует клеточную мембрану до КУД, то он трансформируется в ПД, способный к активному распространению.
Электротоническое распространение биопотенциалов есть физи-
ческий механизм превращения местных потенциалов через этап локального ответа в ПД. При электротоническом распространении нервного импульса местные токи текут вдоль волокна между деполяризованными и поляризованными участками, обеспечивая вовлечение в возбуждение соседних участков волокна.
70
Эффективность электротонического распространения биопотенциалов зависит от кабельных свойств нервных и мышечных волокон:
1)большое сопротивление мембраны волокна;
2)низкая ёмкость мембраны;
3)низкое электрическое сопротивление цитоплазмы внутри волокна;
4)длина и диаметр волокна. Кабельные свойства волокна увеличиваются при увеличении его диаметра, что снижает сопротивление цитоплазмы, а также при миелинизации волокна, что снижает её ёмкость.
Активное распространение биопотенциалов с формированием ПД связано с непременным участием в этом процессе потенциалуправляемых ионных каналов. Непрерывное распространение ПД происходит в безмиелиновых нервных волокнах и мышечных волокнах, имеющих равномерное распределение потенциалуправляемых каналов. При этом проведение возбуждения начинается с этапа электро- тонического возбуждения ПД. В процессе формирования нового ПД на соседнем (ещё не возбуждённом) участке волокна возникает мощный трансмембранный Na+-ток, приводящий к самоусиливающейся деполяризации, обеспечивая восстановление амплитуды ПД, которая уменьшается при электротоническом распространении. Именно поэтому проведение ПД распространяется без снижения его амплитуды. Таким образом формируется эстафета генерируемых ПД, где каждый участок мембраны выступает вначале как раздражаемый (при поступлении к нему электротонического потенциала), а затем, после формирования в нём ПД, превращается в раздражитель для соседнего невозбуждённого участка. Наличие потенциалуправляемых ионных каналов на всём протяжении или в ограниченных, но повторяющихся участках волокна является обязательным условием распространения ПД на большие расстояния.
6.7. ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ МЕМБРАННЫХ ПОТЕНЦИАЛОВ
ИСОСТОЯНИЯ ИОННЫХ КАНАЛОВ
В1939 году А. Ходжкин и А. Хаксли впервые определили МП и ПД в гигантском аксоне кальмара, используя тонкий металлический неполяризующийся электрод, который вводился в волокно со стороны среза нерва до неповреждённых участков аксона. Другой (индифферентный) электрод располагался в омывающем аксон растворе и при этом измерялось напряжение (рис. 6.5).
71

Рис. 6.5. Регистрация мембранного потенциала
при помощи стеклянных микроэлектродов:
1 – оба электрода находятся во внеклеточном растворе;
2 – один электрод вкалывается в клетку.
Справа показано, что введение микроэлектрода в клетку приводит к смещению регистриуремого потенциала в сторону отрицательных значений МП, в данном случае равен – 60 мВ. Справа показано, что введение микроэлектрода в клетку приводит к смещению регистрируемого потенциала в сторону отрицательных значений. МП покоя в данном случае равен – 60 мВ
(из Kandel, Schwartz, Jessel, 2002 с изменениями)
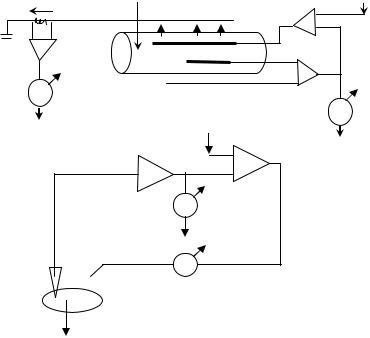
В начале 50-х годов XX века К. Коулом, А. Ходжкиным и А. Хаксли был предложен метод фиксации потенциала, позволяющий поддерживать МП на определённом уровне при помощи усилителя обратной связи. Это даёт информацию о величине и кинетике ионных потоков при заданном значении МП. Для этого в аксон кальмара авторы вводили не один, а два электрода. Из них один фиксировал МП, другой служил для подачи импульсов стимулирующего тока. МП клетки искусственно смещался до определённого уровня, а специальный усилитель обратной связи поддерживал его на этом уровне (рис. 6.6).
За работы по электрофизиологии клетки А.Л. Ходжкину и Э.Ф. Хаксли присуждена в 1963 году Нобелевская премия по физиологии и медицине.
А.Л. Ходжкин |
Э.Ф. Хаксли |
(1914 – 1998 гг.) |
(г. р. 1917) |
72
А |
|
а2 |
Vс |
Аксон кальмара |
|
||
|
|
||
|
|
|
|
|
|
а1 |
|
|
I |
|
|
|
Vс |
|
V |
|
|
|
|
Б |
а1 |
а2 |
|
|
|
V
I
Е1  Е2
Е2
Клетка мышечного волокна
Рис. 6.6. Метод фиксации мембранного потенциала:
А – с использованием металлических электродов, введённых в гигантский аксон кальмара; Б – с использованием двух электродов, введённых в отдельную клетку на примере мышечного волокна; а1 – усилитель; а2 – усилитель обратной связи; Vc – смещение мембранного потенциала; V – регистрация мембранного потенциала (мВ); I – регистрация мембранного тока (мА);
E1 – отводящий электрод; Е2 – токовый электрод (по А.Л. Зефирову и Г.Ф. Ситдиковой, 2010)
Однако метод фиксации МП не подходит, если размеры объекта исследования настолько малы, что введение микроэлектродов может вызвать серьёзные повреждения клетки. Для этих целей разработан метод внеклеточной (фокальной) регистрации. Суть его заключает-
ся в снятии показателей с небольшого участка мембраны, ограниченного размерами кончика регистрирующего электрода. Внеклеточно регистрируемый сигнал является падением напряжения на изолирующем сопротивлении электрода, которое пропорционально току, протекающему через участки мембраны под электродом. Принципиальная схема внеклеточного отведения представлена на рис. 6.7.
73

Рис. 6.7. Внеклеточное отведение электрического сигнала:
V1 – потенциал на внутренней стороне мембраны; V2 – потенциал на внешней стороне мембраны; Сm – ёмкость мембраны; rm – сопротивление мембраны; Im – ток текущийц через мембрану; Rs – шунтирующее сопротивление;
re – сопротивление электрода (по А.Л. Зефирову и Г.Ф. Ситдиковой, 2010)
В1975 году группа советских учёных во главе с П.Г. Костюком разработала метод внутриклеточного диализа, суть которого заключалась в помещении гигантских нейронов некоторых пресноводных моллюсков в пору, сделанную в пластике, и покрытую изолированной смазкой, после чего внутренняя сторона клетки разрушалась скачком гидростатического давления. Данный метод позволил отрыть наличие
вклетке кальциевых каналов и явился первым вариантом появившейся позже общеизвестной методики петч-кламп.
В1976 году Неер и Сакман предложили метод петч-кламп (рис. 6.8) для измерения ионных токов через одиночные каналы. Для петч-кламп (patch-clamp) регистрации необходимо, чтобы кончик стеклянной пипетки с внутренним размером около 1 мкм плотно контактировал с мембраной исследуемой клетки. При удачном подведении благодаря лёгкому присасыванию между клеточной мембраной и стеклом пипетки создаётся сопротивление более 109 Ом (отсюда возник термин patch-clamp – гигантский контакт). Если пипетка соединена с усилителем и осциллографом, то регистрируются токи, проходящие через участок мембраны, находящийся внутри кончика пипетки, такая конфигурация петч-кламп-метода называется cell-attached (контакт с клеткой).
Петч-кламп-метод позволяет менять конфигурацию клеточной мембраны и тем самым проводить более детальные исследования отдельных типов ионных каналов. Например, изменение конфигурации клеточной мембраны по типу inside-out означает поворот участка клеточной мембраны внутренней стороной наружу (к омывающему раствору), а конфигурация wholl-cell достигается ведением микроэлектрода
вцитоплазму клетки.
74

Рис. 6.8. Регистрация токов отдельных ионных каналов. Пипетка с участком мембраны помещается в раствор. Токи, текущие через одиночный канал, усиливаются и
регистрируются с помощью осциллографа
(по А.Л. Зефирову и Г.Ф. Ситдиковой, 2010)
Рис. 6.9. Схема оптической регистрации изменений мембранного потенциала в изолированном нейроне с помощью потенциал-чувствительного красителя
При использовании пэтч-кламп-метода регистрируемые события состоят из прямоугольных токовых сигналов, отражающих процессы открытия и закрытия ионных каналов. Этот метод позволяет менять потенциал на мембране, варьировать ионный состав как с наружной,так и с внутренней стороны мембраны, использовать разнообразные физиологические подходы для исследования ионных каналов. При невозможности зарегистрировать ПД с помощью микроэлектродов, в многоклеточных препаратах, а также для измерения пространственных и временных параметров ПД используют применение потенциалчувствительных красителей (рис. 6.9). Суть данного метода состоит в использовании специальных химических веществ (красителей), спектральные характеристики которых меняются в ответ на изменение мембранного потенциала. С помощью этих красителей можно зарегистрировать место возникновения ПД, направление и скорость его распространения. Главным условием для таких красителей является короткое время ответа и высокая чувствительность.
75
Вопросы для самоконтроля к главе 6
1.В чём отличие возбудимости от возбуждения?
2.Дайте определение раздражимости.
3.Что представляет собой мембранный потенциал покоя (МПП)? Напишите его формулу.
4.Чем отличается МПП от митохондриального и межфазного потенциалов?
5.Укажите функциональную роль МПП.
6.Что является условием формирования МПП?
7.Поясните первый ведущий механизм формирования МПП и дайте определение равновесного потенциала и поясните формулу Нернста.
8.Поясните второй ведущий механизм формирования МПП.
9.Поясните роль ионов натрия и хлора в формировании МПП.
10.Поясните механизм локального ответа и назовите его основные свойства.
11.В чём заключается основное предназначение МПП?
12.Поясните механизм развития КУД.
13.Дайте определение ПД и объясните его роль в организме.
14.Нарисуйте схему формирования ПД и поясните её.
15.Как влияет возбудимость на изменение КУД и МПП?
16.Нарисуйте и поясните схему влияния ионов кальция на возбудимость клетки.
17.Объясните механизмы формирования и физиологическое значение фазы абсолютной рефрактерности ПД.
18.Что понимают под лабильностью? Напишите формулу её вычисления.
19.Опишите механизмы развития фазы относительной рефрактерности ПД.
20.Что лежит в основе развития супер- и субнормальной возбудимости?
21.Дайте характеристику электротонического распространения ПД.
22.Объясните механизм активного распространения биопотен-
циалов.
23.Напишите и поясните схему регистрации биопотенциалов с помощью стеклянных электродов.
24.В чём заключается метод фиксации МП?
25.В чём заключается метод внеклеточной фокальной регистрации МП?
26.В чём заключается петч-кэмп-метод регистрации МП?
76
