
6 курс / Клинические и лабораторные анализы / Группы крови человека
.pdfАнтигены Н, А и В формируются трансферазами, которые присоединяют соот- ветствующиемоносахаридыкцепям-предшественникам.
Н-антиген представлен L-фукозой, присоединенной в позиции С-2 терминального галактозного остатка.
А- и В-антигены появляются в результате присоединения к фукозилированному галактозному остатку (Н-антигену) N-ацетил-D-галактозамина или D-галактозы в позиции С-3. Хотя структура Н-антигена представлена не только фукозой, данная группировка считается иммунодетерминантной, поскольку дефукозилирование приводит к утрате Н-серологической активности субстрата. Аналогичным образом N-ацетил-D-галактозамин и D-галактозу относят к иммунодетерминантным структурам, определяющим А- и В-серологическую актив-
ность соответственно (Schenkel-Brunner [195]).
Выделяют шесть типов АВН-активных цепей (типы 1 – 6). Цепи типа 1 присутствуют в секретах, плазме и тканях энтодермального происхождения. Цепями типа 2 представлено большинство АВН-активных олигосахаридов на эритроцитах и в тканях экто- и мезодермального происхождения. Тип 3 несет антигенные детерминанты в гликолипидах эритроцитной мембраны и в муцине у индивидов группы А (Anstee [68]). Тип 4 связан с гликолипидами и представлен в небольшом количестве на эритроцитах (Anstee [68], Daniels [87], Schenkel-Brunner [195]). Тип 6 присутствует в виде свободных олигосахаридов в грудном молоке и моче. Цепи 5-го типа в организме не встречаются, они синтезированы искусственно (Daniels [87], Schenkel-Brunner [195]).
Синтез Н-антигена происходит при участии α1,2-L-фукозилтрансферазы, которая обеспечивает перенос фукозы от гуанозин-дифосфата (ГДФ) к галактозному остатку цепи-предшественника в позиции С-2. Известны 2 типа α1,2-L- фукозилтрансферазы, синтез каждого из них контролируют высокогомологичные, однако генетически независимыме друг от друга локусы FUT1(H) и FUT2(SE). Они расположены на хромосоме 19. Продукты указанных генов (ферменты) обеспечивают фукозилирование и образование Н-активных структур в различных тканях. FUT1(H) обладает большей аффиностью к цепям типа 2, в то время как FUT2(SE) – к цепям 1-го типа. У подавляющего большинства людей антиген Н присутствует в обязательном порядке, Н-дефицитные фенотипы очень редки.
Н-антиген, образовавшийся в результате действия α1,2-L-фукозилтрансфераз, является субстратом для дальнейшего гликозилирования А- и В-специфическими трансферазами, обеспечивающими присоединение иммунодетерминантных группировок: N-ацетил-D-галактозамина и / или D-галактозы, после чего субстрат при- обретаетА-и / илиВ-антигенныесвойства.
Гены, контролирующие А- и В-трансферазы, независимы от локусов FUT1(H) и FUT2(SE), картированы на хромосоме 9, в локус АВО. Последний нередко содержит молчащие аллели О1, О2 и др., в присутствии которых синтеза А- и В-трансфераз не происходит. У лиц, гомозиготных по таким аллелям, вещество Н не конвертируется далее в антигены А.
111
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Присутствие Н-, А- и В-трансфераз в сыворотке крови и на эритроцитах устанавливают с помощью специфических антител, которые нередко образуются после трансплантации органов (Eiz-Vesper и соавт. [96]).
Н. В. Бовин и др. (1990) создали искусственные А- и В-субстанции биохимическим синтезом, однако они, несмотря на их структурное сходство с естественным группоспецифическим веществам, не нашли применения, поскольку их адсорбционная активность в отношении α- и β-изогемаагглютининов была низкая.
Молекулярная генетика систем АВО и Н
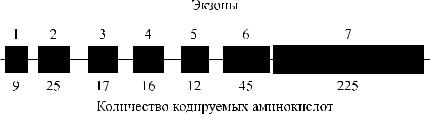
Как уже указывалось выше, серологически определяемые антигены А, В и Н не являются непосредственными продуктами генов. Гены А, В и Н контролируют синтез соответствующих трансфераз. В настоящее время строение генов АВО и Н расшифровано (рис. 3.7). Их удалось клонировать и секвенировать. Расшифрована также аминокислотная последовательность А- и В-трансфераз, которые отличаются друг от друга двумя аминокислотами в позициях 266 и 268 (рис. 3.8).
Рис. 3.7. Строение гена АВО.
MARVLRTLAG |
KPKCHALRPM |
ILFLIMLVLV |
LFGYGVLSPR |
SLMPGSLERG |
50 |
FCMAVREPDH |
LQRVSLPRMV |
YPQPKVLTPC |
RKDVLVVTPW |
LAPIVWEGTF |
100 |
NIDILNEQFR |
LQNTTIGLTV |
FAIKKYVALF |
KLFLETAEKH |
FMVGHRVHYY |
150 |
VFTDQPAAVP |
RVTLGTGRQL |
SVLEVRAYKR |
WQDVSMRRME |
MISDFCERRF |
200 |
LSEVDYLVCV |
DVDMEFRDHV |
GVEILTPLFG |
TLHPGFYGSS |
REAFTYERRP |
250 |
QSQAYIPKDE *GDFYYLGGFF |
GGSVQEVQRL |
TRACHQAMMV |
DQANCIEAVW |
300 |
|
HDESHLNKYL |
**GDFYYMGAFF |
PEYLWDQQLL |
GWPAVLRKLR |
FTAVPKNHQA |
350 |
LRHKPTKVLS |
|||||
VRNP |
|
|
|
|
354 |
Рис. 3.8. Аминокислотная последовательность А-* и B-трансферазы**.
Гены АВО содержат по 1062 пары оснований и кодируют пептиды, состоящие из 354 аминокислот (Reid, Lomas-Francis [186]). Секвенирование генов А и В позволило установить отличающие их последовательности в 7 кодонах, 4 из них (в позициях 176, 235, 266 и 268) могут быть причиной замены аминокислот в трансферазах. Секвенирование гена О1 показало его идентичность с А1 до нуклеотида 261, с которого рамка считывания нарушается с образованием стоп-кодона (Daniels [87]). Такой аллель кодирует синтез пептида, не обладающего какой-либо трансферазной активностью. Возможно также образование
112
нестабильного информационного РНК-транскрипта. Секвенирование гена А 2 выявило делецию одного нуклеотида в кодоне, предшествующем стопкодону в аллеле А1. Делеция приводит к инактивации стоп-кодона и синтезу А-трансферазы, которая содержит 21 аминокислотный остаток дополнительно (Olsson и соавт. [174]). Аллель О, описанный Yamamoto и соавт. [238], в настоящее время получил обозначение О1. Другой аллель О, встречающийся с высокой частотой и получивший обозначение O1v (О1-вариант), также характеризуется делецией в позиции 261. В его присутствии синтез активной трансферазы блокируется (Olsson и соавт. [174]). Еще один вариант аллеля О, обозначенный как О2, не содержит делеции в позиции 261, однако отличается от А1 двумя кодонами, и как результат заменами аминокислотArg 176 Gly и Gly 268Arg. Замена аргинина на глицин приводит к конформационным изменениям молекулы трансферазы и отражается на ее специфической активности.
Синтез АВО-трансфераз контролируют 7 экзонов протяженностью 18 кб, причем на долю экзонов 6 и 7 приходится 77 % генетическго материала (см. рис. 3.7). Делеция G 261 в генах O1 и O1v выявлена в экзоне 6. Замены нуклеотидов, определяющие различия аллелей А, В и О2, локализуются в экзоне 7 (табл. 3.14).
Таблица 3.14
Нуклеотидаяя последовательность в экзонах 6 и 7 локуса АВО, определяющая фенотипические различия
|
|
|
|
|
Позиция нуклеотидов в экзоне |
|
|
|
|
||||||||
|
|
6 |
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
2 |
2 |
4 |
5 |
6 |
6 |
6 |
7 |
7 |
7 |
8 |
8 |
8 |
8 |
9 |
1 |
1 |
Локализация |
6 |
9 |
6 |
2 |
4 |
5 |
8 |
0 |
7 |
9 |
0 |
0 |
2 |
7 |
3 |
0 |
0 |
|
1 |
7 |
7 |
6 |
6 |
7 |
1 |
3 |
1 |
6 |
2 |
3 |
9 |
1 |
0 |
5 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
0 |
Аллель А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А101 |
G A C |
C |
T |
C |
G |
G C |
C |
G |
G |
G |
G |
G C |
C |
||||
А102 |
" |
" |
T |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
|
А201 |
" |
" |
T |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
d |
А301 |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
" |
d |
" |
" |
" |
Ах01 |
" " " |
" A |
" " " " " " " " |
" " " " |
|||||||||||||
Цис-АВО1 |
" |
" |
T |
" |
" |
" |
" |
" |
" |
" |
" |
" |
C |
" |
" |
" |
" |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аллель В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В101 |
" |
G |
" |
G |
" |
T |
" |
A |
" |
A |
" |
C |
" |
" |
A |
" |
" |
В301 |
" |
G |
" |
G |
" |
T |
" |
A |
" |
A |
" |
C |
" |
" |
A |
T |
" |
В(А)01 |
" |
G |
" |
G |
" |
" |
" |
" |
" |
A |
" |
C |
" |
" |
A |
" |
" |
Аллель О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О01 |
d " " " " |
" " |
" " " " " " " " " " |
||||||||||||||
О02 |
d G " " A " A " T " " " A " " " " |
||||||||||||||||
О03 |
" G " G " " " " " " A " " " " " " |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
113
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Выявлено несколько вставок: гуанин-цитозин (GC boxes), которые находятся выше кодона, инициирующего транскрипцию, и могут играть важную роль в регуляции активности трансфераз. Транскрипция генетической информации зависит от мини-сателлитов – участков размером 4 кб, расположенных выше начального участка считывания. Эксперименты с трансфекцией генов показали, что активность транскрипции гена А по сравнению с В существенно ниже.
Найдены часто встречающиеся аллели, характерные для представителей различных этнических групп. Так, примерно 80 % аллелей А1 среди японцев отличались от аллелей А1 европейцев мутацией, ведущей к замене пролина на лейцин в положении 156. Однако это никак не проявляло себя на фенотипическом уровне (Olsson и соавт. [176–178]). Вместе с тем вставка одного нуклеотида в позиции от 798 до 804 в аллеле А2 приводила к синтезу продукта, не обладающего трансферазной активностью (аллель О 3) (Olsson и соавт. [179]). При сравнении нескольких аллелей установлена их гибридная природа. Образование гибридов, включающих фрагменты двух разных аллелей, авторы объясняют кроссинговером во время мейоза. В большинстве случаев кроссинговер затрагивал экзон 6. При наличии делеции G 261 экзон 7 фенотипически не проявлялся. В тех случаях, когда экзон 6 не содержал указанной делеции, экзон 7 аллеля А1 или О 1 проявлял себя фенотипически как А1-серологическая активность. Экзон 7 аллеля O 1v проявлял себя как А2-серологическая актив-
ность (Ogasawara [170]).
Описана семья, в которой мать имела группу В, ребенок – А, отец – О. На первый взгляд, такие результаты серологического исследования в традиционной интерпретации должны были исключить отцовство. Однако результаты молекулярно-генетического исследования не позволили этого сделать. Секвенирование генов АВО членов данной семьи показало, что у ребенка имелся гибридный ген, экзон 6 которого содержал фрагменты гена В, а экзон 7 – фрагменты гена O 1v. Поскольку экзоны 7 аллелей А1 и O 1v идентичны, а в экзоне 6 указанного гибридного гена, В-O 1v, отсутствовала делеция G 261 (стоп-кодон), на эритроцитах ребенка сформировался антиген А (Olsson и соавт. [177]). Вероятно, этот В-O1 v-гибридный ген с А-трансферазной активностью возник во время мейоза в результате кроссинговера.
В литературе появляется все больше материалов, свидетельствующих о гетерогенности аллелей А, В, Н и Se среди представителей различных рас и этнических групп. Молекулярно-генетические методы позволяют выявлять варианты генов с точковыми мутациями, делециями, гибридными включениями (табл. 3.14, 3.15, 3.16, рис. 3.8), приводящими к формированию стоп-кодонов, инактивации участков сплайсинга (Ogasawara и соавт. [170]). В ряде случаев отмечены эпистатические эффекты в виде аллельного угнетения (Feng и соавт. [101]) или, напротив, аллельного усиления активности генов (Morel и соавт. [162], Ogasawara и соавт. [171]). Структурные особенности генов часто не проявляют себя и лишь в редких случаях приводят к появлению необычных
114
фенотипов с отсутствием или ослаблением экспрессии антигенов А, В и Н [81, 83, 98, 100, 106, 113–115, 124, 126, 131, 141–143, 166, 173, 174, 176–179, 183, 198, 209–211, 220, 222, 242, 248, 249].
Степень гомологии генов АВО человека и высших обезьян достигает 95 %. Это позволяет полагать, что гены АВО возникли не менее 13 миллионов лет назад, то есть значительно раньше разделения высших приматов на отдельные виды: шимпанзе, гориллы, орангутанги и др. (Roubinet и соавт. [190]). Считается, что гены АВО в эволюционном плане высококонсервативны. Эволюционный возраст терминальных углеводных группировок, определяющих групповую принадлежность, вероятно, исчисляется миллиардами лет.
|
|
|
|
|
Таблица 3.15 |
|
|
|
|
Аллели, ассоциированные со слабой экспрессией А |
|||
|
|
|
|
|||
Фенотип |
Аллель |
Замена нуклеотидов |
Замена аминокислот |
|||
|
|
|
|
|||
А3 |
A3-1 |
G 871A |
Asp 291Asn |
|||
А3 |
A3-2 |
G 829A, delC1060 5′ участок |
Val 277 Met, Pro 354 FS |
|||
сплайсинга в интроне 6 |
||||||
|
|
|
|
|
|
|
A |
finn |
Ax-1 |
T 646A |
Phe 216 Ile |
||
|
|
|
|
|||
|
|
|
|
|
|
|
Ax |
Ax-2, -4, -5; |
T646A,G681A,C771T,G829A |
Phe 216 Ile, Val 277 Met |
|||
A1-O1v |
||||||
A |
x |
Ax-3 |
A297 G, T 646A, G 681A |
Phe 216 Ile, Val 277 Met |
||
|
|
|
|
|
||
|
|
|
|
|
||
A |
x |
B-O1v-гибрид |
C 771 T, G 829A |
Phe 216 Ile |
||
|
|
|
|
|
||
|
|
|
|
|
||
A |
x |
Ax-6 |
G 996A |
Thr 332 Стоп |
||
|
|
|
|
|
||
|
|
|
|
|||
Ael |
Ael-1; A*109 |
+ G G798-804 |
Phe 269, FS |
|||
A |
el |
Ael-2; A*110 |
C 467 T, G 829A |
Pro 156 Leu, Phe 216 Ile |
||
|
|
|
|
|
||
|
|
|
|
|
||
A |
w |
Aw-1 |
C 407 T, С 467 T, del C1060 |
Thr 136 Met, Pro 156 Leu |
||
|
|
|
|
|
||
|
|
|
|
|
|
|
Aw |
Aw-2 |
C 350 G, C 467 T, del C 1060 |
Pro 156 Leu, Gly 177Ala, |
|||
Pro 354 FS |
||||||
A |
|
Aw-3 |
G 203 C, C 467 T, del C 1060 |
Arg 68 Thr, Pro 156 Leu, |
||
w |
Pro 354 FS |
|||||
|
|
|
|
|||
|
|
|
|
|
||
A |
w |
Aw-4 |
C 712 T |
Arg 241 Trp |
||
|
|
|
|
|
||
|
|
|
|
|
||
A |
w |
Aw-5 |
A965 G |
Glu 322 Gly |
||
|
|
|
|
|
||
|
|
|
|
|||
Примечание. del – делеция, FS – изменение рамки считывания |
||||||
|
|
|
|
|
115 |
|
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Таблица 3.16
Аллели, ассоциированные со слабой экспрессией В
Фенотип |
Аллель |
Замена |
Замена |
|
нуклеотидов |
аминокислот |
|||
|
|
|
|
|
B |
3 |
B3-1 |
C 105 4T |
Arg 352 Trp |
|
|
|
|
|
B |
x |
Bw-1 *B104 |
G 871A |
Asp 291Asn |
|
|
|
|
|
B |
el |
Bel-1*B105 |
T 641 G |
Met 214Arg |
|
|
|
|
|
B |
el |
Bel-2 *B106 |
G 669 T |
Glu 223Asp |
|
|
|
|
|
B |
w |
Bw-2 |
C 873 G |
Asp 291 Glu |
|
|
|
|
|
B |
w |
Bw-3 |
C 721 T |
Arg 241 Trp |
|
|
|
|
|
B |
w |
Bw-4 |
A748 G |
Asp 183 Gly |
|
|
|
|
|
B |
w |
Bw-5 |
G 539A |
Arg 180 His |
|
|
|
|
|
B |
w |
Bw-6 |
A1036 G |
Lys 346 Glu |
|
|
|
|
|
B |
w |
Bw-7 |
G 1055A |
Arg 352 Gln |
|
|
|
|
|
B |
w |
Bw-8 |
T 863 G |
Met 288Arg |
|
|
|
|
|
Высокая степень гомологии локуса АВО человека обнаружена также при сравнении с аналогичными локусами других млекопитающих: хомяков, крыс, мышей, овец, коров, кроликов, кошек и собак (Daniels [87], Roubinet и соавт. [190]). Интересная деталь: трансферазная активность локуса АВО у мышей вдвое выше, чем у человека (Roubinet и соавт. [190]).
Высокая степень подобия выявлена при секвенировании генов FUT1(Hh) и FUT2(Se) (табл. 3.17, см. рис. 3.8). Полагают, что локус FUT2 мог произойти в результате преобразования гена FUT1 (Daniels [87]).
Таблица 3.17
Аминокислотная последовательность гликозилтрансфераз у млекопитающих
Вид |
Аллель, антиген, энзим |
Высокогомологичный фрагмент аминокислотной |
|
последовательности |
|
||
|
|
|
|
Человек |
А101 |
FTYERRPQSQAYIPKDEGDFYYLGGFFGG |
272 |
Человек |
В101 |
FTYERRPQSQAYIPKDEGDFYYMGAFFGG |
272 |
Человек |
О01 |
FTYERRPQSQAYIPKDEGDFYYLGRFFGG |
272 |
Человек |
цис-АВ |
FTYERRPQSQAYIPKDEGDFYYLGAFFGG |
272 |
Мышь |
АВ |
FTYERRPQSQAYIPWDRGDFYYGGAFFGG |
251 |
Свинья |
А |
FTYERRPLSQAYIPRDEGDFYYAGGFFGG |
282 |
Собака |
Антиген Форссмана |
FPYERRHISTAFVAENEGDFYYGGAVFGG |
267 |
|
|
|
|
Мышь |
Галактозилтрансфераза |
FTYERRELSAAYIPFGEGDFYYHAAIFGG |
312 |
|
|
|
|
Корова |
Галактозилтрансфераза |
FTYERRKESAAYIPFGEGDFYYHAAIFGG |
286 |
|
|
|
|
Крыса |
IGb3 |
LPYERDKRSAAALSLSEGDFYYMAAVFGG |
259 |
|
|
|
|
116
АВО-генотипирование
РазработаныметодыАВО-генотипированиясиспользованиемполимеразнойцеп-
ной реакции (Gassner и соавт. [110], Misfud и соавт. [153], Stroncek и соавт. [206],Yip [239],Yoshidaисоавт.[245]).Благодаряихиспользованиюустановленоболее140отличающихся аллелей АВО и более 20 аллелей Н (табл. 3.18, 3.19) (Seltsam и соавт. [193]). Изучение характера их распределения позволило выявить некоторые расовые и этнические особенности, которые серологическими методами не определяются(Olssonисоавт.[175,179]).НаибольшеечислонеобычныхаллелейАВОиНвыяв-
леносредимонголоидов(Fukumoriисоавт.[106],Ogasawaraисоавт.[172],Yip[239]).
Таблица 3.18
Мутации гена FUT1, ассоциированные с Н-дефицитными фенотипами
Аллель |
Мутация |
Замена аминокислот |
h 35 / 980 |
C 35 T,A980 C |
Ala 12 ValAsn 327 Thr |
h 349 |
C 349 T |
His 117 Tyr |
h 442 |
G 442 T |
Asp 148 Tyr |
h 460 |
T 460 C |
Tyr 154 His |
h 460,1042 |
T 460 C, G 1042A |
Tyr 154 His Glu 348 Lys |
h 461 |
A461 G |
Tyr 154 Cys |
h 491 |
T 491A |
Leu 164 His |
h 513 |
G 513 C |
Trp 171 Cys |
h 522 |
C 522A |
Phe 174 Leu |
h del547 / 548 |
delAG 547-552 |
Кодон 183 / 184 |
h 658 |
C 658 T |
Arg 220 Cys |
h 659 |
G 659A |
Arg 220 His |
h 695 |
G 695A |
Trp 232 стоп |
h 721 |
T 721 C |
Tyr 241 His |
h 725 |
T 725 G |
Leu 242Arg |
h 776 |
T 776A |
Val 259 Glu |
h 785,786 |
G 785AC 786A |
Ser 262 Lys |
h 801 |
G 801 C или G 801 T |
Trp 267 Cys |
h 826 |
C 826 T |
Gln 276 стоп |
h 832 |
G 832A |
Asp 278Asn |
h del880 / 881 |
Делеция TT 880-882 |
Кодон 274 |
h 944 |
C 944 T |
Ala 315 Val |
h 948 |
C 948 G |
Tyr 316 стоп |
h del960 / 970 |
Делеция CT 969, 970 |
Кодон 323 / 324 |
h del990 |
Делеция G 990 |
Кодон 330 |
h 1047 |
G 1047 C не выявлен |
Trp 349 Cys |
117
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Таблица 3.19
FUT2- дефицитные аллели, ассоциированные с невыделительством
Аллели |
Мутации |
Замены аминокислот |
|
Se w385 |
A385 T |
Ile 129 Phe |
|
se428 |
G 428A |
Trp 1435 стоп |
|
se571 |
C 571 T |
Arg 191 стоп |
|
se628 |
C 628 T |
Arg 210 стоп |
|
se658 |
C 658 T |
Arg 220 стоп |
|
se685 |
Делеция GTG 685 - 689 |
Делеция Val 229 или 230 |
|
se688 |
Делеция GTG 688 - 690 |
Делеция Val 230 |
|
se778 |
Делеция C 788 |
Изменение рамки считывания |
|
Pro 260, 275 стоп |
|||
|
|
||
|
|
|
|
se849 |
G 849A |
Trp 283 стоп |
|
sedel |
Делеция экзона 2 |
|
|
se fus |
Sec1FUT2 слияние |
|
Примечание.стоп–прекращениесинтезаполипептиднойцепипосле указаннойпозиции.
Группы крови и объем особи в пространстве
Большинству людей не свойственно задумываться над простыми вещами. Например: рост 175 см, масса тела 75 кг. Что в этом удивительного? На самом деле,объеморганизма,занимаемыйимвокружающейсреде,егопространственная структура – интереснейшее явление, напрямую связанное с групповыми антигенами и антителами. В данном случае речь идет не столько о 4 группах крови АВО, сколько о совокупности всех антигенов, общей антигенной массе, составляющей организм,испециальныхконтролирующихееантиидиотипическихантителах.
Как поддерживается объем тела? С одной стороны – клеточная масса (масса антигена), с другой – антитела, удерживающие эту массу в установленных рамках. Все, что выходит за рамки дозволенного, отсекается, в том числе атипичные, мутантные, стареющие клетки. Организм таким образом сохраняет объем, внешнюю пространственную структуру и обеспечивает постоянство внутренней среды.
Человек не может произвольно менять объем костной и мышечной массы. Они жестко лимитированы индивидуальной генетической программой. Изменить программу можно лишь с помощью анаболических гормонов в сочетании с усиленными физическими нагрузками.
Жиры лишены групповых антигенов и не имеют соответствующих антител. Накопление их в организме не ограничено, а скорее, наоборот, предусмотрено. Этим процессом человек, как правило, может управлять, регулируя массу тела
118
соразмеренным образом жизни, включая дозированные физические нагрузки и адекватное питание.
Группы крови и диета
Групповая принадлежность крови не определяет вкусовые предпочтения индивида, а также способность организма перерабатывать и усваивать те или иные пищевые продукты. Рекомендации по соблюдению различных диет в зависимости от группы крови АВО не имеют под собой научного обоснования.
Математические, музыкальные и другие способности также не зависят от группы крови. Высказывания о том, что обладатели первой группы крови по складу характера охотники, второй – пахари, третьей – воины, четвертой – интеллектуалы – не более чем развлекательный домысел.
Внимательный читатель легко обнаружит, что пропагандисты диеты по группе крови наряду с набором продуктов (во многом совпадающим для всех групп) рекомендуют оптимальный режим труда и отдыха, уход от стрессов, отказ или сдержанное употребление алкоголя, прогулки, физические упражнения, водные процедуры и другие общеукрепляющие виды воздействия. Соблюдение этих рекомендаций – путь к здоровью и долголетию. Они, несомненно, приносят пользу, хотя групповая принадлежность крови и продолжительность жизни никак не связаны.
Уместно упомянуть еще одно обстоятельство: до 1900 г. человечество не знало о существовании групп крови и не испытывало в связи с этим какого-либо неудобства в плане качества жизни.
Группы крови и болезни
Установлены слабые ассоциации фенотипов АВО с некоторыми видами патологии. Так, в 1951 г. Aird и соавт. [66] указали на повышенную частоту группы крови А среди больных раком желудка.
Среди больных язвенной болезнью желудка и двенадцатиперстной кишки почти на 10 % увеличена частота группы крови О. На пищеварительный тракт лиц, имеющих группу крови О, приходится большая антигенная нагрузка полисахаридами А и В по сравнению с людьми, имеющими другие группы крови. Однако какие-либо эксперименты в этом направлении не проводились, и приведенное положение остается не доказанным.
По данным Н.Д. Герасимовой [11], группу крови А чаще выявляли у больных раком легких, молочной железы, толстой кишки.
Группу А чаще обнаруживали среди больных атеросклерозом магистральных сосудов нижних конечностей (C.А. Фатьянов, В.А. Мороков [62]).
У лиц группы А чаще отмечали нарушение свертываемости крови
(В.Н. Шабалин, Л.Д. Серова [64], Moeller и соавт. [156]).
Группа крови А чаще, чем другие группы крови, встречается среди больных карциномой, пернициозной анемией, ревматизмом, оспой и лепрой. У лиц
119
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
группы А чаще находят повышенное содержание факторов светывания крови V, VIII и IX. Как следствие, у лиц группы А чаще возникают тромбоэмболические осложнения.
По данным других авторов, индивиды группы А в большей степени подвержены вирусным инфекциям (Henry и соавт.).
Среди лиц, имеющих группу крови А, чаще выявляли индивидов с низким уровенем интерферона в сыворотке крови (С.И. Донсков и др. [22]). Интерферонобразующая способность их лейкоцитов также снижена. Как известно, интерферон обеспечивает противоопухолевую и антивирусную защиту организма. Возможно относительный дефицит интерферона у людей, имеющих группу крови А, и объясняет меньшую их устойчивость по отношению к опухолевым и вирусным заболеваниям (С.И. Донсков и др. [22]).
Лиц группы А можно отнести к менее защищенным от воздействия экзогенных патогенов, несущих группоспецифические полисахариды А и В. Изогемагглютинин β, содержащийся в сыворотке их крови, менее активен по сравнению с изогемагглютининами, содержащимися в сыворотке крови лиц, имеющих группу О и В. Патоген, несущий А-подобную субстанцию, также не встречает должного сопротивления в организме лиц А в силу химического сродства.
Имеются сообщения, что люди с группой крови В в большей мере подвержены урогенитальным инфекциям и инфекциям, вызванным Streptococcus pneumonia и Escherichia coli (Nydegger и соавт. [169]). Эту группу крови чаще выявляли среди заболевших гонореей.
Частота группы крови О выше среди лиц, страдающих туберкулоидной формой лепры, инфекционным паротитом и туберкулезом.
Среди больных инфекциями, вызыванными Neisseria meningitidis,
Haemophilis influenzae или Candida albicans, невыделителей групповых субстан-
ций регистрировали чаще, чем выделителей.
Следует подчеркнуть, что относительная связь некоторых заболеваний с групповой принадлежностью крови характеризует лишь популяцию в целом, и не может быть основанием для медицинского заключения о предрасположенности конкретного человека к тому или иному заболеванию. Вместе с тем проведение профилактических мероприятий в группах повышенного риска тех или иных заболеваний, по-видимому, могло бы дать положительные результаты. Такие модели здравоохранения обсуждаются, однако на практике их не применили (В.Н. Шабалин, Л.Д. Серова [64], С.И. Донсков [18]).
Небезынтересны курьезные сообщения о том, что люди, имеющие группу крови А, тяжелее переносят похмелье, а людей, имеющих группу крови О, охотнее кусают москиты. Сообщалось, что лица А обладают высоким интеллектуальным потенциалом и в связи с этим составляют большинство в высших социальных группах населения, а также среди анестезиологов Бруклина и молекулярных генетиков Чили. Выявлены ассоциации групп крови
120
