
Радиобиология / Моссэ И. Б., Морозик П. М. Генетические эффекты ионизирующей радиации
.pdfпоследовательности ДНК в образце. Для анализа в режиме «реального време- ни» используют специальные ДНК-амплификаторы с оптическим блоком, по-
зволяющие детектировать флуоресценцию внутри реакционной пробирки в ходе реакции. Сигнал флуоресценции в ходе ПЦР возрастает пропорцио- нально количеству продукта амплификации. Главным преимуществом детек-
ции результатов ПЦР в режиме «реального времени» является возможность проведения количественного анализа.
ПЦР обеспечивает в настоящее время уникальную возможность оценки частоты мутаций по отдельным генам, а использование современной техноло- гии молекулярных чипов может позволить получить уникальную информа-
цию сразу по нескольким тысячам генов.
1.4.2.Технология анализа последовательности ДНК
спомощью биочипов
Впоследние годы технологии прямой ДНК-диагностики вышли на каче- ственно новый уровень в связи с появлением методов так называемого парал- лельного молекулярно-генетического анализа, позволяющих проводить одно-
временный мутационный скрининг большого числа образцов и значительно ускорить выявление мутаций в изучаемых генах. К ним относятся секвениро-
вание, технология капиллярного электрофореза, использование ДНК-биочи- пов и целый ряд других новейших разработок.
Биологический микрочип (биочип) – это матрица микроячеек, содержащая молекулы зонда (белков, нуклеиновых кислот, биомакромолекул или био-
структур) для одновременного проведения большого числа анализов в одном образце. Молекулы в биочипе размещены организованно на специальном но- сителе (платформе, подложке), в качестве которого может быть пластик, стек- ло, кремний. При этом организованное размещение макромолекул на плат- форме занимает очень небольшой участок. Характерные размеры ячеек совре-
менных микрочипов составляют 50–200 микрон, общее число ячеек на чипе – 103–105, размеры чипа – около 1 см.
Биочипы в настоящий момент широко используются в диагностике in vitro
ипозволяют проводить индивидуальный анализ множества генов, белков
иклеточных секретов для каждого конкретного организма.
Наибольшее распространение получили ДНК-биочипы. Эта технология позволяет использовать сравнительно небольшие количества исходного мате- риала, проводить реакцию в микрообъемах, одновременно осуществлять мно-
гопараметрический анализ множества генов одного и того же объекта [24]. Методика проведения исследования состоит собственно из приготовления
ДНК-биочипа, пробоподготовки, гибридизации и анализа полученных дан-
ных (рис. 1.19).
В основе механизма действия биочипов лежит молекулярное распознава- ние анализируемых молекул иммобилизованными молекулами-биополимера-
60
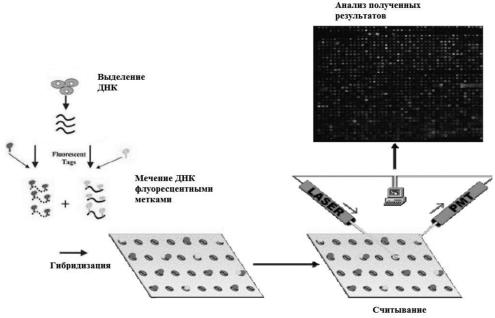
Рис. 1.19. Технология анализа последовательности ДНК с помощью ДНК-биочипов
ми с известной последовательностью нуклеотидов, нанесенными на чип. Это распознавание построено на гибридизации комплементарных цепей ДНК.
Вслучае, когда соответствие между нуклеотидами иммобилизованной
игибридизуемой ДНК точно удовлетворяет условиям комплементарности, происходит гибридизация (связывание) и образуется стабильная двухнитча- тая спираль. Однако присутствие в последовательности ДНК даже одной не-
правильной пары предотвращает гибридизацию.
Если иммобилизовать в одном из элементов микрочипа специфическую одноцепочечную ДНК, то при добавлении к микрочипу меченных флуорес-
центными красителями фрагментов ДНК генома человека, будет происходить их высокоспецифичное взаимодействие. При взаимодействии биочипа с ис- следуемым образцом, предварительно обработанным флуоресцентным краси-
телем, в соответствующих ячейках происходит химическая реакция, эти ячейки начинают светиться – тем сильнее, чем интенсивнее процесс [25]. Заданный олигонуклеотидный элемент биочипа специфически свяжет только одну ком-
плементарную последовательность из всех возможных последовательностей этой длины в ДНК. В результате флуоресцентное свечение наблюдается толь-
ко на этом комплементарном элементе (ячейке) биочипа.
Интенсивность флуоресценции в ячейках измеряют с помощью прибораанализатора биочипов – сканера или люминесцентного микроскопа, передающего сигнал на прибор с зарядовой связью. Флуоресценция является основным, но не единственным методом изучения гибридизации. В частности, данные
61
о характере гибридизации можно получить также с помощью масс-спектро- метрии, атомной силовой микроскопии и др.
Разработаны биочипы, распознающие короткие олигонуклеотидные по-
следовательности и позволяющие детектировать единичные мутации в генах. Наноразмерная длина олигонуклеотидов, нанесенных на микрочип, является одним из ключевых факторов, определяющих их высокую эффективность и специфичность.
Биочипы позволяют быстро проанализировать большое число генов, еди- новременно оценить экспрессию большого количества различных генов, срав- нить их активность в здоровых и пораженных клетках, определить эпигенети-
ческие изменения в генах, существенно снизить себестоимость анализов [26].
1.4.3. Секвенирование ДНК
Секвенирование ДНК является самым объективным методом регистрации мутаций, при котором точно идентифицируется молекулярный характер по- вреждения [27]. Однако применение данного метода ограничивает его трудо-
емкость и высокая стоимость.
Секвенирование ДНК – это процесс определения ее точной нуклеотидной последовательности. Применяется этот метод для обнаружения неизвестных нуклеотидных замен в анализируемом участке (участках) гена.
Известно несколько методов определения порядка нуклеотидов в ДНК [28]. На практике наиболее широкое распространение получило секвенирова-
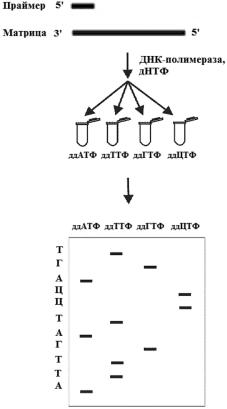
ние по классическому методу Сэнгера. Изучаемый фрагмент ДНК играет роль матрицы, на которой при участии праймера, дезоксирибонуклеотид-трифос- фатов (дНТФ) и ДНК-полимеразы инициируется направленный комплемен- тарный синтез новых молекул ДНК, осуществляемый одновременно в четы-
рех параллельных реакциях. Обычно до начала секвенирования производят амплификацию участка ДНК, последовательность которого требуется опреде- лить, при помощи ПЦР. Смысл метода в том, что в каждую из реакций добав- ляется один из четырех химически измененных дНТФ (терминаторов) – диде-
зоксинуклеозид-трифосфаты, ддНТФ (ддАТФ, ддЦТФ, ддГТФ и ддТТФ) [29]. Эти терминаторы при встраивании в состав ДНК обрывают дальнейший син-
тез полинуклеотидной цепи (рис. 1.20).
Врезультате этого в каждой из пробирок накапливается набор дочерних мо-
лекул ДНК различной длины, оканчивающихся строго на один и тот же ддНТФ, случайным образом присоединившийся к растущей цепи. После электрофореза продуктов этих реакций в полиакриламидном геле в четырех соседних дорож-
ках проводится считывание информации от более коротких фрагментов к более длинным, при этом выявляемый пошаговый порядок удлинения цепей и отра-
жает последовательность нуклеотидов в составе анализируемой ДНК.
Всовременном варианте дидезоксинуклеотиды метят четырьмя разными флуоресцентными красителями и проводят ПЦР в одной пробирке, процесс
62
автоматизирован, и для детекции результатов используется капиллярный элек-
трофорез [27].
Размеры секвенируемых участков ДНК при секвенировании по Сэнгеру обычно не превышают 1000 пар нукле-
отидов. В результате секвенирования перекрывающихся участков ДНК, по-
лучают последовательности участков генов, целых генов, тотальной мРНК и даже полных геномов организмов.
Секвенирование полного генома обычно осуществляют при помощи тех- нологий секвенирования нового поко-
ления (next-generation sequencing) [28].
Технология методов секвенирования нового поколения позволяет «прочитать» единовременно сразу несколько участ- ков генома, что является главным отли- чием от более ранних методов секвени- рования. Секвенаторы «нового поколе-
ния» не используют метод терминации цепи Сэнгера и капиллярный электро-
форез.
Принципы работы приборов (амплификация участков генома и детекция
нуклеотидов в прочтенных последовательностях) различаются в зависимости от производителя, однако все они базируются на секвенировании ДНК-чипов, используя интерактивные циклические ферментативные реакции с дальней- шим сбором полученной информации в виде изображений. Полученные дан-
ные применяются для восстановления нуклеотидной последовательности. Общая схема работы для всех секвенаторов одинаковая:
1)создание библиотеки случайных последовательностей ДНК, которые можно будет сшить с общедоступными последовательностями;
2)создание ампликонов с помощью ПЦР, которые будут использованы как образцы;
3)определение первичной структуры всех фрагментов.
По принципу работы современные секвенаторы можно разделить на осно- ванные на лигировании, на пиросеквенировании и полупроводниковые секве- наторы, у каждого из которых есть свои преимущества и недостатки. Произ-
водительность таких секвенаторов на несколько порядков превосходит производительность самых мощных капиллярных приборов и достигает сотен миллиардов пар оснований за запуск.

Глава 2
РАДИОГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ НА РАЗНЫХ УРОВНЯХ ОРГАНИЗАЦИИ ЭУКАРИОТ
2.1.Молекулярно-клеточный уровень
2.1.1.Первичные повреждения, вызываемые в ДНК ионизирующей радиацией
Живые организмы в течение всей истории их существования на Земле подвергались воздействию радиации в виде излучений с высокой энергией (гамма-лучи и продукты ядерного распада), а также в виде ультрафиолетового света, видимого света и инфракрасных лучей. Особое значение для процессов наследственной изменчивости у современных форм жизни имеет влияние на них различных излучений.
Понять действие излучений на живую клетку можно лишь путем выясне-
ния сущности явлений, лежащих в основе взаимодействия энергии квантов, проникших в клетку, с веществами клетки. Квант энергии, проникающий
вклетку, взаимодействует с атомами и молекулами. Это физическое взаи- модействие приводит к появлению радиационно-химических процессов, веду-
щих к изменению биохимических и затем биологических свойств клетки. Излучения с высокой энергией, как электромагнитные в виде гамма-лучей и рентгеновских лучей, так и излучения ядерных частиц в виде протонов, нейтронов и других, получили название ионизирующих за способность вы-
зывать появление пар ионов в поглощающей их среде. Кроме того, все они
втой или иной мере вызывают возбужденное состояние молекул.
Квант энергии электромагнитных излучений или заряженная частица вы-
рывает электрон из внешней оболочки атома или молекулы. Теряя электрон, такая молекула или атом становится положительно заряженным ионом. Ото-
рвавшийся электрон несет отрицательный заряд; присоединяясь к другому атому или молекуле, он образует отрицательный ион. Таким образом, возни-
кает пара ионов. На отрыв одного электрона тратится только часть энергии кванта или заряженной частицы, поэтому на всем пути пробега кванта или частицы возникают пары ионов.
Проходя внутри клетки, они сталкиваются с молекулами и атомами ве- ществ клетки и постепенно растрачивают свою энергию на ионизации и воз- буждения. Это служит причиной постепенного замедления скорости их дви-
жения. Наряду с образованием пар ионов появляются возбужденные атомы или молекулы. Возбужденное состояние связано с перемещением электронов на оболочках атомов. Поглощая энергию, электрон перескакивает с ближней на более далекую оболочку. При обратном переходе электрона с далекой на
64
более близкую электронную оболочку энергия, ранее затраченная на возбуж- дение, теперь излучается в виде фотонов рентгеновых лучей, ультрафиолето-
вого или видимого света.
Таким образом, первичные физические процессы, вызываемые проникно-
вением излучений в клетку, связаны с поглощением энергии веществами клетки, ведущим к ионизации и возбуждению их атомов и молекул.
Различают следующие стадии первичных радиобиологических процессов:
1)физическая (10–16–10–13 с) – возникают возбужденные и ионизированные
молекулы;
2)физико-химическая (10–13–10–10 с) – внутри- и межмолекулярная мигра-
ция энергии, образование ионов и радикалов;
3)химическая (10–6–10–3 с) – взаимодействие ионов и радикалов, структур-
ные повреждения;
4)биохимическая (от долей минуты до нескольких суток) – работа репара-
ционных систем.
На химической стадии первичных радиобиологических реакций образо-
вавшиеся ранее высокоактивные свободные радикалы начинают вступать
вреакции между собой и с интактными молекулами, в результате чего возни- кают разнообразные повреждения молекул. Повреждение биомолекул в ре-
зультате непосредственного поглощения ими энергии излучения происходит при прямом действии радиации, а если же биомолекулы повреждаются в ре-
зультате их химического взаимодействия с продуктами радиолиза воды, то это непрямое действие радиации.
Большинство механизмов повреждающего действия облучения на биомо- лекулы ДНК изучены в модельных экспериментах. Однако существующие ли-
тературные данные позволяют выявить некоторую общую схему событий, происходящих в облученной ДНК.
На первом этапе облучения в ДНК образуется сложный макрорадикал с двумя типами локализации неспаренных электронов, которым соответству-
ют повреждения оснований (потери, вставки и химические модификации) и повреждения сахарофосфатных цепей (одиночные и двойные разрывы фос-
фодиэфирных и межуглеродных связей). Причем нуклеотидные основания повреждаются чаще, чем сахарофосфатная часть ДНК (примерно в три раза) [30, 31]. По данным В. А. Шарпатого [32], 80–90 % свободных электронов и ра- дикалов, образующихся при облучении, реагируют с азотистыми основания- ми – самыми лабильными частями молекулы – и только 10–20 % энергии рас-
ходуется на разложение углеводородного фрагмента ДНК. Наиболее радиоустойчивыми являются углеродные связи, которые в 7,5 раза стабильнее, чем фосфодиэфирные. Из азотистых оснований большей радиочувствительностью обладают пиримидиновые, из которых самый лабильный – тимин. Пуриновые основания в два раза устойчивее пиримидиновых.
Под действием ионизирующей радиации чаще повреждается одна нить ДНК. При этом характер первичных повреждений достаточно разнообразен –
65
это дезаминирование оснований, алкилирование, возникновение оксимов ци-
тозина, димеризация и гидратация пиримидиновых оснований и др. Вторичные реакции – это разрывы водородных связей, конформационные
изменения надмолекулярных структур ДНК, а также внутри- и межмолеку-
лярные сшивки полимерных цепей. Разрушение надмолекулярной структуры (деспирализация) обусловлено в первую очередь двойными разрывами ДНК, которые возникают, если одиночные разрывы нитей ДНК расположены на расстоянии не более 10 пар нуклеотидов друг от друга [31].
Молекула ДНК состоит из двух полинуклеотидных цепей. Если на такую двуцепочечную молекулу подействовать мочевиной, то она вызывает разрыв водородных связей и молекула распадается на одноцепочечные структуры. При облучении таких молекул, диссоциированных с помощью мочевины, было показано, что разрыв одноцепочечной молекулы вызывается действием
10–20 эВ.
Под влиянием облучения происходит не только разрыв полимерной струк-
туры ДНК, но и разнообразные изменения в химической структуре молекулы. Особенно важно то обстоятельство, что эти изменения касаются азотистых оснований, из которых составлен код генетической информации.
При действии радиации мутации возникают лишь при непосредственном воздействии лучей на зародышевые клетки. Для возникновения мутаций, как правило, необходимо поглощение энергии излучений в хромосомах. Сам ра-
диационно-химический процесс, ведущий к индукции мутаций, сложен и протекает в течение некоторого времени. При формировании как генных мута-
ций, так и разрывов хромосом может иметь место предмутационная стадия, на которой может происходить репарация потенциальных повреждений. Од- нако после завершения процесса становления мутаций они переходят в кате-
горию необратимых изменений.
Попадание кванта энергии при облучении клетки – процесс стохастиче- ский, однако конечное повреждение возникает преимущественно в опреде-
ленных участках хромосом, в так называемых горячих точках. Это явление можно объяснить миграцией энергии или заряда вдоль хромосомы к наиболее «ранимым» местам. Существует миграция электронного возбуждения по мо-
лекуле ДНК на большие расстояния – 103–104 пар оснований [33]. Установлено, что если первоначально поражается наиболее радиоустойчи-
вая компонента в смеси фосфат–сахар, то в конечном счете свободная валент-
ность локализуется на сахарной компоненте этой смеси [32]. Далее миграция энергии или заряда идет в направлении наиболее уязвимых азотистых основа-
ний, которые и являются преимущественными местами атаки электронов. С углеводородным фрагментом ДНК электрон практически не взаимодей-
ствует, а лишь стабилизируется и за счет этого принимает участие в реакциях с азотистыми основаниями ДНК [32]. Образующийся под действием γ-облу- чения анион-радикал может возникать случайно в любом из четырех нуклео-
тидов, а затем неспаренный электрон передается на тот нуклеотид, который
66
обладает наибольшим электронным сродством. После этого анион-радикал стабилизируется [34].
Пиримидиновые основания как наиболее чувствительные и являются пер- вичными точками приложения повреждающего действия радиации. Таким об- разом, независимо от места первоначального попадания кванта энергии пер- вичные повреждения начинают формироваться на пиримидиновых нуклеоти-
дах. Необходимо также отметить, что миграция энергии и заряда возможна не только внутри молекулы ДНК, но и с ДНК на протектор. Так, при введении, например, профлавина – лучшего, чем любой нуклеотид, акцептора электро-
нов – конечное радиационное повреждение локализуется на профлавине. Если же ввести гистамин, который является худшим акцептором электронов, чем азотистые основания, то после γ-облучения энергия передается, наоборот, от гистамина к нуклеотидам [34].
Вещества-радиопротекторы могут захватывать на себя и электроны, и энергетический избыток, чем вызывают снижение выхода радикалов ДНК [32]. Предполагается, что такой радиопротектор образует с ДНК комплекс, в кото- ром возможна миграция заряда или возбуждения с ДНК на защитное веще- ство, а рекомбинация этого заряда с зарядом противоположного знака проис-
ходит на фрагменте протектора.
Таким образом, если квант энергии попадает на ДНК, необязательно по-
следует ее повреждение: при наличии в клетке веществ-радиопротекторов возможна миграция энергии или заряда полностью или частично на протек- тор (рис. 2.1). Если такой миграции нет, то первичное радиационное повреж-
дение локализуется на азотистых основаниях ДНК.
Какова дальнейшая судьба этих повреждений? Во-первых, первичные по- вреждения могут быть репарированы; во-вторых, возможно образование точ- ковых мутаций; в-третьих, первичные радиационные повреждения нуклеоти- дов могут дать начало цепи событий, приводящих к формированию хромо-
сомных аберраций (рис. 2.1).
Воснове появления хромосомных перестроек лежит исходный процесс
ввиде разрыва хромосом. Появление под действием радиации как точковых мутаций, так и хромосомных перестроек объясняется поглощением энергии
вкаком-то локусе хромосомы. При точковых мутациях осуществляется хими-
ческое или структурное изменение локуса. В этом случае можно говорить об одном событии, или об одноударном механизме появления мутации. В случае разрыва хромосомы одно событие, т. е. появление в ядре одного разрыва, мо-
жет повести к мутации только в случае появления концевой нехватки. Как правило, клетки с нехваткой какого-либо заметного участка хромосомы поги-
бают. Что касается всех остальных типов хромосомных перестроек, то они не могут возникнуть на основе одного разрыва. В основе появления хромосом-
ной перестройки лежит возникновение в клетке двух и более независимых разрывов. В случае двух разрывов говорят о двухударном механизме появле-
ния мутаций.
67
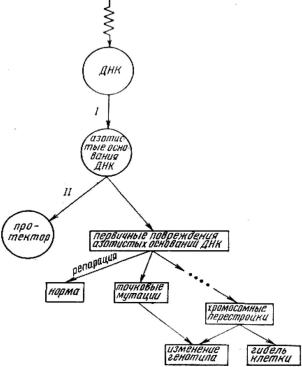
Рис. 2.1. Схема радиогенетических эффектов в клетке эукариот
Для понимания принципов действия радиации при вызывании хромосом- ных перестроек большое значение имеет знание фазы в цикле клеточного де- ления, при которой происходит действие радиации. С этой точки зрения ос-
новными в цикле клеточного деления являются процессы ауторепродукции хромосом. Цикл деления содержит четыре основные фазы. Первой можно на- звать фазу митоза, во время которой два образовавшихся дочерних ядра рас- ходятся по дочерним клеткам. Второй является предсинтетическая интерфа-
за, наступающая вслед за митозом, во время ее протекания еще нет синтеза ДНК, каждая хромосома представлена в виде одной нити. Третья – это синте-
тическая интерфаза, во время которой идет синтез ДНК, он предваряет собой структурную ауторепродукцию хромосом. Четвертой является постсинтети- ческая интерфаза, здесь синтез ДНК уже закончен и осуществляется струк-
турная ауторепродукция хромосом. Каждая хромосома расщепляется на две хроматиды, соединенные между собой общей хромосомной центромерой. Во вновь начинающейся первой стадии, т. е. в митозе, происходит деление цен-
тромеры, каждая из хроматид превращается в самостоятельную хромосому и отходит к своему полюсу деления.
Мутации нерасхождения хромосом ведут к появлению особей с лишними хромосомами или с их недостатком.
68
2.2.Клеточно-тканевый уровень
2.2.1.Особенности возникновения точковых мутаций
Термин «точковая мутация» долгое время понимался разными исследова-
телями по-разному, поэтому следует уточнить, что согласно современным представлениям точковыми мутациями мы называем стабильные изменения на уровне нуклеотидов ДНК. При образовании точковой мутации не наруша-
ется целостность хромосомы и не затрагивается ее белковый компонент. Предположение о различной зависимости выхода точковых и хромосомных
мутаций от эффективности репарационных систем было высказано И. Б. Моссэ в 1974 г. [35] и подтверждено работами разных авторов.
Данные, свидетельствующие о независимости или слабой зависимости формирования точковых мутаций от интенсивности процессов репарации, по-
лучены при исследовании различных факторов.
Радиочувствительность стадий гаметогенеза. Физиологическое состоя-
ние клетки оказывает серьезное влияние на степень поражения ее ядра иони- зирующими излучениями. Детальный анализ, проведенный на дрозофиле, по-
казал, что разные стадии развития зародышевых клеток резко различаются по генетической радиочувствительности. У млекопитающих мужские половые клетки проходят целый ряд стадий развития. Исходные зародышевые клетки носят название А-сперматогонев. Они являются резервом при постоянно иду-
щем сперматогенезе. В ряде делений А-сперматогонии переходят в стадию так называемых активных сперматогониев, или В-сперматогонев. Последние пре-
вращаются в сперматоциты, в которых развертываются важнейшие процессы мейоза, приводящие к кроссинговеру, к редукции хромосом и, наконец, к об-
разованию сперматид, несущих гаплоидное число хромосом. Сперматиды дифференцируются в спермии, образованием которых заканчивается цикл спер-
матогенеза. В этих последовательных преобразованиях зародышевых клеток наиболее радиочувствительны сперматогониев типа В, в которых уже при действии 5 рентген обнаруживаются нарушения. Доза в несколько десятков рентген обусловливает гибель сперматогониев типа В, вызывая этим времен- ную стерильность самцов. Напротив, А-сперматогонии отличаются исключи- тельной устойчивостью, например у дрозофилы они способны переносить об-
лучение в дозе в 10 000 рентген.
В процессах развития происходит смена разных стадий мейоза, каждая из которых характеризуется специфической радиогенетической чувствительностью. При помощи радиационных методов удается установить длитель-
ность в часах как всего сперматогенеза, так и его отдельных частей, вплоть до отдельных фаз мейоза. Это достигается тем, что при малых дозах убиваются сперматогонии типа В и затем, прослеживая последовательность разных ста- дий в таком прерванном и затем вновь начинающемся сперматогенезе, уста- навливают длительность каждой стадии. В табл. 2.1 представлена общая дли-
тельность сперматогенеза и длительность всех стадий мейоза.
69
