
Радиобиология / Моссэ И. Б., Морозик П. М. Генетические эффекты ионизирующей радиации
.pdfПетр Фомич Рокицкий наряду с академиками Н. В. Турбиным и А. Р. Же-
браком принадлежит к числу отцов-основателей Института, сформировавших его научный профиль. Он является создателем и воспитателем научной шко-
лы, известной своими научными достижениями далеко за пределами своей страны.
По решению Совета Министров БССР в память о П. Ф. Рокицком на зда- нии Института генетики и цитологии НАН Беларуси установлена мемориаль- ная доска. На родине в поселке Криничном Мозырского района в 1981 г. от-
крыт музей академика П. Ф. Рокицкого.
Преподаватели и студенты принимали участие в создании музея академи- ка П. Ф. Рокицкого, который сейчас размещается в Криничанской общеобразо- вательной школе Мозырского района. В комнате-музее представлены различ- ные фотодокументы. Есть очень редкие фотографии Н. В. Тимофеева-Ресов- ского, академиков А. Р. Жебрака, С. М. Гершензона, Б. Л. Астаурова, Л. В. Хо- тылевой и др. Имеются личные вещи, много книг и научных статей с дарствен-
ными надписями от ученых из разных уголков бывшего СССР и зарубежья. Многие писали Петру Фомичу и как бессменному члену редколлегии журнала «Генетика». На стеллажах имеется большой выбор библиографически редкой научной литературы по экологии, радиоэкологии, генетике, зоотехнии, биоме-
трии и другим отраслям науки.
Институт генетики и цитологии НАН Беларуси совместно с Мозырским университетом в 1998 г. организовали Научную конференцию, посвященную 95-летию Петра Фомича Рокицкого, а в 2003 г. отметили 100-летие со дня его рождения. На приглашение приехать в Мозырь откликались многие известные ученые стран СНГ. В 2003 г. к 100-летнему юбилею была выпущена книга «Академик П. Ф. Рокицкий», в которой собраны воспоминания его друзей
иколлег, приведен список основных публикаций Петра Фомича, его фотографии.
Кнастоящему времени в честь академика П. Ф. Рокицкого названа одна из улиц пос. Криничного, а Криничанская школа стала называться «Школа имени академика П. Ф. Рокицкого».
Не только ученые, знавшие труды Петра Фомича, и ученики, которых он вырастил, но и земляки и все те, кто знал этого светлого человека, свято чтят его память и отдают дань уважения его сложной, но прекрасной судьбе.

Глава 1
МЕТОДЫ УЧЕТА РАДИАЦИОННЫХ МУТАЦИЙ
Термин «мутация» впервые был предложен Г. де Фризом в 1901 г. Соглас-
но его определению, мутация – это явление скачкообразного прерывистого изменения признаков. До сих пор не предложено другого общепринятого определения мутации. Процесс возникновения мутаций получил название мутагенеза.
Одно из главных свойств мутаций – их наследственность, передача из по-
коления в поколение без изменений, т. е. новые мутантные формы являются устойчивыми. Мутации могут возникать самопроизвольно на протяжении всей жизни организма в нормальных для него условиях окружающей среды (спонтанные) и в результате мутагенных воздействий различных факторов (индуцированные). Мутации могут происходить в разных направлениях (пря-
мые или обратные), могут быть полезными, нейтральными или вредными. Частота мутирования в обоих направлениях индивидуальна для каждого ло- куса. Каждый локус может мутировать, образуя серию множественных алле-
лей. При этом сходные мутации могут возникать многократно.
Мутации появляются постоянно в ходе физиологических процессов, про- исходящих в клетке: репликации ДНК, репарации ДНК, транскрипции и ге-
нетической рекомбинации.
Учет количества возникающих мутаций необходим при исследовании природы гена, его изменения, для понимания механизма влияния внешних условий и физиологического состояния организма на мутационный процесс.
Однако трудность подобного учета заключается в том, что часто не удается отличить мутацию от рекомбинации. В результате процессов расщепления и кроссинговера в потомстве могут появляться новые наследственные признаки, ко- торые легко принять за мутации. Такое же явление возможно при взаимодей-
ствии генов: рекомбинации могут имитировать мутации особенно в тех случаях, когда гены тесно сцеплены и редко разделяются в результате кроссинговера.
По механизму своего возникновения различают три основные категории мутаций. К первой относятся генные мутации, которые возникают при ло-
кальном изменении в химической молекулярной структуре ДНК, входящей в состав хромосом. Второй категорией мутаций являются хромосомные пере-
стройки и третьей – изменение числа хромосом или целых геномов. Основными типами как доминантных, так и рецессивных мутаций явля-
ются видимые мутации, летальные и биохимические. Особи, обладающие видимыми мутациями, проявляют изменения тех или иных признаков. Нали-
31
чие летальных мутаций ведет к гибели особи. Понятно, что доминантные летали сразу же элиминируются, а рецессивные проявляются у гомозигот, передаваясь в гетерозиготном состоянии в неограниченном числе поколений. Биохимические мутации ведут к изменению биохимических свойств клетки и организма.
Мутации, возникающие в клетках тела, называются соматическими. Му- тации, проявляющие свое действие в соматических клетках, изменяют от- дельные клетки тела или ту или иную ткань, развившуюся из исходной мута- ционной клетки. Эти мутации погибают вместе с телом организма и не пере-
даются следующим поколениям.
При появлении мутации в зародышевых клетках мы имеем дело с гамети-
ческими мутациями. Эти мутации через гаметы (спермий или яйцеклетку) переходят к следующим поколениям.
Если точковые мутации классифицируются по типу их влияния на свой- ства организмов, то хромосомные перестройки в первую очередь характери- зуются по типу изменений структуры хромосом. Среди них основными явля-
ются инверсии, нехватки и транслокации.
Методы обнаружения мутаций должны быть разными в зависимости от особенностей объекта, способа размножения организма. При вегетативном
ибесполом размножении многоклеточных организмов мутации учитываются
всоматических тканях, дающих побег, в потомстве одной особи (по клонам). У самооплодотворяющихся растений и животных рецессивные мутации про- являются в следующем же после возникновения мутации поколении. У пере-
крестно оплодотворяющихся организмов возникающие мутации переходят
вгетерозиготное состояние, для выявления их необходимо применять близко-
родственное скрещивание (инбридинг), чтобы увеличить вероятность встречи особей, несущих в себе мутировавший ген.
Объективно регистрировать общее число возникающих мутаций пока практически невозможно. Однако подсчет мутаций в отдельных локусах
иопределенного типа мутаций вполне доступен. Некоторые видимые морфо-
логические изменения можно учитывать довольно точно; несколько более сложным является определение физиологических и биохимических измене-
ний у многоклеточных организмов. Последнее удается лишь при применении стандартных тестов на определенный химический состав или физиологиче-
скую реакцию организма и т. д., т. е. по ответу «да» или «нет».
Легче всего обнаруживаются видимые доминантные мутации, которые могут проявляться в гетерозиготном состоянии в первом же поколении, труд- нее анализировать рецессивные мутации. Для выявления последних требует-
ся специальный генетический анализ в ряду поколений.
Летальные мутации по генетической природе являются смешанным ти- пом мутаций, к которым относятся как различного рода хромосомные пере-
стройки, так и изменения отдельных генов.
Для выявления мутаций разных типов применяют гибридологические, цитологические, биохимические, молекулярные методы.
32
1.1. Гибридологические методы учета частоты рецессивных летальных мутаций
Для того чтобы учитывать мутации, особенно рецессивные, возникшие как единичные изменения в хромосомах половых клеток, их необходимо пере- водить в гомозиготное состояние. Для дальнейшего анализа мутантную ли- нию скрещивают с линией-анализатором, имеющей одну или несколько мар-
кированных групп сцепления. Такой подход позволяет не только подтвердить ее наследование, но и сберечь время на анализ принадлежности мутации к со-
ответствующей группе сцепления.
Для хорошо изученных в генетическом отношении объектов (дрозофила, кукуруза, ряд микроорганизмов) с установленными группами сцепления изу-
чение новой мутации проводить довольно легко, действуя указанным путем. Для этих же объектов разработаны специальные методики учета частоты му-
таций, возникающих в отдельных хромосомах. По данной схеме скрещивания можно обнаружить отдельные видимые рецессивные сцепленные с полом мутации, возникшие в Х-хромосоме половых клеток отцовского организма и проявляющиеся у мужского пола в F1. Наиболее объективно можно учиты-
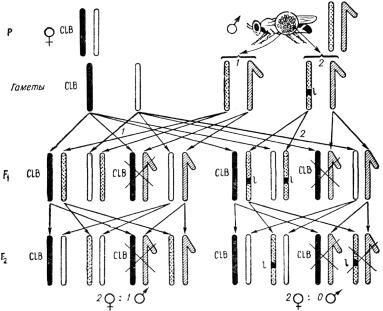
вать рецессивные летальные мутации, приводящие в гомозиготном состоянии к смерти несущих их особей. Для учета таких мутаций в половой хромосоме дрозофилы Г. Мёллером была разработана методика СlВ, схема которой при-
ведена на рис. 1.1.
Рис. 1.1. Метод обнаружения рецессивных сцепленных с полом летальных мутаций у Drosophi la (метод ClB): 1 – результаты скрещивания в случае отсутствия летальной мутации в Х-хромосоме спермы самца; 2 – результаты скрещивания в случае наличия летальной мута-
ции в Х-хромосоме спермы самца; С – инверсия, l – летальность, В – полосковидные глаза [1]
33
Генетическая структура линии СlВ характеризуется тем, что одна из Х-хромосом самки маркирована доминантным геном Ваr (полосковидные глаза). В этой же хромосоме имеется инверсия, обозначаемая буквой С. Эта инверсия препятствует кроссинговеру и обладает рецессивным летальным эффектом 1, т. е. зиготы, несущие две такие Х-хромосомы, погибают. Этими тремя начальными буквами (ClB) и обозначена линия-анализатор на леталь-
ные мутации в половых хромосомах дрозофилы.
В случае если в одном из спермиев анализируемого самца в Х-хромосоме возникает летальная мутация, то при оплодотворении таким спермием яйце-
клетки с Х-СlВ-хромосомой развивается гетерозиготная по данной летали самка. В F1, как это видно на рис. 1.1, будут встречаться самки двух типов:
с нормальными (круглыми) и с полосковидными глазами (Ваr). Каждая из этих самок несет по одной Х-хромосоме отца. Самцы, несущие хромосому ClB, не развиваются, так как у них леталь находится в гемизиготном состоя- нии. Поэтому самцы в F1 встречаются только с нормальными глазами. Для дальнейшего анализа самок F1 с геном Ваr скрещивают индивидуально с нор-
мальными самцами (каждая пара в отдельной пробирке).
Если самка F1 получила Х-хромосому анализируемого самца с летальной мутацией и, следовательно, стала гетерозиготной по ней, то в потомстве F2
такой самки не появится самцов, так как все они погибнут.
Очевидно, что число исследованных на обнаружение летальных мутаций самок СlВ из F1-дочерей одного исходного анализируемого самца будет соот-
ветствовать числу исследованных Х-хромосом в его сперматозоидах.
Хотя эта методика и очень удобна для количественного учета возникающих летальных мутаций, но у самок F1 между половыми хромосомами
иногда может происходить двойной перекрест, что приводит к снижению истинной частоты летальных мутаций.
В настоящее время для анализа частоты возникновения летальных мута- ций в Х-хромосоме самцов применяется другая методика, названная Мел-
лер-5, или М-5 (рис. 1.2).
В этой методике применяется линия-анализатор, преимущество которой заключается в том, что обе Х-хромосомы самки содержат по две инверсии, не связанные с летальным действием. В силу наличия двух инверсий перекрест между хромосомами более затруднен. Кроме того, обе хромосомы самки мар- кированы тремя генами: sc8, В, w a. Самцы в этой линии жизнеспособны. При анализе самца дикого типа методом М-5 мы получаем в F2 по два фенотипиче- ских класса самок и самцов. Если же в анализируемой Х-хромосоме исследуе- мого самца возникла летальная мутация, то в F2 будут самцы одного феноти- пического класса: sc8, В, w a, а самцы дикого типа не появятся. При этом каж- дая индивидуальная культура F2 являющаяся потомством лишь одной самки F1 соответствует одной исследованной Х-хромосоме самца Р.
Для учета летальных мутаций в аутосомах дрозофилы существует другая методика, представленная на рис. 1.3. В этом случае учет возникающих рецес- сивных летальных мутаций производится в F3.
34

Рис. 1.2. Метод обнаружения рецессивных сцепленных с полом летальных мутаций у Drosophi la (метод М-5): 1 – результаты скрещивания в случае отсутствия летальной мутации в Х-хромосоме спермы самца; 2 – результаты скрещивания в случае наличия летальной мута-
ции в Х-хромосоме спермы самца; В – полосковидные глаза, w а – абрикосового цвета глаза [1]
Рис. 1.3. Метод обнаружения летальных мутаций в аутосомах Drosophila (метод сбалансиро- ванных леталей CyL/Pm): 1 – результаты скрещивания в случае отсутствия леталей в хромосоме II спермы самца; 2 – результаты скрещивания в случае наличия летальной мутации в Х-хромосоме спермы самца; Су+ – нормальные крылья, Су (Curly) – загнутые крылья, лета- лен в гомозиготном состоянии; L+ – нормальные глаза, L (Lobe) – лопастные глаза, летален
в гомозиготном состоянии; Рm+ – красные глаза, Pm (Plum) – коричневые глаза [1]
35
Для проявления летальной рецессивной мутации в аутосоме необходимо, чтобы мутация оказалась в обеих испытываемых хромосомах, т. е. в гомози- готном состоянии. Обычно для этой цели у дрозофилы используют специаль- ную линию, позволяющую учитывать летальные мутации во второй паре ау-
тосом. В этой линии мух одна из хромосом содержит две большие инверсии – по одной в каждом плече, доминантные гены Су (Curly – загнутые крылья) и L (Lobe – маленькие глаза), каждый из которых в гомозиготном состоянии вызывает летальный эффект; гомологичная хромосома, также содержащая инверсию, маркирована геном Pm (Plum – коричневатые глаза). Этот метод обнаружения мутаций иногда называют методом CyL/Pm.
Испытываемого самца скрещивают с самкой из линии CyL/Pm. В F1 все мухи CyL являются гетерозиготными по той или другой гомологичной хро- мосоме II анализируемого самца. Из F1 выбирают самцов CyL, поскольку у них кроссинговер подавлен. Каждого такого самца, несущего по одной анализиру- емой хромосоме, индивидуально скрещивают с самкой исходной линии CyL/Pm. В F2 половина мух (самцов и самок) в каждой культуре оказывается гетерози-
готной по одной и той же анализируемой хромосоме. Фенотипически у этих мух проявляются только гены Су и L. Таких самок и самцов скрещивают меж- ду собой. В случае отсутствия летальной мутации в анализируемой хромосо- ме происходит расщепление в отношении 2CyL: 1Cy+L+. Данное отношение возникает в силу того, что гомозиготные мухи CyL не выживают. Если в ана- лизируемой хромосоме имеется леталь, то в культуре F3 будут мухи одного фенотипа – CyL, а нормальные по фенотипу будут погибать в силу гомозигот- ного состояния рецессивной летальной мутации. Таким методом можно учиты-
вать частоту рецессивных летальных мутаций во второй хромосоме дрозофилы. Аналогичные схемы скрещиваний разработаны и для третьей аутосомы
дрозофилы.
В итоге рассмотрения мутационного процесса мы приходим к следующим выводам:
1)точковые мутации являются скачкообразными изменениями отдельных нуклеотидов или локусов хромосом;
2)мутантные гены сохраняют свойство репродукции при делении ядра клетки, вследствие чего мутационные изменения наследуются;
3)мутации могут быть прямыми и обратными;
4)частота мутирования в обоих направлениях характерна для каждого локуса;
5)спонтанный мутационный процесс обусловливается свойством самого гена, системой генотипа, физиологическим состоянием организма и колебани-
ем факторов внешней среды;
6)каждый локус – ген может мутировать в несколько состояний, образуя серию множественных аллелей;
7)мутации у различных видов организмов образуют гомологические ряды наследственных изменений.
36
1.2. Цитологические методы
Хромосомные перестройки известны у животных, растений и у микроор-
ганизмов. Они возникают как спонтанно, так и индуцированно. Открытие хромосомных перестроек дало в руки исследователей новый метод анализа генотипа, изучения локализации генов в хромосоме и кариотипа, а также ме- тод оценки мутагенного эффекта различных факторов и особенно ионизиру- ющей радиации, так как ионизирующие излучения – это мощный фактор по-
лучения различных хромосомных перестроек.
Хромосомные перестройки могут быть внутрихромосомными и межхро-
мосомными.
Квнутрихромосомным перестройкам относятся изменения, происходя-
щие внутри одной хромосомы: выпадение или удвоение участка, изменение порядка расположения генов в хромосоме; к межхромосомным – обмен участками между негомологичными хромосомами, вызывающий изменение рас-
пределения генов по группам сцепления – это так называемые транслокации.
1.2.1.Внутрихромосомные изменения
Квнутрихромосомным изменениям относят:
1)нехватки, потери части хромосомы (дефишенси и делеции);
2)удвоение, или, точнее, умножение тех или иных участков хромосомы (дупликации);
3)изменение линейного расположения генов в хромосоме вследствие «пе-
ревертывания» на 180° отдельных участков хромосомы (инверсия);
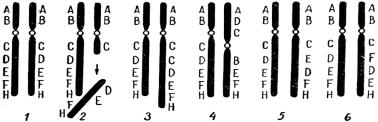
4)перестановки генов (инсерции) (рис. 1.4).
Хромосомные перестройки у диплоидных организмов могут быть в гомо-
зиготном и в гетерозиготном состояниях.
Внутрихромосомные перестройки, связанные с разломами внутри одного плеча хромосомы, называют парацентрическими. Перестройки хромосом, возникающие вследствие разломов по обе стороны центромеры, называют пе- рицентрическими. Сразу же следует отметить, что хромосомы с перестройка-
ми могут сохраняться в ряду клеточных делений лишь при наличии в них
Рис. 1.4. Типы внутрихромосомных перестроек: 1 – исходная пара гомологичных хромосом; 2 – потеря участка DEFH; 3 – дупликация участка С; 4 – перицентрическая инверсия участка BCD; 5 – парацентрическая инверсия участка DE; 6 – инсерция – перестановка участка DE [1]
37

центромер. Участки хромосомы, лишенные центромеры, называются фрагментами; они утрачиваются в ходе митоза.
В кариотипе всех организмов имеется одна пара хромосом, которая несет так называемый ядрышковый организатор, он участвует в формировании ядрыш- ка, которое исчезает во время митоза. Ядрышковый организатор строго лока-
лизован в хромосоме. Хромосомные перестройки по отношению к ядрышковому организатору могут быть двух видов: исключающие ядрышковый организатор – парануклеолярные перестройки, и захватывающие его – пе-
ринуклеолярные перестройки.
Каждый из типов хромосомных изменений играет важную роль в цитоге-
нетическом анализе наследственности и изменчивости.
Дефишенси и делеции. Хромосомы могут утрачивать большие и малень- кие участки, несущие наследственную информацию. В метацентрической хро-
мосоме нехватки могут возникать за счет разрывов хромосомы в различных ее точках. Соответственно числу разрывов и их месту в хромосоме образуются разные типы нехваток.
Если разрыв происходит в одном из плеч хромосомы таким образом, что один из ее концов утрачивается (рис. 1.5, 1), то данное плечо укорачивается. Оторвавшийся фрагмент вместе с содержащимися в нем генами теряется при ближайшем делении ядра, поскольку он лишен центромеры. Такие нехватки называют терминальными (или концевыми), а также дефишенси.
Разрывы иногда происходят одновременно в двух плечах хромосомы, вследствие чего элиминируются оба ее конца (рис. 1.5, 2), при этом открытые кон-
цы могут соединиться, образуя в митозе кольцеобразную хромосому. Нехватки возникают также в результате двух одновременных разрывов,
но не по краям, а в середине хромосомы (рис. 1.5, 3). Места разрывов соединя- ются, и хромосома становится короче, при этом внутренний участок элими- нируется. Если выпавший фрагмент достаточно велик, то открытые его кон-
Рис. 1.5. Типы нехваток хромосом: 1 – концевая нехватка; 2 – две концевые нехватки, приво-
дящие к образованию кольца; 3 – внутрихромосомная нехватка [1]
38
цы могут соединиться, и в метафазе образуется ацентрическое кольцо, кото-
рое при делении ядра не ориентируется в плоскости экватора и в последующем элиминируется. Потери внутренних участков хромосом называют де-
лециями.
Нехватки могут быть большими и малыми. К последним относят такие, которые связаны с выпадением нескольких хромомер или только части хромо- меры – это микроделеции. Микроделеции можно обнаружить только при ис-
следовании гигантских хромосом.
Мелкие нехватки обычно сохраняются в гомозиготном состоянии, давая иногда фенотипический эффект и имитируя генную мутацию. Единственный показатель, по которому их отличают от истинной мутации гена, – это отсут- ствие эффекта обратного мутирования. Большие нехватки, как правило, в го- мозиготном состоянии летальны, так как нарушают генный баланс. Жизне- способными могут быть только гетерозиготы по нехваткам. В этом случае не- хватки проявляются как доминантные гены. Целый ряд доминантных мута-
ций у дрозофилы, ранее принимавшихся за генные, оказались нехватками
(Blond, Pale, Beaded, Cuvked, Plexate).
Фенотипический эффект нехватки участка хромосомы объясняют тем, что она нарушает генетическую систему хромосомы, последовательность распо- ложения генов, их взаимосвязь. Поскольку хромосомы с нехваткой при це- лостности центромеры сохраняют свойство репродуцировать себя в изменен-
ном виде и правильно распределяться при делении клеток, то изменение
впризнаке, вызванное нехваткой, наследуется. Установлено, что если делеции и дефишенси затрагивают генетически активные районы, они почти всегда вызывают фенотипический эффект.
Следует отметить, что нехватки часто сопровождаются плейотропным фе- нотипическим эффектом. Они вызывают понижение общей жизнеспособ-
ности и плодовитости особей.
Крупную нехватку, затрагивающую несколько дисков, можно обнаружить генетическими и цитологическими методами. Так, например, существует ли- ния дрозофилы, где самки в одной из Х-хромосом несут нехватку части хро-
мосомы, затрагивающую локусы вблизи гена white. Эта нехватка, названная
всвое время мутацией Notch, в гетерозиготном состоянии обусловливает раз-
витие вырезки на крыльях, т. е. мутация является доминантной.
Вгомозиготном состоянии она обусловливает гибель организма, т. е. об-
ладает рецессивным летальным действием.
Если скрестить самку дикого типа, имеющую нормальные половые хро-
мосомы, с самцом, несущим в единственной Х-хромосоме три рецессивных гена в гемизиготном состоянии: у – определяющий желтый цвет тела, W – бе-
лые глаза и f – вильчатые щетинки, то все особи первого поколения будут по фенотипу нормальными.
При скрещивании же самки из линии Notch, несущей в гетерозиготе не- хватку локуса W, с самцом ywf в Fx половина самок будет дикого типа, другая
39
