
Радиобиология / Моссэ И. Б., Морозик П. М. Генетические эффекты ионизирующей радиации
.pdfпревосходящей исходную, что позволило сделать вывод об адаптации этой популяции клеток за счет амплификации генов, ответственных за проявление резистентности к адриамицину [231].
В линиях клеток китайского хомячка, отобранных с помощью многосту- пенчатой селекции по резистентности к винкристину, обнаружена амплифи- кация соответствующего гена, которая сопровождалась как увеличением син-
теза белка 19, так и повышением количества полисом мРНК 9. В результате этих изменений клетки оказались устойчивее в 500–4000 раз по сравнению с исходными [232].
Показано, что 4–8-кратная амплификация гена обеспечивает 20-кратную сверхэкспозицию мРНК гомологичного гена [233]. Сверхрепликация ДНК на-
блюдалась и при возникновении резистентности клеток китайского хомячка
кгипоксии [234]. При этом содержание ДНК превышало 4 С. Обнаружено, что клетки с высокой амплификацией гена происходили из популяции клеток, претерпевших сверхрепликацию ДНК [234]. На клетках джунгарского хомяч-
ка, обладающих высокой устойчивостью, показано, что амплифицированная ДНК, как и митохондриальная, реплицируется асинхронно [235]. При этом об-
наружено, что количество копий повторяющихся последовательностей ДНК коррелирует с уровнем резистентности клеток и размер амплифицированного сегмента составляет 200–250 тыс. оснований.
Впоследние годы появляется все больше данных о вкладе в быструю адаптацию популяций к неблагоприятным внешним факторам мобильных ге- нетических элементов (МГЭ), называемых также транспозонами. МГЭ пред-
ставляют собой дискретные сегменты ДНК, которые могут перемещаться из одного местоположения в другое в пределах одного генома или между разны-
ми геномами. МГЭ распространены повсеместно и составляют существенную часть генома многих изученных организмов. В основе влияния мобильных элементов на структуру генетического материала находится их способность
кперемещению и увеличению числа копий в геноме. При этом транспозиции некоторых MГЭ могут отличаться высокой специфичностью.
Приближение определенных МГЭ к некоторым генам про- и эукариот по- вышает активность этих генов в десятки раз [236]. Предполагают, что индук- ция мобильных генетических элементов является одним из механизмов об-
щей реакции клетки на действие неблагоприятных факторов. В определенных условиях, например, под действием неблагоприятных (мутагенных) внешних факторов, к которым также относится ионизирующая радиация, скорость транспозиций мобильных элементов может увеличиваться на несколько порядков.
Внастоящее время накоплен большой фактический материал, показывающий, что ионизирующее излучение и многие другие неблагоприятные фак-
торы вызывают повышение транспозиционной активности МГЭ и увеличение количества их копий в геноме разных организмов.
Транспозоны формально относятся к так называемой некодирующей части генома – той, которая в последовательности пар оснований ДНК не несет
120
информацию об аминокислотных последовательностях белков. У разных видов транспозоны распространены в разной степени: так, у человека транс-
позоны составляют до 45 % всей последовательности ДНК, у плодовой мухи Drosophila melanogaster – лишь 15–20 % всего генома. У растений транспозо-
ны могут занимать основную часть генома – так, у кукурузы по крайней мере 85 % генома составляют различные мобильные элементы.
Многие МГЭ содержат различные знаки пунктуации и управления считы-
ванием (в частности, промоторы и терминаторы транскрипции). В структуре МГЭ обнаружены также энхансероподобные сайты. Активность всех этих знаков способна изменять (активировать или подавлять) функции соседних генов, причем влияние энхансеров может распространяться на расстояния по-
рядка тысяч нуклеотидов. Таким образом, инсерция МГЭ в отдаленный сайт способна существенно повысить активность соответствующих генов.
Способы перемещения и механизмы функционирования МГЭ в различ- ных генетических процессах прежде всего определяются их структурой и на- бором синтезируемых ферментов. Несмотря на существующие различия, про-
цесс перемещения всех классов мобильных генетических элементов проходит через ряд ключевых событий, которые происходят в донорском сайте, сайтемишени, а также на промежуточной стадии.
Отсюда понятно, что перемещения МГЭ могут вызвать быструю адапта- цию организмов к меняющимся условиям внешней среды [237–239]. Разрабо-
тана математическая модель для системы «внешняя среда – ген – МГЭ» [237, 240]. В результате компьютерного анализа модели показано, что могут суще- ствовать режимы резких изменений внешней среды, когда механизмы мутаге-
неза не способны обеспечить выживание популяции. Возможность адаптации популяций в таких условиях могут обеспечить мобильные генетические эле- менты, причем с большой долей вероятности МГЭ функционируют коррели-
рованно с условиями внешней среды.
Например, было показано, что чувствительность экспериментальных по- пуляций дрозофилы к мутагенному действию облучения ступенчато снижа- ется при ступенчатом повышении уровня облучения (0, 2, 4 и 8 кР на поколе-
ние) [241]. Выявлено, что адаптация популяций обусловлена возникновением отдельных генетических элементов, которые, по мнению автора, являются транспозонами. При каждом новом повышении уровня облучения ступенчато включаются дополнительные генетические «элементы». Так, при облучении популяций в дозе 2 кР возникло два полудоминантных фактора в и хромосомах. При увеличении дозы облучения до 4 кР появился третий (рецессив-
ный) фактор в хромосоме, а при повышении уровня облучения до 8 кР возник четвертый элемент, тоже рецессивный, в I хромосоме. После прекращения облучения один из факторов устойчивости исчез из популяции. Такие явле-
ния могут быть объяснены только транспозициями МГЭ.
Были описаны аналогичные «элементы», обладающие селективным преимуществом и возникающие в разных хромосомах дрозофилы при облучении
121
популяций [242]. При интенсивном давлении отбора в популяциях могут про-
исходить резкие перестройки за счет появления «элементов», имеющих преимущество в гетерозиготах. В работах [243–245] обнаружено, что при ступен- чатой температурной обработке особей дрозофилы в чувствительные перио- ды онтогенеза рисунки перемещения и локализации МГЭ оказываются анало-
гичными в разных повторностях опыта.
Очевидно, не только ионизирующая радиация, но и любые экстремальные воздействия, в том числе и температурные, способны стимулировать транс-
позиции МГЭ в генеративных клетках. Перемещения мобильных элементов наследуются, поэтому наследуется и вызываемая ими активация генов, повы-
шающих приспособленность особей.
Особый интерес представляет неслучайность спектров перемещений МГЭ, адекватных внешним воздействиям. Формирование нового генотипа может быть адекватным ответом на стрессовое влияние окружающей среды, которое вызывает активацию мобильных элементов генома, вырабатывающих обрат- ную транскриптазу, а также может нарушать автономность созревания синте- зируемой РНК. Обратная транскрипция незаконно сплайсированных РНК мо- жет формировать копии ДНК, которые способны встраиваться в геном, обу-
словливая возникновение новых функций [246].
Характерным свойством многих транспозонов является наличие необыч-
ных последовательностей на концах терминальных повторов, что, очевидно, обеспечивает их избирательное встраивание в предпочтительные сайты ин-
серции.
Один из наиболее ярких примеров направленной реакции популяций на изменения условий внешней среды – появление генотрофов у растений, выра- щенных при различном содержании азота, калия и фосфора в среде [247]. Воз-
никающие при этом фенотипические различия сохраняются у потомков при содержании их в одинаковых условиях. Оказывается, что причиной таких фе- нотипических различий является амплификация генов, необратимо изменяю-
щих геном.
Другими примерами направленных генетических изменений являются синтез специфических антител в лимфоцитах В и индуцируемое недостатком восстановленного азота появление у синезеленой водоросли способности к фиксации азота атмосферы, что также сопровождается изменениями генома [247].
Очевидно, существует связь между МГЭ и амплификацией генов. По-
скольку МГЭ могут кодировать ревертазу, усиление их транскрипции будет стимулировать амплификацию клеточных генов, что и приведет к изменению дозы генов или к инсерционному мутагенезу [248]. Таким образом, мобиль-
ные элементы могут выполнять функцию рецепторов, обеспечивающих связь между изменением параметров внешней среды и величиной изменчивости, и тем самым приводить к быстрой адаптации популяций в экстремальных ус-
ловиях.
122
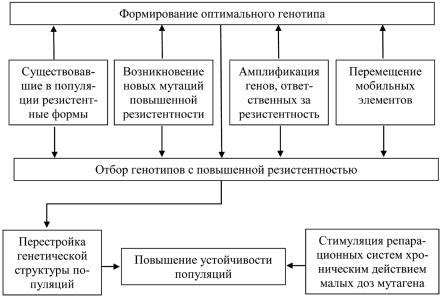
Рис. 2.14. Система механизмов, обеспечивающих повышенную резистентность популяций к повреждающим факторам
Описанные механизмы адаптации популяций могут приводить к пере- стройке генетической структуры популяций. Однако повышенная устойчи-
вость популяций к действию мутагенных факторов может быть следствием стимуляции или активации систем репарации хроническим воздействием ма-
лых доз мутагена [213].
Система механизмов, повышающих устойчивость популяций к поврежда-
ющим факторам, представлена на рис. 2.14, из которой видно, что в каждом конкретном случае резистентность может обеспечиваться каким-то одним или несколькими путями. Стимуляция репарационных систем малыми дозами мутагена и перестройка генетической структуры популяции – это два принципиально разных механизма повышения резистентности популяций, один из них приводит к физиологической адаптации популяций, а другой – к генетической.
Если резистентность популяции обусловлена стимуляцией систем репара-
ции под действием мутагена, то после прекращения мутагенных воздействий чувствительность популяции должна вернуться к норме.
2.4.4. Динамика численности особей в облучаемых популяциях
Колебания численности популяций животных изучены многими автора- ми. Известно, что с увеличением плотности популяций число взрослых по- томков падает. При содержании культур дрозофилы в бутылочках с искус-
123
ственной средой после достижения популяцией наибольшего размера ее чис-
ленность резко падает, вплоть до гибели культур.
Регулярные колебания численности особей в популяции не связаны с ка- ким-либо изменением внешней среды, а обусловлены внутрипопуляционны- ми процессами. Причем пары особей, взятые из популяции в период депрес- сии, имеют большую плодовитость по сравнению с особями, изолированны-
ми в период пика численности.
Вэкологии популяций хорошо известны «популяционные волны» – рез-
кие колебания численности, захватывающие разное количество поколений. Численность особей в популяциях при этом может изменяться на 5 порядков. Например, при изучении 38 природных популяций, обитавших в Бразилии, обнаружены 12-недельные циклы колебаний численности [249]. Каждый цикл имеет четыре четкие фазы: сокращение, подъем, вспышку и снижение. В фазе вспышки число особей в популяции в 10 раз больше, чем в фазе сокращения. Динамика численности в облученных популяциях имеет такой же характер.
Впопуляциях существует обратная связь между численностью особей,
содной стороны, и их жизнеспособностью и плодовитостью – с другой. При высокой плотности популяций плодовитость и жизнеспособность особей сни-
жаются, а при низкой увеличиваются. За счет этого и происходит регуляция численности популяций.
Известно, что при чрезмерном увеличении общей численности особей в популяции снижается плодовитость, что приводит к снижению численности по-
пуляции в следующем поколении. Плодовитость особей во всех популяциях подвержена существенным колебаниям, также не связанным с эксперимен-
тальными воздействиями. Вспышки численности сопровождаются снижением плодовитости, и наоборот. Известно, что колебания жизнеспособности особей в популяциях зависят от изменений численности. При личиночном перенасе-
лении наиболее очевидное следствие, которое в порядке обратной связи будет ограничивать численность популяции – смертность на предимагинальных стадиях развития. Во многих опытах при увеличении числа личинок насеко- мых в популяциях наблюдалось уменьшение размера куколок и имаго, удли- нение времени развития (в основном на личиночной стадии), увеличение раз-
броса вылупления мух и, наконец, повышение смертности особей на разных стадиях развития.
При этом влияние перенаселения на плодовитость не связано с блокирова- нием яйцекладки. При высокой плотности населения яичники самок функци-
онируют, однако интенсивность оогенеза снижается, уменьшается количество зрелых яиц и овариол. Кроме того, в откладке яиц может принимать участие меньшее количество самок.
Известно, что в перенаселенной популяции возрастание доли неоплодот- воренных самок может быть следствием как стерильности самцов, так и ре- цептивности самок. Кроме того, с увеличением плотности популяций возрас- тает интенсивность соревнований самцов за спаривание и увеличивается раз-
ница между успешными и неуспешными самцами.
124
Причинами осцилляции считают как внутрипопуляционные процессы, так и влияние внешних по отношению к популяции факторов, например, воз-
действие комплекса экологических факторов, включая и космические.
В научной литературе есть сведения о плодовитости популяций с «радиа- ционной историей». Так, была подробно изучена генетическая структура по- пуляции дрозофилы, подвергавшейся длительному воздействию рентгенов- ским излучением [215]. Показано, что вначале облучение вызывало уменьше-
ние фертильности популяции, но затем произошла адаптация популяций
квоздействию радиации. Эта адаптация обусловлена повышенной скоростью яйцекладки: особи из популяции, подвергавшейся длительному облучению на протяжении 220 поколений, вследствие высокой плодовитости давали больше потомков, чем контрольные.
Аналогичные данные получены нами при мониторинге популяций дрозо- филы, облучавшихся на протяжении 100 поколений. Так, в начале анализа плодо-
витость особей в облученных популяциях была ниже, чем в контрольных. Это вполне согласуется с общеизвестным положением о том, что воздействие ионизирующей радиацией снижает плодовитость животных. Однако в даль-
нейшем этот показатель начинал возрастать. В одной из облучавшихся популяций плодовитость особей достигла контрольного уровня к 25-му поколе-
нию, в другой популяции плодовитость особей достигла уровня контроля уже
к15-му поколению [250].
Увеличение средней плодовитости особей в облученных популяциях по сравнению с не облученными может свидетельствовать о наступлении рези-
стентности этих популяций к воздействию облучения.
Ранее мы уже рассматривали аналогичную динамику мутационного про- цесса в облучаемых популяциях – вслед за резким повышением частот мута- ций наступает их постепенное снижение. Снижение уровней мутаций в усло-
виях продолжающегося облучения может свидетельствовать о наступлении генетической адаптации облучаемых популяций к мутагенному действию ио-
низирующей радиации.
Известно, что при увеличении численности особей в популяциях частота мутаций в них растет, так как происходит размножение особей, несущих му-
тации. При снижении численности уровень мутаций падает, так как в первую очередь элиминируются мутантные особи. Облучение популяций повышает частоты мутаций в обоих случаях. Поэтому, когда популяция на подъеме, влияние изменения численности на частоту мутаций действует в одном на- правлении с эффектом облучения, и их эффекты суммируются. Когда же по- пуляция на спаде, снижение численности и облучение действуют в разных на-
правлениях, при этом эффект облучения нивелируется.
Эти процессы необходимо учитывать в радиобиологических эксперимен- тах с природными популяциями, когда для анализа берутся выборки из попу- ляций, подвергающихся облучению, и сравниваются с выборками из кон-
трольных популяций. Не зная, на какой фазе изменения численности находится
125

данная популяция, можно получить абсолютно противоречивые результаты. Для получения корректных данных, необходимо исследовать популяции в ди- намике, чтобы проанализировать все фазы изменения численности, суще-
ственно влияющие на уровень мутационного груза в популяции.
2.5.Видовой уровень
2.5.1.Сравнительная радиочувствительность разных видов
Существуют отличия в чувствительности организмов различных видов к действию радиации. Так, летальная доза для млекопитающих составляет от 1 до 10 Гр, а для других позвоночных десятки и сотни грей. Значительные вариации радиочувствительности были обнаружены не только между таксо- нами, но и внутри каждой филогенетической группы (рис. 2.15). Наблюдае-
мые различия в устойчивости организмов к действию радиации невозможно объяснить какими-либо физическими особенностями поглощения энергии излучения их тканями – она примерно одинакова для всех тканей и организ-
мов. Различия обусловлены биологическими особенностями объектов, их структурной и функциональной организацией, адаптивными и регенерацион-
ными возможностями, специфичностью репарации первичных радиационных повреждений, интенсивностью метаболических и пролиферативных процес-
сов и др.
Наиболее распространенным показателем радиочувствительности, приме- нимым к организмам различного уровня сложности, служит степень выжива-
емости (или другой показатель, однозначно связанный с выживаемостью). Чаще всего для этой цели используют летальную дозу, вызывающую гибель 50 или 100 % особей в облученной популяции, так называемую дозу LD50 или LD100 соответственно. При определении радиочувствительности большинства млекопитающих ограничиваются определением выживаемости животных к 30-му дню после облучения. Этот срок выбран в связи с тем, что острый период луче-
вой болезни у млекопитающих обычно заканчивается в первый месяц после радиационного воздействия. Для дру- гих объектов временной интервал вы- бирают в соответствии со средней про-
должительностью жизни облученных
Рис. 2.15. Сравнение радиочувствительно- |
организмов. |
|
сти (LD100) организмов, принадлежащих |
В табл. 2.4 |
приведены данные по |
к различным филогенетическим группам: |
определению величины LD50 у предста- |
|
1 – одноклеточные организмы; 2 – беспоз- |
||
воночные; 3 – позвоночные; 4 – млекопита- |
вителей различных филогенетических |
|
ющие; 5 – человек |
групп. Видно, |
что диапазон устойчи- |
126

вости к радиации в живой природе необычайно широк. Наиболее устойчивы к действию ионизирующих излучений микроорганизмы – дозы, способные вызвать их гибель, составляют сотни и тысячи грей. Для беспозвоночных жи-
вотных диапазон летальных доз обычно на порядок ниже; для позвоночных они составляют десятки грей, а наиболее радиочувствительными являются млекопитающие. Таким образом, можно заключить, что по мере усложнения организации объектов их устойчивость к радиации резко снижается.
Таблица 2.4. Ориентировочные значения LD50 при облучении некоторых биологических объектов (общее однократное облучение рентгеновскими или гамма-лучами)
Объект |
LD50, Гр |
Объект |
LD50, Гр |
Вирусы |
|
Членистоногие |
|
полиомы |
7000 |
Artemia salina |
200–900 |
табачной мозаики |
4500 |
Daphnia magna |
50 |
Бактерии |
|
Асцидии |
|
Micrococcus radiodurans |
7500 |
Heterodera |
30 |
В. mesentericus |
1500 |
Нематоды |
|
Micrococcus sodensis |
300 |
Molgula |
50 |
E. coli |
50–100 |
Насекомые |
|
Водоросли |
|
Drosophila (imago) |
950 |
Chroococcus |
1000 |
Drosophila (куколка) |
20–65 |
Chlorella |
180 |
Drosophila (яйца 7-часовые) |
8 |
Высшие растения |
10–1500 |
Drosophila (яйца 4-часовые) |
5 |
Беспозвоночные |
|
Drosophila (яйца 3-часовые) |
2 |
Простейшие амебы |
|
Chaoborus (личинка) |
100–250 |
Diflugia |
2000 |
Tribolium confusum (imago) |
200 |
Amoeba proteus |
1000 |
Calandria granria (imago) |
50 |
Инфузории |
|
Позвоночные |
|
Ophryoglena mucifera |
7000 |
Змеи |
80–200 |
Ophryoglena atra |
5500 |
Черепахи |
15–20 |
Ophryoglena pectans |
4000 |
Тритоны |
25–30 |
Paramecium caudatum |
3000 |
Лягушки |
5–10 |
Кишечнополостные |
|
Голуби |
25–30 |
Anetnonia sulcata |
2500 |
Куры |
10–15 |
Hydra fusca |
50 |
Рыбы (карповые) |
5–20 |
Моллюски |
|
|
|
Thais |
200 |
|
|
Radix japonica |
120 |
|
|
С генетически детерминированными различиями в радиочувствительно-
сти мы сталкиваемся не только при сопоставлении различных таксонов, но и при изучении родственных видов. Так, Micrococcus radiodurans может быть отнесен к «рекордсменам» радиоустойчивости – его обнаружили в воде, окру-
жающей атомный реактор, где облучение достигает величин 104–105 Гр. В этих условиях бактерии сохраняют способность к размножению. В то же время родственная форма – Micrococcus sodensis – примерно в 25 раз менее устойчи-
127
ва к радиационному воздействию, а для многих штаммов Е. coli величина дозы LD50 составляет около 50 Гр.
Растительные объекты также характеризуются значительными различия-
ми в устойчивости к радиационному воздействию. Необыкновенно высокая чувствительность к ионизирующему излучению отмечена у гриба Phycomyces blakeslecanus, рост которого угнетается в результате гамма-облучения в дозе, составляющей всего 0,008 Гр. Высшие растения обладают высокой устойчи-
востью к облучению: значение дозы LD100 достигает величины порядка сотен и тысяч грей.
Генетически детерминированные различия в радиочувствительности ор-
ганизмов зависят от структурных и функциональных особенностей, а также от условий проживания вида. К структурным факторам относятся: объем ядер, величина генома, плоидность, диаметр, длина и строение хромосом, со-
отношение эу- и гетерохроматина и т. д.
Метаболические характеристики включают особенности обмена веществ, содержание кислорода и ряда эндогенных продуктов в органах и тканях, ак-
тивность репарирующих систем, адаптационные возможности и др.
При этом сама репарационная система обладает определенной степенью радиочувствительности, а интенсивность восстановления зависит от наличия в клетках необходимых метаболитов. Считается также, что стабильность ге- нома тем выше, чем меньше объем хромосом, чем менее интенсивно идут про-
цессы синтеза ДНК и РНК, чем более хромосома спирализована и защищена белками от действия свободных радикалов и других повреждающих агентов.
Влияют и внешние условия – газовый состав (проживание в аэробных или анаэробных условиях), температура (вид арктический или тропический), дие- та (ранее приводился пример высокой радиорезистентности пустынных туш-
канчиков, обусловленной их пищей).
Оценка радиочувстительности разных видов может резко отличаться в за-
висимости от анализируемого теста. Например, выбрав в качестве критерия задержку клеточного деления, мы выявим значительную чувствительность активно пролиферирующих тканей и не обнаружим постлучевой реакции у неделящихся или медленно делящихся клеточных популяций. Выбор друго- го критерия – метаболической активности облученных тканей – мог бы при- вести к противоположному результату: ранние биохимические изменения ча-
сто обнаруживаются в тех клетках, которые казались высокоустойчивыми к облучению по критерию «задержки клеточного деления». Аналогичные трудности возникают при использовании морфологических и физиологиче- ских показателей для оценки степени радиочувствительности тканей и орга- низмов. Еще больше эти различия выявляются при сравнении радиочувстви- тельности различных видов по соматическим (чаще всего используют показа-
тели выживаемости после облучения) и по генетическим критериям.
Так, если по выживаемости ряд млекопитающих можно расположить в по-
рядке убывания следующим образом:
128
кролик – хомяк – крыса – мышь – обезьяна – человек – морская свинка,
то по тесту индукции доминантных летальных мутаций [212] виды распола-
гаются в таком порядке (количество видов в рядах обусловлено имеющимися данными):
мышь – морская свинка – золотистый хомяк,
по частоте хромосомных аберраций в сперматоцитах:
морская свинка – крыса – мышь – обезьяна – кролик,
по частоте реципрокных транслокаций в постмейотических клетках:
хомяк – морская свинка – кролик – мышь.
По данным болгарских ученых Въгленова и Баева [212] по тесту реципрок-
ных транслокаций в сперматогониях при остром облучении аналогичный ряд млекопитающих выглядит таким образом:
обезьяна – хомяк – морская свинка – кролик – мышь – человек,
а при хроническом облучении:
мышь – хомяк – крыса – обезьяна – кролик.
Приведенные данные свидетельствуют о том, что радиочувствительность – это очень лабильный признак, зависящий от огромного количества факторов. Поэтому оценивая или сравнивая виды по радиочувствительности, необходи-
мо указывать, по какому тесту производится эта оценка. Дело в том, что все тесты, приведенные выше в качестве примеров, в большей или меньшей сте-
пени связаны с метаболизмом, который различен в разных клетках одного и того же организма и меняется в зависимости от многих факторов. Исключе-
ние составляют точковые мутации, индукция облучением которых у эукариот практически не зависит от изменений метаболизма (см. п. 2.1), но обусловлена структурными особенностями генома.
В 1973 г. С. Абрахамсон и соавт. выдвинули гипотезу о линейной зависи- мости частоты индуцированных излучением прямых генных мутаций от со- держания ДНК в гаплоидном ядре [251]. Рассмотрев данные по частоте ин-
дуцированных излучением прямых мутаций определенных локусов у ряда организмов, начиная от бактерий и кончая млекопитающими (у бактерий, дрожжей, нейроспоры, дрозофилы, томатов, мышей, ячменя и человека), эти авторы обнаружили, что частота мутаций на 1 локус на 1 сГр у разных орга-
низмов варьировала в пределах трех порядков. Однако если частоту мутаций разделить на количество ДНК в гаплоидном ядре, отнесенное к количеству ДНК у человека, принятому за единицу, то величины, полученные для разных организмов, отличаются только в три раза. При этом была выявлена прямая зависимость между частотой индуцированных излучением мутаций опреде-
ленных локусов у вида и содержанием ДНК в гаплоидном ядре (рис. 2.16).
129
