
Радиобиология / Моссэ И. Б., Морозик П. М. Генетические эффекты ионизирующей радиации
.pdf
dp e dp+ e+ . dp e dp e
Втом случае, когда в половых клетках изучаемого нормального самца
Рнет реципрокной транслокации между II и хромосомами, расщепление
в потомстве соответствует нормальному отношению 1:1:1:1. В другом случае, когда в одном из сперматозоидов нормального самца произошла транслока-
ция, расщепление изменяется. В результате транслокации хромосома получила большой фрагмент III хромосомы с локусом е+, а III – малый фрагмент II хромосомы. Сочетание такой мужской гаметы с женской, несущей оба рецес- сивных гена dp и е, дает гетерозиготу F1 по указанной транслокации:
dp+ e+ . dp e
Усамца этого типа образуются четыре сорта гамет. При скрещивании его
ссамкой, гомозиготной по обоим рецессивным генам, дающей гаметы лишь одного сорта, в потомстве обнаруживается ненормальное расщепление: так как зиготы, имеющие недостачу или излишек генного материала, не выживают, то особи с фенотипом только dp или только е в потомстве отсутствуют. Нарушение
генного баланса приводит к тому, что в FB появляются не четыре фенотипических
класса, а два, т. е. наблюдается расщепление в отношении 1:1.
В последующем генетическими методами, а именно путем изучения ре-
зультатов кроссинговера, можно локализовать место разрывов в хромосомах. Это же можно производить цитологически.
Реципрокные транслокации появляются, как правило, в гетерозиготном состоянии, так как только одна хромосома из пары гомологичных хромосом обменивается участками с другой, негомологичной хромосомой. Гомозиготы по транслокациям получаются в потомстве от особей, гетерозиготных по ним. При этом гомозиготы иногда оказываются жизнеспособными, если разрывы хромосом и новое положение генов не вызывают летального эффекта.
Большой интерес представляет поведение транслоцированных хромосом в мейозе, так как конъюгация таких хромосом у гетерозиготных особей про-
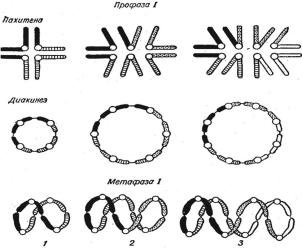
текает своеобразно, у гетерозиготы по транслокации в профазе при конъюгации образуется фигура в виде креста. Она возникает в силу того, что гомоло-
гичные локусы, оказавшиеся в разных хромосомах, испытывают взаимное притяжение на стадии зиготены (рис. 1.13). При неразделившихся центроме-
рах в стадии диплотены крестообразные фигуры образуют сложные хиазмы. В диакинезе в силу сползания хиазм от центромер к концам хромосом полу-
чаются кольцеобразные фигуры.
Иногда хромосомы кольца, переворачиваясь, образуют фигуры в виде восьмерки. Именно такой тип расположения хромосом и дает жизнеспособ-
ные сбалансированные гаметы (рис. 1.13, 1), так как в этом случае к одному полюсу отходят либо обе измененные хромосомы, либо обе неизмененные.
50

Рис. 1.13. Картины синапсиса и продукты мейоза при гетерозиготных транслокациях: 1 – об- разование сбалансированных гамет в случае расположения хромосом в виде восьмерок в мей-
озе; 2, 3 – образование несбалансированных гамет в случае кольцеобразного расположения в мейозе. Стрелкой указаны полюса расхождения хромосом [1]
Когда же хромосомы расположены в виде колец в мейозе, образуются гаметы с несбалансированными геномами: в одних – гены повторяются дважды, в других – они отсутствуют, т. е. имеется либо удвоение, либо нехватка их (рис. 1.13, 2,3). Следовательно, при равной вероятности всех трех типов рас- хождения хромосом в мейозе из шести различных сортов гамет, образующих-
ся у организмов, гетерозиготных по одной реципрокной транслокации, только два сорта гамет (т. е. 1/3) оказываются жизнеспособными. Нежизнеспособные гаметы в некоторых случаях можно определить под микроскопом, например, стерильные микроспоры у кукурузы, энотеры и другие оказываются смор-
щенными или пустыми, в отличие от нормальных.
Следует отметить, что гетерозиготные транслокации у различных расте- ний, а также у животных дают разную степень стерильности. Эта изменчи- вость объясняется различием в частоте разных типов ориентации колец на ве-
ретене в метафазе . У кукурузы ориентация хромосом в виде восьмерок происходит примерно в 50 % случаев, что приводит к образованию 50 % фертиль-
ных гамет. У дурмана, пшеницы, ячменя, томатов, энотеры и других растений
51
ориентация в виде восьмерок происходит более часто, что и объясняет боль-
шую фертильность их гетерозигот по транслокации.
Уряда высших растений, например, у ослинника, пиона, дурмана, коло- кольчика и других, наличие гетерозиготных транслокаций в генотипе являет-
ся нормальным состоянием.
Реципрокные транслокации включают две и более пар хромосом. В мета- фазе образуется кольцо из четырех элементов в результате одной транслока- ции, кольцо из шести элементов – в результате транслокации между тремя па-
рами хромосом и восьмичленное кольцо – при транслокации между четырьмя парами хромосом (рис. 1.14). Из-за образования таких хромосомных комплек- сов нарушается свободное комбинирование хромосом при редукционном де- лении, и, как следствие, расщепление по признакам будет отличаться от мен-
делевского.
Умногих рас ослинника (Oenothera) образование комплексов хромосом является регулярным процессом. Их хромосомы, как установил Р. Клиленд
в1924 г., в мейозе всегда образуют кольца. Оказалось, что некоторые виды ослинника в мейозе имеют 7 пар нормальных бивалентов, но некоторые расы имеют кольца из четырех и более хромосом, а у вида Ое. muricata и Ое. biennis образуется одно кольцо из всех 14 хромосом (рис. 1.15). Причем в метафазеодин из наборов (7 хромосом) идет к одному полюсу, а другой – к другому (рис. 1.15, 2). В этом случае все гены, содержащиеся в каждом из указанных наборов, наследуются вместе, и, следовательно, каждый из потомков всегда получит по два различных комплекса генов.
Транслокации распространены и среди животных, особенно часто они встречаются у кузнечиков и скорпионов. У бразильских скорпионов Tityus
Рис. 1.14. Синапсис хромосом у Oenothera при наличии транслокаций: 1 – образование колец в случае одной; 2 – образование колец в случае двух; 3 – образование колец в случае трех реципрокных транслокаций [1]
52

Рис. 1.15. Клеточное ядро Oenothera на стадии диакинеза: 1 – схематическое изображение хро-
мосом, цифрами отмечена последовательность расположения хромосом в одном кольце; 2 – хромосомное кольцо на стадии диакинеза [1]
и Isqmetrus комплексы, включающие транслокации, сходны с таковыми у рас-
тений.
Изучение транслокаций представляет не только теоретический интерес, но может иметь и практическое значение, поскольку они образуются под дей-
ствием ионизирующей радиации. Исследовать реципрокные транслокации очень удобно на стадии сперматоцитов животных, что позволяет анализиро-
вать мутационный процесс в половых клетках.
1.3. Биохимические методы
Ранее описанные методы основывались на анализе довольно грубых изме- нений генома, что существенно сказывается на жизнеспособности клеток-но-
сителей и в конечном итоге на чувствительности метода в целом. Переход на более тонкий уровень – генный – может преодолеть вышеотмеченный недо- статок и способствовать повышению эффективности оценки генетических эф-
фектов ионизирующей радиации.
К числу «генных» методов относится гликофориновый тест и TCR-тест.
1.3.1. Гликофориновый тест (GPA-тест)
Гликофориновый тест основывается на оценке частоты соматических му-
таций по локусу гликофорина А на эритроцитах периферической крови [2]. Молекула гликофорина экспрессируется на поверхности клеток с частотой до 5 · 105 на клетку в двух аллельных формах, определяющих M- и N-группы кро-
ви, гены которых локализованы в длинном плече 4-й хромосомы [3]. Одним из основных ограничений к широкому использованию этого теста является его применимость только для гетерозигот. В связи с тем, что M- и N-аллели на популяционном уровне встречаются с равной частотой, то гетерозиготы мо-
гут составлять не более половины обследуемой популяции. Вследствие этого настоящий тест применим только для достаточно больших популяций. Гено-
53
токсический эффект по локусу гликофорина А (GPA) может проявляться со стадии эритробластов и свидетельствует о поражении ранних клеток-предше-
ственников эритропоэза, включая полипотентную стволовую клетку [4].
В современной версии GPA-тест реализуется с помощью двуцветной про- точной цитофлуориметрии с использованием моноклональных антител к со-
ответствующим антигенам (M/N-антитела), меченным различными флуорохромами. В результате нормальные клетки гетерозигот будут мечены двумя флуорохромами, в то время как мутантные клетки – только одним. Потеря экспрессии гликофорина А сопровождается появлением мутантных гемизи-
гот N/0 и гомозиготных вариантов N/N. N/0 может возникать по различным механизмам (т. е. бессмысленные генные мутации, мутации, связанные с за- меной аминокислот, делеции или инактивация генов), появление же N/N фе-
нотипических вариантов связано не только с утратой экспрессии гликофорина А, но также с двойной экспрессией (по сравнению с гетерозиготным уровнем) N-аллели. Такие «гомозиготные» варианты могут возникать в результате утраты хромосом и их дупликации, генной конверсии или митотической рекомбина-
ции в клетках-предшественниках.
При обследовании лиц контрольной группы украинской популяции [3] в случае многократных повторных обследований частота мутантных клеток составила (для N/0 гемизигот) 12,3±4,8 · 106 и была достаточно стабильна. У сотрудников Чернобыльской станции этот показатель существенно возрас- тал и варьировал в пределах 23±8,9 · 106. Исходя из этих данных, авторы пред-
ложили формулу расчета дозовой нагрузки:
GPA Mf = (6,4 ± 5,8) · 106 + 13 · 106 D(Гр).
До настоящего времени не существует реальной калибровочной кривой доза–ответ, полученной in vivo (что, по-видимому, практически невозможно), что существенно снижает эффективность этого методического подхода и ос- ложняет его широкое применение для целей биодозиметрии. Этот метод ско-
рее может быть использован для биоиндикации радиационных воздействий, чем для реконструкции доз.
Таким образом, данный методический подход обладает следующими пре- имуществами: метод легко выполним, не трудоемок, что позволяет использо- вать его при популяционных исследованиях, может быть легко автоматизиро-
ван. Мутации по указанному локусу не сказываются на жизнеспособности клеток и тем самым не превращают их в объект для отрицательной селекции.
В то же время для выполнения исследования требуется достаточно боль- шое количество крови, и возможность применения метода ограничена гетеро-
зиготными пациентами.
Метод обладает достаточно высоким порогом чувствительности, что огра- ничивает его применение в области малых доз и мало эффективен при хрони-
ческом облучении.
54
1.3.2. TCR-тест
Одним из разновидностей гликофоринового теста является TCR-тест. Метод основывается на определении частоты специфической субпопуля-
ции Т-клеток (в данном случае Т-хелперов, CD4 + клеток), утративших специфический Т-клеточный рецептор (TCR), ассоциированный с CD3 антигеном – т. е. клеток с фенотипом CD3–/ CD4+. α, β Т-клеточный рецептор (α, β TCR) представляет собой гетеродимер, экспрессирующийся на поверхности боль- шинства зрелых CD4+ и CD8+ Т-клеток периферической крови и лимфоид-
ных органов [5–7].
Другой тип TCR-рецептора, образованного γ- и δ-цепями, также ассоции-
рованного с CD3 антигеном, преимущественно обнаруживается в клетках с даблотрицательным фенотипом (CD4–/CD8–) Т-клеточной популяции [8–10].
Считается, что TCR и CD3 формируют функциональный блок для анти- генного распознавания и сигнальной трансдукции. Для нормальной экспрес- сии любой из компонентов блока является критически важным. Таким обра- зом, инактивация любого гена, кодирующего любой полипептид блока, при- ведет к утрате экспрессии TCR/CD3 комплекса, что в конечном итоге наруша- ет антигенное распознавание и активацию клеток. При клонировании челове- ческих Т-клеточных лимфом, подвергшихся радиационному или химическо- му мутагенному воздействию, были отселектированы многочисленные му-
тантные клеточные линии (TCR/CD3-негативные клетки) [11–16]. Эти клетки утрачивали способность реагировать на различные митогенные стимулы и антитела [14, 15, 17]. В подавляющем большинстве случаев наблюдались де-
фекты именно TCR и, как следствие, внутриклеточное накопление неполных блоков. Исходя из этих данных, было сделано предположение о том, что TCR гены более чувствительны к мутагенным воздействиям, чем CD3 гены.
Четыре TCR гена локализованы в хромосомах 7 (β-, γ-цепи) и 14 (α-, δ-цепи) [18]. Считается, что, как и в случае с генами иммуноглобулинов в В-клетках, только один из аллелей TCR гена может быть активен [19]. Хотя на молеку-
лярном уровне механизм аллельного исключения TCR гена еще не изучен, он может быть чрезвычайно важен при формировании одного идиотипа Т-клеток по TCR. Полагают, что аберрантные незрелые Т-клетки с обоими дефектными аллелями TCR гена гибнут в тимусе [20]. Однако до настоящего времени неиз- вестно, существует ли аналогичный механизм для элиминации зрелых му- тантных Т-клеток, возникших в результате мутагенных воздействий на клет-
ки периферической крови.
Для определения частоты мутантных Т-хелперов используется двуцветная проточная цитофлуориметрия. Очищенные лимфоциты периферической кро-
ви по стандартной методике подвергаются обработке анти-CD3 и анти-CD4 антителами, меченными различными флуорохромами (обычно – F TC и фикоэритрином). Как правило, для анализа используется более 100 000 клеток, ча-
стота мутантных клеток рассчитывается относительно 10 000 нормальных Т-хелперов.
55

Рис. 1.16. Принцип определения частоты мутантных Т-хелперов (F TC-анти-CD4 и PE-анти-CD3–; DC – мертвые клетки (окраска – йодистый пропидиум) [4]
Принцип определения частоты мутант- ных Т-хелперов методом проточной ци-
тофлуориметрии представлен на рис. 1.16. Анализ частоты TCR-мутантов явля-
ется весьма информативным параметром для оценки генетических эффектов иони-
зирующей радиации. К преимуществам этого метода можно отнести возможность его использования при относительно ма- лом количестве биологического материа- ла (0.1–0.2 мл крови), его краткосроч- ность и возможность автоматизации. Од- нако до настоящего времени нет еще до-
статочного информативного сета данных для оценки стабильности данного метода в отношении временного фактора для до-
статочно больших временных периодов.
1.4.Молекулярные методы
1.4.1.Молекулярный метод учета частоты мутаций с помощью ПЦР
Одним из наиболее современных и широко используемых молекулярных методов является метод с использованием полимеразной цепной реакции
(ПЦР).
Поворотным моментом в разработке метода ПЦР явились труды Л. Клеппер и соавт., разработавших принципы использования праймеров (коротких искусственных фрагментов одноцепочной ДНК) [21]. В 1983 г. . Мюллис предложил метод, сущность которого сводится к многократной амплификации IN vitro определенных участков ДНК, определяемых праймерами, в процессе повторяющихся температурных циклов, что, по сути дела, и составляет сущ- ность ПЦР [22]. В каждом термическом цикле синтезированные ранее фраг-
менты вновь копируются за счет действия ДНК-полимеразы.
Метод быстро нашел применение. Уже в 1985 г. Р. К. Сайки и соавт. опубликовали работу с описанием амплификации геномной последовательности β-глобина [23]. С этого момента количество работ с применением ПЦР стало расти в геометрической прогрессии. Особое значение метод ПЦР приобрел в связи с международной программой «Геном человека». В настоящее время предложен ряд модификаций ПЦР, которые позволяют идентифицировать то-
чечные мутации в реальном времени – т. е. при постоянном количественном контроле реакции амплификации в каждом цикле.
Для проведения ПЦР необходим ряд стандартных компонентов реакции. В первую очередь к ним относятся праймеры – искусственно синтезирован-
ные олигонуклеотиды, размером 15–30 пар нуклеотидов, комплементарные
56
специфическим участкам ДНК. Обычно используют пару праймеров, которые фланкируют тестируемый фрагмент и комплементарны двум противополож-
ным цепям ДНК. Taq-полимераза, еще один обязательный компонент рабочей смеси, – термостабильный фермент, обеспечивающий достраивание 3’-конца второй цепи ДНК. Синтез идет за счет добавляемой смеси дезоксинуклеотид-
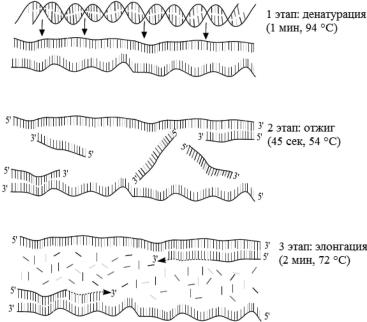
фосфатов. Стабильность реакции поддерживается за счет специального буфера. Анализируемый образец представляет собой очищенную нативную ДНК. Цикл амплификации состоит из трех основных этапов (рис. 1.17).
Первый этап (денатурация). Реакционная смесь прогревается до 92–95 °С,
врезультате чего происходит расплетание двуцепочной ДНК с образованием однонитчатой.
Второй этап (отжиг). Праймеры «садятся» по принципу комплементар-
ности на однонитевую ДНК. Отжиг протекает в соответствии с правилом Чаргаффа – в двунитевой ДНК напротив тимина всегда расположен аденин, а цитозина – гуанин. В противном случае отжиг блокируется.
Третий этап (элонгация). Температура реакционной смеси понижается до ее оптима при работе Taq-полимеразы, и происходит синтез второй цепи ДНК. Если температура отжига и оптимума работы фермента совпадают, то ампли-
фикация превращается в двухэтапный процесс.
Обычно температурный цикл повторяется не менее 30 раз, а количество синтезируемой ДНК удваивается в каждом цикле и в итоге увеличивается
вмиллион раз.
Рис. 1.17. Схема ПЦР
57
Следует заметить, что процесс амплификации геометрически нарастает ограниченное время, а затем его эффективность критически падает («эффект плато»). Этот термин отражает ситуацию накопления продуктов ПЦР на поздних циклах амплификации, когда количество ампликонов достигает 0,3–1 пика-
молей.
В зависимости от условий и количества циклов реакции амплификации на момент достижения «плато» влияют и расходование субстратов (дНТФ и праймеров), и стабильность реагентов, и количество ингибиторов, включая пирофосфаты и ДНК-дуплексы; неспецифические продукты или праймер-ди- меры, конкурирующие за праймеры, дНТФ и полимеразу; а также концентра-
ция специфического продукта и неполная денатурация продуктов амплификации. При этом чем меньше начальная концентрация ДНК-мишени, тем выше риск «плато».
Для ПЦР можно использовать и РНК, что существенно расширяет спектр ПЦР-исследований. При этом необходимо в первую очередь перевести одно- цепочечную молекулу РНК в комплементарную ДНК (cDNA), что осущест- вляется c применением фермента – обратной транскриптазы, который выде-
ляют из Аvian myeloblastosis virus и Moloney murine leukemia virus. Эти фер-
менты термолабильны и могут быть использованы при температуре не выше 42 °С, но при такой температуре молекулы РНК образуют вторичные структу-
ры, а эффективность реакции по разным оценкам составляет приблизительно 5 %. Этот недостаток можно нейтрализовать, использовав в качестве обратной транскриптазы термостабильную полимеразу из Thermus Thermophilus, про- являющую транскриптазную активность в присутствии Mn2+. Для проведе- ния реакции обратной транскрипции в реакционной смеси так же, как и в ос- новном варианте ПЦР, должны присутствовать праймеры и смесь дНТФ. По-
сле проведения реакции обратной транскрипции полученные молекулы кДНК могут служить мишенью для проведения ПЦР.
Для правильной интерпретации результатов ПЦР нужно учитывать, что данный метод не является количественным. Теоретически продукты ампли- фикации единичных молекул ДНК-мишени могут быть обнаружены с помо- щью электрофореза уже после 30–35 циклов. Однако на практике это выпол- няется лишь в случаях, когда реакция проходит в условиях, близких к идеаль-
ным. Особенно большое влияние на эффективность амплификации оказывает степень чистоты препарата ДНК, т. е. наличие в реакционной смеси ингиби-
торов. Иногда из-за их присутствия не удается амплифицировать молекулу ДНК-мишени более, чем до 10 000 копий. Таким образом, прямая корреляция между исходным количеством ДНК-мишени и конечным количеством про-
дуктов амплификации часто отсутствует.
Для визуализации результатов амплификации используют различные ме-
тоды. Например, метод электрофореза, основанный на разделении молекул ДНК по размеру. Для этого готовят пластину агарозного геля, представляющего собой застывшую после расплавления в электрофорезном буфере агарозу
58
в концентрации 1,5–2,5 % с добавле- |
|
|
нием специального красителя ДНК, на- |
|
|
пример, бромистого этидия. Застывшая |
|
|
агароза образует пространственную |
|
|
решетку. При заливке с помощью гре- |
|
|
бенок в геле формируют специальные |
|
|
лунки, в которые в дальнейшем вносят |
|
|
продукты амплификации. Пластину ге- |
|
|
ля помещают в аппарат для горизон- |
|
|
тального гель-электрофореза и под- |
|
|
ключают источник постоянного напря- |
|
|
жения. Отрицательно заряженная ДНК |
|
|
начинает двигаться в геле в электриче- |
|
|
ском поле от минуса к плюсу. При этом |
|
|
более короткие молекулы ДНК движут- |
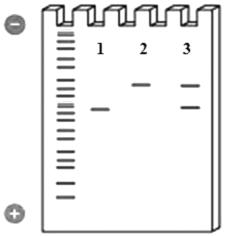
Рис. 1.18. Принцип разделения молекул |
|
ся быстрее, чем длинные. Пример ин- |
ДНК в агарозном геле: образцы 1 и 2 – |
|
гомозиготы по анализируемому полимор- |
||
терпретации результатов электрофоре- |
физму; 3 – гетерозигота; более короткие |
|
за приведен на рис. 1.18. |
молекулы ДНК движутся быстрее, чем |
|
На скорость движения ДНК в геле |
длинные, и пробегают за то же время боль- |
|
влияет концентрация агарозы, напряжен- |
шее расстояние; размер аллелей определя- |
|
ность электрического поля, температура, |
ется с помощью стандартного образца |
|
(лэддера) |
||
состав электрофорезного буфера и в мень- |
||
|
шей степени ГЦ-состав ДНК. Все молекулы одного размера движутся с оди-
наковой скоростью. Краситель встраивается (интеркалирует) в молекулы ДНК. После электрофореза, продолжающегося от 10 мин до 1 ч, гель помещают
на фильтр трансиллюминатора, излучающего свет в ультрафиолетовом диа-
пазоне (254, 310 нм). Энергия ультрафиолета, поглощаемая ДНК в области 260 нм, передается на краситель, заставляя его флуоресцировать в оранжевокрасной области видимого спектра (590 нм). Яркость полос продуктов ампли-
фикации может быть различной.
Более трудным, но и более эффективным, является метод вертикального электрофореза, в котором вместо агарозы используется полиакриламид. Их отличие заключается в том, что электрофорез в полиакриламидном геле име- ет большую разрешающую способность по сравнению с агарозным электро- форезом и позволяет различать молекулы ДНК с точностью до одного нукле-
отида. Однако приготовление полиакриламидного геля несколько сложнее агарозного, кроме того, акриламид является токсичным веществом.
Существуют и другие специальные методы детекции, применимость ко-
торых определяется вариациями ПЦР.
Все большее распространение получает метод ПЦР в реальном времени, который используется для одновременной амплификации и измерения коли-
чества данной молекулы ДНК. Метод ПЦР в реальном времени включает в себя одновременно детекцию и количественное определение специфической
59
