
Радиобиология / Моссэ И. Б., Морозик П. М. Генетические эффекты ионизирующей радиации
.pdfИнтересно отметить, что ДНФ в концентрации 0,30 мкг на муху оказал за-
щитное действие не только на спермин, но и на радиочувствительные стадии – сперматиды и сперматоциты.
Таким образом, эффективность ДНФ меняется в зависимости от его кон- центрации [515]. Поэтому отсутствие защиты спермиев отнюдь не противоре- чит полученным позднее результатам [514]. Следовательно, некоторые фено- лы, такие, например, как ДНФ, способны защищать половые клетки дрозофи- лы от мутагенного действия ионизирующей радиации. К сожалению, в лите- ратуре нет сведений о влиянии этого препарата на генетический эффект об-
лучения у млекопитающих.
Противопоказанием применения ДНФ в качестве радиопротектора слу- жит его метаболическая активность, поскольку вещество препятствует окис-
лительному фосфорилированию и является ассимиляторным ядом, так как может заменить нормальное вещество в физиологических реакциях благодаря химическому сходству с ним [516].
Поскольку проводившиеся более 20 лет (с 1953 по 1975 г.) исследования по- казали, что традиционные радиопротекторы малоэффективны в защите поло- вых клеток животных от мутагенного действия облучения, поиски антиму- тагенных препаратов были перенесены в другую область. Внимание иссле-
дователей привлекли природные соединения, представляющие интерес по двум причинам. Во-первых, известно, что некоторые виды живых организмов обладают высокой радиоустойчивостью. Следовательно, внутри организма существуют какие-то факторы резистентности. Поскольку в живой природе можно обнаружить такие совершенные формы и реакции, которые намно- го превосходят придуманные человеком аналоги, то поиски веществ, «соз-
данных» эволюцией для защиты организма от облучения, могут быть весьма перспективными.
Во-вторых, естественные вещества для организма, даже будучи использо-
ваны в больших концентрациях, чем в норме, окажутся менее токсичными по сравнению с синтезированными искусственно.
Все это побудило исследователей обратиться к таким соединениям, как ДНК и ее предшественники, АТФ и т. д.
5.7.5.Вещества естественного происхождения
Впервых работах по изучению предшественников ДНК было показано, что предварительное воздействие нуклеозидов уменьшает частоту радиаци-
онно-индуцированных сцепленных с полом рецессивных летальных мутаций
впостмейотических клетках дрозофилы [517]. Обработка же предмейотиче- ских клеток галогеновыми производными пиримидина (5-бромдиоксиуриди- ном и 5-бромдиоксицитидином) способствовала увеличению частоты рецес- сивных летальных мутаций, но не повлияла на выход транслокаций в сперма-
тогониях дрозофилы [518].
230
Влияние препаратов ДНК на мутагенный эффект ионизирующей радиа-
ции исследовали в половых клетках самцов мышей – анализировали частоту ДЛМ в постмейотических клетках и частоту реципрокных транслокаций
всперматогониях [519]. Под влиянием ДНК частота доминантных деталей
вранних сперматидах уменьшилась с 67,0 до 62,1 %. В поздних, наоборот, на- блюдалось усиление мутагенного эффекта облучения. В сперматогониях ча-
стота транслокаций также возросла с 4,4 до 5,8 %. Более сильным защитным эффектом обладало использование АТФ в смеси с ацетуроном и АЭТ – наблю- далось существенное снижение частоты транслокаций в сперматогониях мы- шей [520, 521]. При применении АТФ в смеси с метионином и цистеином полу- чено уменьшение выхода рецессивных сцепленных с полом летальных мута-
ций, индуцированных облучением у дрозофилы [522, 523].
Хороший защитный эффект против генетических повреждений, вызванных облучением у мышей, был показан при использовании АТФ [524–527]. Влияние смеси АТФ, АЭТ и серотонина, вводимой самцам внутрибрюшинно за 8 мин до облучения в дозе 400 Р, изучалось в соотношении 45:3:1. Частота индуцирован-
ных реципрокных транслокаций в сперматогониях мышей при этом снизилась примерно в два раза (с 8,65 ± 1,2 до 4,05 ± 0,6 %). При исключении АТФ из смеси наблюдалась лишь тенденция к снижению частоты мутаций. В отсутствие об-
лучения АТФ снижал в два раза выход транслокаций, индуцированных смесью АЭТ и серотонина (статистически недостоверно из-за малых величин).
Интересно, что при защите мышей от лучевой гибели вклад АТФ незначи- телен – защитное действие смеси АТФ + АЭТ + серотонин и смеси АЭТ + се- ротонин одинаково. Таким образом, эти исследования показали, что радио-
протекторы АЭТ и серотонин, снижающие смертность облученных животных, малоэффективны против генетического действия радиации, и для защиты от индуцированных облучением мутаций могут использоваться вещества, мало-
способные повышать выживаемость облученных животных.
Внимание исследователей привлекла также антимутагенная активность α-токоферола (витамина Е). Это соединение оказалось способным подавлять мутагенез, вызываемый химическими и физическими мутагенами, вирусами, старением и т. д. [528–530]. Исследование радиозащитной эффективности α-токоферола в половых клетках самцов дрозофилы, выращенных на среде с витамином Е, проводили путем облучения рентгеновским излучением с последующим скрещиванием с виргильными самками тесторной линии через 24 ч [531]. При этом, если самки выращивались на нормальной пита- тельной среде, снижение выхода рецессивных летальных сцепленных с по-
лом мутаций не обнаруживалось. Если же не только самцы, но и самки вскармливались питательной средой с токоферолом, то частота индуциро-
ванных облучением мутаций значительно снижалась. Авторы предположили, что α-токоферол не влияет на образование первичных радиационных эффек- тов, но модифицирует репарацию предмутационных повреждений, возника-
ющих в зрелых половых клетках самцов и репарируемых после оплодотво-
рения ферментами самки.
231
Большое внимание уделяется исследованию антимутагенного действия различных растений. Многочисленные позитивные результаты, полученные при испытании антимутагенного действия растений, вызвали интерес к рас- тительным экстрактам и у радиобиологов. В частности, исследовалось влия-
ние фитонцидов чеснока и вытяжки из листьев эвкалипта на мутационный процесс, индуцированный ионизирующей радиацией у дрозофилы [532]. По- казано, что использование чеснока не изменило индукции облучением рецес-
сивных летальных мутаций и транслокаций между и хромосомами, а вытяжка из эвкалипта оказала хорошее защитное действие против генетическо-
го эффекта гамма-лучей.
5.7.6. Витамин Е (α-токоферол)
Альфа-токоферол является естественным компонентом клеточной мем-
браны млекопитающих, жирорастворимым витамином и считается основным звеном защиты мембран от перекисного окисления липидов. Витамин Е часто используется в кремах для кожи и лосьонах, так как он способствует улучше-
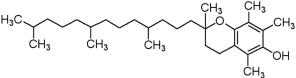
нию заживания и снижению рубцевания кожи после повреждений (ожогов). Витамин Е существует в 8 различных формах: 4 токоферола и 4 токотрие-
нола. Все изомеры (α, β, γ и δ) обладают гидроксильной группой (способной отдавать атом водорода свободным радикалам) и гидрофобной цепью, способ- ствующей проникновению в биологические мембраны (рис. 5.4). Каждая фор- ма обладает собственной биологической активностью и функциональным на-
значением в организме.
Альфа-токоферол традиционно считается наиболее активной формой ви-
тамина Е у человека, являясь сильным биологическим антиоксидантом.
С момента открытия витамин Е считается незаменимым питательным ве-
ществом для всех животных особей. Он использовался при лечении сахарного диабета, аутоиммунных заболеваний и психических расстройств [533]. Эпи- демиологические исследования показали [534], что прием витамина Е в боль- ших количествах связан со сниженным риском сердечно-сосудистых заболе-
ваний, что обусловлено его антиоксидантными свойствами. Aльфа-токоферол является наиболее эффективным липофильным антиок-
сидантом в животных тканях, способным разорвать цепь радикальных про- цессов. Он также участвует в стабилизации биологических мембран. Отсут-
ствие витамина Е в мембране делает ее высокопроницаемой и, следовательно,
Рис. 5.4. Химическая структура витамина Е
232
нестабильной. Также токоферол влияет на другие важные характеристики биофизических мембран, такие как текучесть, в такой же мере как и холесте- рол [535]. Кроме того, витамин Е снижает вероятность возникновения болез-
ней сердца и препятствует образованию кровяных сгустков.
Было показано, что витамин Е способен проявлять защитный эффект про- тив развития опухолей, индуцированных химическими агентами и облучени-
ем. В экспериментах на животных было показано, что он может блокировать образование нитрозаминов – канцерогенов, образующихся в желудке из ни- тритов, потребляемых с пищей [536]. Существуют клинические и эксперимен-
тальные данные, свидетельствующие о корреляции между уровнем витамина Е
вкрови и частотой развития опухолей [536]. В некоторых исследованиях было показано, что дополнительное употребление витамина способствует сни-
жению частоты развития рака молочной и предстательной желез [537]. Также α-токоферол может стимулировать иммунную систему.
Из пищевых продуктов, наиболее богатым источником витамина Е явля- ются растительные масла, такие как пальмовое, оливковое, подсолнечное, ку-
курузное и соевое, а также орехи и ореховое масло, семена подсолнуха, рыба и зерна пшеницы.
Синтез α-токоферола из 2,3-диметилфитилкинола и S-аденозил-L-метио- нина происходит в хромопластах Capsicum annuum (желтый перец). Фермен- ты, участвующие в циклизации (2,3-диметилфитилкинолциклаза) и метили- ровании (S-аденозилметионин-γ-токоферолетилтрансферраза) локализованы
вмембранной фракции хромопластов.
Одной из наиболее важных функций, выполняемых витамином Е в орга- низме, является антиоксидантная. Это вещество считается самым эффектив-
ным природным липидорастворимым антиоксидантом, способным разрывать порочный круг образования свободных радикалов и защищать клеточные мембраны от перекисного повреждения [538]. Кроме этого, α-токоферол также оказывает действие на клеточный ответ при окислительном стрессе за счет модификации путей передачи сигнала [539].
Считается, что α-токоферол может предотвращать перекисное окисление липидов двумя основными путями: путем взаимодействия с ненасыщенными жирными кислотами и защиты полипептидных цепей белков [540].
Токоферол способен к нейтрализации молекулярного кислорода, перекис-
ных и гидроксильных радикалов, а также радикалов атомарного кислорода [541]. Свой эффект он может проявлять во всех клеточных мембранах, ядре, эндоплазматическом ретикулуме и митохондриях [542].
В экспериментах мышам давали с пищей в течение одной недели до облу-
чения и 30 дней после гамма-облучения в дозе 8,5 Гр витамин Е, в три раза превышающий потребность. В результате 60 % мышей выжили в течение 30 дней после облучения, в то время как в контроле все 100 % мышей погибли сразу после облучения. При дозе облучения 7,5 Гр выживаемость облученных осо-
бей составила 10 %, а особей, которым в рацион добавляли витамин Е – 100 %
233
[543]. В другом исследовании при подкожном введении витамина Е наблюда-
лось 79 % повышения выживаемости мышей, облученных в надлетальной дозе 10,5 Гр; принятие витамина Е с пищей не способствовало защитному эф- фекту [544]. В эритроцитах костного мозга мышей при употреблении токофе- рола за 2 ч до и через 2 ч после тотального гамма-облучения в дозе 1 Гр часто-
та формирования микроядер и хромосомных аберраций была значительно ниже по сравнению с облученными мышами без добавления витамина [545].
При анализе радиозащитного эффекта витамина Е у мышей наблюдалось значительное снижение числа апоптозных клеток в подвздошной кишке [546].
5.7.7. Требования к радиопротекторам нового типа
Поиски эффективных противолучевых антимутагенов продолжаются. Не- обходимо, чтобы они соответствовали трем основным критериям: 1) стабиль-
ной химической структуры; 2) эффективности; 3) не токсичности.
Однако ни один из известных на настоящий момент радиопротекторов не удовлетворяет данным критериям. Так, большинство традиционных радио-
протекторов, имеющих стабильную химическую структуру, эффективны лишь в высоких токсичных концентрациях, а вытяжки растений практически не-
токсичны, но не имеют стабильной химической структуры. Все это требовало дальнейших теоретических и экспериментальных исследований с целью по- исков оптимальных радиозащитных препаратов. Кроме того, для радиопро-
текторов нового типа надо, чтобы препарат отвечал следующим критериям:
1)дешевый способ производства;
2)эффективность при пероральном введении;
3)эффективность при хроническом воздействии;
4)способность защищать генеративные клетки от точковых мутаций.
5.7.8. Меланиновые пигменты
Длительное облучение больших групп населения ионизирующей радиа- цией в малых дозах, обусловленное загрязнением окружающей среды радио-
нуклидами, поставило перед радиобиологами задачу поиска радиозащитных препаратов нового типа – способных уменьшать отдаленные эффекты дли-
тельного облучения. Известно, что традиционные радиопротекторы не эффективны при хроническом облучении и к тому же проявляют свои радиозащит-
ные свойства лишь при применении в высоких токсичных концентрациях. Использование наиболее эффективных радиопротекторов с целью умень-
шения генетического действия облучения показало, что они либо вовсе не способны защитить наследственные структуры, либо оказываются менее эф-
фективными, чем при защите от лучевой гибели.
Внимания в этом плане заслуживает пигмент меланин, созданный самой природой для защиты организма от УФ-радиации и образующийся в коже че-
ловека при воздействии солнечных лучей (загар).
234
Меланины представляют собой конденсированные фенольные соедине- ния. Они присутствуют в тканях растений, животных и многих микроорга-
низмов. В организме человека этот пигмент придает окраску волосам, бровям, ресницам, радужной оболочке глаза, коже. В коже животных и человека при- сутствие и новообразование меланина представляет собой защитную реак-
цию организма на действие УФ-излучения.
Меланин не токсичен, содержится в тканях микроорганизмов, растений, животных и человека, в ряде пищевых продуктов.
Под влиянием ультрафиолета интенсифицируется процесс образования меланина из тирозина и других мономеров (загар – защитная реакция орга- низма на воздействие солнечных лучей). Возникновение черной кожи у чело-
века при продвижении первоначальной белой расы в тропические районы произошло, по мнению Ленграйджа, в результате отбора многих мелких му-
таций, обусловливающих формирование все более и более темной кожи, что имеет большое адаптивное значение в этих районах [547].
Образование меланина в организме придает ему устойчивость не только к ультрафиолету, но и к ионизирующей радиации.
Существует связь между содержанием меланина в организмах и их радио-
резистентностью. Так, у многочисленных видов микроскопических грибов, актиномицетов и некоторых бактерий бурые и черные меланиновае пигменты служат защитой от жестких электромагнитных излучений и являются глав-
ной причиной высокой устойчивости пигментированных микроорганизмов не только к ультрафиолетовому (в том числе и коротковолновому), но и к рентге-
новскому излучению.
Штаммы микроорганизмов, содержащих меланиновые пигменты, настолько устойчивы к действию солнечного ультрафиолета и космических лучей, что живут и размножаются в высоких слоях атмосферы, горах, пустынях, Арктике и Антарктике – там, где другие микроорганизмы погибают. Меланин
вопределенных условиях увеличивает выживание даже после летальной дозы
(ЛД100) радиации [548].
Повышение естественного радиоактивного фона, обусловленное примене-
нием радиоактивных веществ, нарушением хранения радиоактивных отходов и т. д., способствует преимущественному развитию темнопигментированных грибов, некоторые из них выживают после облучения почвы в дозе 6400 Гр [549]. Имеются сведения о преимущественной встречаемости меланинсодер- жащих видов грибов в почвенных образцах, отобранных после взрыва атом-
ной бомбы в районе атолла Бикини [550].
Показано, что черные мыши обладают повышенной радиоустойчивостью
врезультате продолжительного облучения их малыми дозами гамма-лучей, а у белых и серых мышей появляется гиперпигментация [551, 552].
При сравнении выживаемости γ-облученных белых и черных штаммов дрожжей также выявлены различия, обусловленные присутствием в клетках
235
черного пигмента меланиновой природы [553]. Клетки трансплантируемой меланомы хомячка, содержащие меланин, в два раза более устойчивы к ле-
тальному действию радиации, чем такие же клетки, лишенные пигмен-
та [554].
Облучение аксолотлей в дозах 500, 1500, 3000 Р стимулировало процесс меланизации в печени, голове и глазах, что является защитной реакцией орга-
низма на облучение [555]. Аналогичные данные получены и при облучении гипофиза лягушки гамма-лучами: усилилось образование меланинов в мела-
нофорах кожи вследствие выделения интермедина из средней доли гипофиза и изменения обмена тирозина [556]. В первые часы после облучения в тканях животных наблюдается усиление окисления тирозина [557].
Меланины животного происхождения способны взаимодействовать со многими радиоактивными элементами: цезием, радием, кобальтом, рутением, стронцием, торием, а также с радиоактивными изотопами цинка, кадмия, свинца, хрома, марганца и железа [558]. Было установлено, что меланин эффективно сорбирует ионы различных металлов [559]. Таким же образом меланины гриб- ного происхождения сорбируют ионы Рb, Th, La, Zn, Cr, Hg, Cu [560]. Повидимому, аналогичные свойства животного меланина ответственны за преи- мущественное накопление 226Rа в пигментированных тканях животных, а также
вмеланоме [561]. Если в среде концентрация 226Rа составляет 25,1 Кu/кг, то
вмеланоме накапливается до 40–360 Кu/кг.
Как отмечал Н. И. Вавилов, в центрах формообразования растений (цен- тры происхождения растений – по Н. И. Вавилову) преобладают сильно пиг-
ментированные формы. Отбор человеком светлоокрашенных форм растений при продвижении их культуры в северные районы означает отбор форм, менее защищенных от мутагенных факторов по сравнению с пигментированными дикорастущими формами [562].
Очевидно, не случаен тот факт, что ткани растений, окружающие генера- тивные органы, окрашены пигментами, которые, вероятно, должны обеспечи- вать их защиту от мутагенов. Наличие форм с высоким содержанием пигмен- та характерно для высокогорных областей с повышенным уровнем ультрафи-
олетовой радиации и космических лучей.
В ряде экспериментов были сделаны попытки использовать меланин для усиления биологической радиорезистентности. В этих экспериментах приме- няли выделенные из грибов четыре фракции меланина, различающиеся рас- творимостью в щелочи и этаноле [563]. Две из них оказывали защитное дей- ствие при облучении мышей рентгеновским излучением и увеличивали сред- нюю продолжительность жизни мышей в 1,5 раза. Добавление меланина в пи- тательную среду существенно повышало выживаемость облученных культи-
вируемых клеток соединительной ткани мышей [564], а внутрибрюшинное введение меланина белым мышам до облучения их в дозе 800 Р, кроме того, значительно увеличивало и продолжительность жизни [565].
236
Установлено, что фенолы могут связываться с ДНК, в частности с ти-
мином [566]. Радиационное повреждение ДНК как раз и начинается с тимина, а меланин способен не только улавливать и обезвреживать свободные ра-
дикалы, но и регулировать концентрацию неспаренных электронов. Кроме того, для ряда фенолов (Nа-галлат, пропилгаллат, кумарины и катехины) показана антимутагенная активность [567–569]. В качестве одной из гипо- тез, объясняющих их антимутагенную способность, предполагается взаи-
модействие фенолов с функциональными группами ДНК, которые могут экранировать важные участки ДНК от действия мутагена или отводить из-
быточную энергию [568].
Эксперименты на животных (дрозофила, мыши) и в культивируемых клет- ках человека показали влияние меланина на отдаленные, генетические по-
следствия облучения: этот пигмент существенно повышает жизнеспособность и снижает в 2–4 раза частоту всех типов мутаций, вызываемых облучением в половых и соматических клетках [188].
Особенно ценной является способность меланина уменьшать частоту ге- нетических повреждений, передающихся из поколения в поколение и нака- пливающихся в популяциях в виде «генетического груза» – в облучаемых по- пуляциях, получавших с пищей меланин, уровень накопленного генетическо-
го груза оказался таким же, как в необлученных популяциях [570].
Таким образом, с помощью меланина впервые показана принципиальная возможность эффективной защиты популяций животных при облучении в те-
чение многих поколений (на дрозофиле исследовано 150 поколений, на мышах – 5 поколений) [570].
Очень важно, что меланин в отличие от всех традиционных радиопротек-
торов, способен защищать организм от хронического облучения. Причем, чем ниже доза или мощность дозы облучения, тем выше защитная эффективность меланина. Так, меланин полностью предотвращает повреждающее действие гамма-лучей в дозе 0,2 Гр [189].
Исследования проводились как с использованием синтетических мелани-
нов, так и выделенных из разного природного сырья – винограда, грибов, шерсти животных, волос человека и т. д. Все они обладают радиозащитной способно- стью, но в разной степени. Наиболее эффективными оказались меланины жи-
вотного происхождения и синтетические. Наиболее дешевыми и удобными для практического использования являются меланины из низших грибов
(табл. 5.4).
В результате токсикологических испытаний было показано, что меланин не обладают мутагенной, канцерогенной, тератогенной или какой-либо дру- гой токсичностью. Более того, при введении меланина облучаемым беремен- ным крысам их потомство превосходит по физическим показателям и способ-
ности к обучению потомство даже не облучавшихся крыс [188].
237
Таблица 5.4. Сравнение биологических функций животных и грибных меланиновых пигментов [570]
|
Животные меланины |
Грибные меланины |
|
|
|
гетерогенные биополимеры на основе |
гетерогенные биополимеры полипептидной |
|
5,6-индолхинона |
природы |
|
Участвуют в защите кожных покровов от |
Участвуют в УФ- и светоустойчивости, вы- |
|
излишнего |
светового и УФ-излучения, |
живаемости при продолжительном голода- |
в функционировании органов слуха, зре- |
нии грибов, усвоении углерода из СО2 возду- |
|
ния, некоторых отделов головного мозга за |
ха и NaHCO3. Пигмент сорбирует фотоны по |
|
счет трансформации фотонов и фононов |
одноквантовому механизму в диапазоне 200– |
|
(звук), электронов по одноквантовому ме- |
900 нм. Предложен механизм взаимодействия |
|
ханизму |
|
пигмента со световыми квантами |
Участвуют |
в устойчивости организмов |
Участвуют в устойчивости грибов к ионизи- |
к ионизирующему излучению, осущест- |
рующему излучению, повышенной сухости |
|
вляют ковалентную модификацию, хране- |
воздуха и субстрата, недостатку кислорода |
|
ние и реализацию клеточной энергии за счет |
в окружающей среде за счет донорно-акцеп- |
|
донорно-акцепторных свойств меланина |
торных свойств пигмента |
|
Связывают разнообразные вещества аро- |
Сорбируют ионы Рb2+, Th4+, La2+, Zn2+, Cr6+, |
|
матической природы, ионы тяжелых метал- |
Hg2+, Cu2+. Являются сильными антиокси- |
|
лов, радиоактивные элементы, что предпо- |
дантами и связывают нестабильные состоя- |
|
лагает возможную регуляцию пигментом |
ния, синглетный кислород, коротко живущие |
|
активности ряда ферментов и пептидов за |
радикалы |
|
счет ионообменных свойств пигмента |
|
|
Пигмент исключительно стабилен IN vivo |
Пигмент практически не лизируется при |
|
и in vitro, в естественных условиях лизису |
длительном культивировании в лаборатор- |
|
практически не поддается |
ных условиях. Участвует в процессах гуму- |
|
|
|
сообразования |
5.8.Механизмы действия радиопротекторов
5.8.1.Некоторые общие механизмы защиты
Смомента установления возможности химической защиты от облучения было выдвинуто много гипотез механизмов радиозащитного действия хими-
ческих веществ [571–580].
Рассмотрим некоторые гипотезы, которые могут представлять интерес
сточки зрения защиты генетических структур от мутагенного действия из-
лучения.
Концепция общего (единого) механизма защиты клеток от ионизирующей радиации основана на представлениях о скрытых радиационных повреждени- ях макромолекул и возможности предотвращения их реализации путем мно-
жественной адсорбции на макромолекулах низкомолекулярных соединений разной химической природы (адсорбционный механизм) [581]. Благодаря та-
кой адсорбции увеличивается период, в течение которого повреждения могут быть репарированы. Предполагается, что молекулы различных низкомолеку- лярных веществ, адсорбируясь в значительном количестве на макромолеку-
лах, скрепляют их структуру и препятствуют тем самым конформационным
238
изменениям. Чем больше времени проходит после облучения, тем выше веро-
ятность разблокировки молекулы в результате флуктуации числа молекул примеси, адсорбированной на ней.
Неспецифичность рассматриваемого механизма защиты касается только природы основного физического процесса, его обусловливающего, т. е. упро- чения структуры макромолекул в результате адсорбции больших концентра- ций примесей. Конкретно же каждое вещество стабилизирует структуру дан-
ной макромолекулы по-своему.
Возможно, что такой механизм защиты может предохранять и от генети- ческих повреждений. По мнению Л. X. Эйдуса, для этого вовсе не обязательна адсорбция примесей на самих наследственных структурах, достаточно защи-
тить макромолекулы, участвующие в каком-либо из процессов, связанных
собразованием хромосомных аберраций. Эти макромолекулы могут находиться не только в ядре, но и в цитоплазме, и в мембранах [578]. Такой механизм мо-
жет быть эффективным и для защиты самих ДНК и ДНП от повреждений, связанных с нарушением строения этих молекул. Повреждения надмолеку- лярных структур ДНК и ДНП возможно предотвратить с помощью «струк- турной защиты» [582]. Этот механизм защиты рассматривается Л. X. Эйдусом
как один из случаев проявления адсорбционного механизма [578].
Действие радиопротекторов независимо от их химической природы может также быть следствием повышения уровня тиолов как в изолированных клет- ках, так и в целостном организме, а снижение содержания SН-групп с по-
мощью специфических блокаторов обусловливает сенсибилизирующий эффект этих соединений [583].
Большинство исследователей разделяют точку зрения о том, что защитное действие радиопротекторов связано с биохимическим шоком [584], вызывае-
мым ими в клетке. Так или иначе, действие радиопротекторов, защищающих от лучевой гибели, обусловлено их влиянием на клеточный метаболизм. В связи с этим представляет определенный интерес гипотеза Лангендорффов, согласно которой существует прямая ассоциация между радиопротекторами и механизмом цАМФ (аденозин-3-5-монофосфат) [585]. По мнению авторов, протектор транспортируется к эффекторным клеткам, где взаимодействует
срегуляторными субъединицами или рецепторами аденилциклазной систе-
мы. Эта система имеет каталитические субъединицы внутри эффекторной клетки. Такое взаимодействие между рецепторами и протекторами вызывает активацию аденилциклазной системы, роль которой заключается в превраще-
нии АТФ в циклическую АМФ. Активация этой энзимной системы приводит к увеличению уровня цАМФ в эффекторной клетке [586]. Очевидно, эффек- тивность протекторов в защите животных обусловлена их способностью сти- мулировать специфическую физиологическую активность эффекторных кле-
ток, которая в противном случае уменьшалась бы в результате облучения. Для того чтобы получить эффективную защиту, необходим уровень цАМФ в клетке более высокий, чем в норме.
239
