
Радиобиология / Моссэ И. Б., Морозик П. М. Генетические эффекты ионизирующей радиации
.pdf5.3. Влияние солей меди на организм
Многие тяжелые металлы являются жизненно важными биологически ак- тивными микроэлементами, необходимыми организму. Металл может слу- жить переносчиком электронов или обеспечивать нормальную упаковку мо- лекул белков при образовании третичной структуры, связываться с амино- кислотами и другими органическими молекулами (мономерами и полимера-
ми), образуя хелатные комплексы.
Тяжелые металлы способны образовывать частично ковалентные связи, «закрепляться» между любыми атомами N, O или S, формируя хелатное кольцо, с их помощью возникают стойкие комплексы с органическими лигандами, стабильность которых в основном определяется природой металла, а не типом лиганда. Особенность меди в этом случае заключается в том, что ее сродство к органическим веществам выше, чем у других металлов, она связывается сильнее других катионов и может вытеснять их из комплексов.
Соли тяжелых металлов при превышении физиологических концентраций обладают токсическим, мутагенным и канцерогенным действием на организ- мы прокариот и эукариот – от микроорганизмов до млекопитающих. Основ- ной механизм их действия заключается в увеличении количества внутрикле-
точных свободных радикалов за счет ингибирования одних и активизации других ферментов. Ионы двухвалентных металлов, особенно Fe2+ и Cu2+, явля-
ясь кофакторами оксидаз, катализируют окислительные процессы. Тяжелые металлы в виде свободных радикалов являются сильнейшими клеточными ядами.
Изменение в свойствах биомембран считают на сегодняшний день наибо-
лее вероятным механизмом токсических эффектов ионов тяжелых металлов на живую клетку как IN vitro, так и IN vivo. Предполагается, что модификация
плазматических мембран, происходящая при взаимодействии ионов тяжелых металлов с клеткой, в дальнейшем запускает комплекс реакций, вызывающих патологические изменения во многих физиологических процессах.
Под действием тяжелых металлов растет проницаемость плазмалеммы для внеклеточных агентов, а некоторые из них могут непосредственно взаи-
модействовать с ДНК, вызывая канонически нерепарабельные повреждения. Тяжелые металлы могут концентрироваться в отдельных органах, тканях и субклеточных структурах. При воздействии на клетку тяжелые металлы мо- гут вызывать апоптоз и некроз. Некоторые тяжелые металлы могут действо-
вать на репаративные системы как стимуляторы, например, индуцируя синтез металлотионинов.
Многие тяжелые металлы влияют на процесс клеточного деления. Тяже-
лые металлы, не являясь мутагенами в неорганических соединениях, в форме органокомплекса проявляют мутагенные свойства, нарушают ферментные взаимодействия, ингибируя отдельные энзимы, в том числе и ферменты, от-
вечающие за синтез ДНК, что проявляется как зависимость эффективности
210
связывания ферментов репарации с ДНК от концентрации тяжелых металлов во внутриклеточной среде.
Все тяжелые металлы в значительной мере задерживаются клеточной стенкой и плазматической мембраной, образуя прочные комплексы с органи- ческими молекулами. Это обеспечивает детоксикацию ионов уже на пути по- ступления в клетку и значительные изменения компонентов мембран. Инду-
цируемые внешними воздействиями изменения в плазмалемме запускают цепь реакций, связанных с передачей сигналов геному, а также приводящих к изменению экспрессии генов. Тяжелые металлы, проходя через метаболиче- скую систему организма, изменяются непредсказуемым образом: могут повы-
шать, понижать, терять и приобретать мутагенную активность [439]. Одним из типичных представителей тяжелых металлов является медь.
Медь – незаменимый микроэлемент, однако в избыточных дозах она явля-
ется сильнейшим токсическим агентом. В природных условиях в воде медь встречается в виде комплексов с цитратом и оксалатом.
Ион Cu2+ имеет уникальные свойства: малый размер при большой атомной массе, способность легко менять валентность и образовывать стойкие ком- плексные соединения со многими органическими молекулами, чем и опреде-
ляется его специфическая физиологическая роль. Как и все тяжелые металлы, медь легко реагирует с физиологически важными группировками аминокис- лот, нуклеиновых кислот, липидов, ароматическими и другими соединения- ми. Наиболее реакционно-активными являются сульфгидрильные, тиоэфир-
ные, дисульфидные и аминогруппы.
Медь входит в состав многих ферментов, повышает каталазную, перокси- дазную и цитохромоксидазную активность тканей, увеличивая их антиокси-
дантный статус и радиорезистентность. Медь в клетке связана с процессом транспорта электронов и является одним из основных регуляторов окисли- тельно-восстановительных реакций. Механизм действия ее заключается в пе-
реносе электрона с одного фермента на другой. Как правило, медь участвует в тканевом дыхании и в образовании фермент-субстратного комплекса [440].
Чувствительность к избытку катионов тяжелых металлов детерминирова-
на генетически [441]. В штаммах бактерий, устойчивых к тяжелым металлам, эта резистентность может быть обусловлена мутациями различных типов, от-
вечающих за подавление системы поглощения клеткой катионов металлов; за активацию выброса поглощенных катионов из клетки; за перестройку систем, чувствительных к ингибирующему действию тяжелых металлов. Эти мута-
ции могут затрагивать и регуляторные, и структурные гены.
В растительных организмах медь участвует в процессах фотосинтеза, по- вышении устойчивости хлорофилла, усвоении азота, продуцировании крах-
мала, стимуляции окислительно-восстановительных реакций [442].
Медь способна инициировать перекисное окисление липидов в клетке и вызывать опосредованные повреждения клеточных компонентов, сходные с последствиями воздействия ионизирующего излучения при так называемом
211
кислородном эффекте. Механизм такой инициации заключается в конверта-
ции неактивного молекулярного кислорода в формы с высокой окислительной способностью медь- и железосодержащими окислительно-восстановительны-
ми ферментативными системами [442].
Способность растений противостоять избытку меди также генетически детерминирована одним или двумя крупными генами. На эту толерантность влияют несколько генов-модификаторов, не наследуемых совместно. Доминант-
ный ген кодирует фенотипические проявления толерантности не только к меди, но и к цинку, и к никелю.
Упозвоночных основным депо меди является печень. У млекопитающих
вобмене меди участвует церулоплазмин – переносчик Cu2+. Церулоплазмин – основной медьтранспортный белок крови, реализующий в межклеточных пространствах антиоксидантную функцию, катализирующий восстановление кислорода до воды, минуя стадию перекиси [443]. Он принадлежит к группе белков острой фазы и является одним из компонентов естественной рези-
стентности организма. Ему присущи иммунотропные свойства, и он способен защищать организм от ионизирующей радиации [444].
Содержание меди в крови позвоночных животных и человека значительно ниже, чем у беспозвоночных (примерно на два порядка). Медь у беспозвоноч-
ных в основном связана с органическими соединениями в крови и в других тканях организма. Она необходима для нормального процесса развития личи- нок, входит в состав гемоцианина. У насекомых медь является составной ча- стью многих ферментов, которые непосредственно связаны с белком. Полифе-
нолоксидаза (о-дифенолоксидаза и п-дифенолоксидаза), являясь типичным медьсодержащим ферментом, играет важную роль в метаболизме пигментов насекомых [445].
Для человека токсичными могут быть любые растворимые соли меди. Доза меди, превышающая 0,6 г, может оказывать токсическое действие на ор- ганизм, вызывая рвоту. Доза в 1–2 г вызывает тяжелое отравление с возмож-
ным летальным исходом. Предельно допустимая доза меди для человека –
10 мг в сутки [446].
Можно выделить следующие группы механизмов повреждения избытком меди нормального функционирования любого организма на молекулярном уровне:
окисление функциональных группировок в органических соединениях; стимуляция гидролаз (ДНКаз, РНКаз, протеаз, липаз) – наиболее опасное
следствие влияния избытка меди на организм; вытеснение конститутивных металлов из органических комплексов [446, 447].
При неспецифическом повышении активности гидролаз повреждается ге-
нетический аппарат, разрушаются мембраны, денатурируют белки.
212
5.4.Влияние сочетанного действия солей меди
иионизирующего излучения на биологические объекты
Комбинированное воздействие факторов разной природы, включающее как индукцию систем репарации, так и подавление их работы, может вызы- вать самые различные ответные реакции – от антагонизма до синергизма. Си-
нергизм обычно наиболее выражен при использовании низких или средних концентраций и доз.
В качестве примера можно привести работу И. Б. Моссэ с соавт. [448] по изучению влияния медного купороса на частоту генетических повреждений
вполовых и соматических клетках мышей, которое проводили на гибридных мышах линии CBA × C57Bl6 и линии Af. Воздействиям подвергали самцов
ввозрасте 2–2,5 мес. Исследуемые химические соединения вводили живот- ным перорально через зонд или внутрибрюшинно. Медный купорос исследо-
вали в концентрациях 28 и 14 мг/кг веса животного. В качестве теста изучали частоту реципрокных транслокаций в половых клетках. Мутации этого типа являются наследуемыми и способны передаваться из поколения в поколение.
Показано, что низкие концентрации медного купороса не повышают ча- стоты реципрокных транслокаций в половых клетках мышей. Это не удиви- тельно, потому что этот тип мутаций индуцируется главным образом ионизи- рующей радиацией или очень сильными химическими мутагенами – радио-
миметиками. Тем не менее более высокие концентрации медного купороса (14 и 28 мг/кг и выше) проявили мутагенную активность, существенно повы-
сив уровень реципрокных транслокаций в половых клетках.
Установлен выраженный мутагенный эффект медного купороса по тесту реципрокных транслокаций в половых клетках и в клетках костного мозга
мышей. Выявлено, что CuSO4 обладает мутагенной активностью в культиви- руемых клетках человека. По тестам доминантных и рецессивных сцеплен-
ных с полом летальных мутаций показано усиление мутационного процесса
впопуляциях дрозофилы под влиянием медного купороса. В результате про- веденных исследований установлено, что в популяциях дрозофилы, подвер-
гавшихся воздействию CuSO4, сформировалась адаптация к его действию. При комбинированном воздействии медного купороса и ионизирующей ра-
диации показано усиление мутационного процесса в популяциях дрозофилы, подвергавшихся воздействию каждого фактора в отдельности, причем макси-
мальный мутагенный эффект получен при сочетанном действии обоих факторов. При облучении мышей в дозе 2 Гр уровень хромосомных аберраций
вполовых и соматических клетках составил 1,29±0,30 и 35,00±2,38 % соот- ветственно (табл. 5.1, 5.2). При совместном действии медного купороса и об- лучения частота хромосомных повреждений в клетках костного мозга со- ставила 39,00±2,44 % и в сперматоцитах – 1,73±0,37 %. Таким образом, мож- но сделать вывод, что при совместном действии медного купороса и облуче-
ния в соматических и половых клетках мышей наблюдается аддитивный ответ (табл. 5.1, 5.2).
213
Таблица 5.1. Влияние сочетанного действия медного купороса и облучения в дозе 2 Гр на частоту реципрокных транслокаций в половых клетках мышей
Вариант опыта |
Количество |
Реципрокные транслокации |
t |
|||
|
|
|
|
|||
мышей |
метафаз |
Количество |
Xi±Si |
|||
|
|
|||||
|
|
|
|
|
|
|
Интактные |
7 |
1430 |
3 |
0,21±0,12 |
|
|
CuSO4 (28 мг/кг) |
9 |
1809 |
15 |
0,83±0,21 |
2,58 |
|
Облучение 2Гр |
6 |
1394 |
18 |
1,29±0,30 |
|
|
CuSO4 + 2Гр |
6 |
1270 |
22 |
1,73±0,37 |
0,94 |
|
Таблица 5.2. Влияние сочетанного действия медного купороса и облучения в дозе 2 Гр на частоту хромосомных аберраций в клетках костного мозга мышей
|
Количество |
Количество |
Количество |
|
||||
Вариант опыта |
|
|
|
|
|
|
t |
|
мышей |
метафаз |
аберраций |
%±Sx |
аберраций |
%±Sx |
|||
|
|
|||||||
|
метафаз |
|
||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Интактные |
12 |
400 |
5 |
1,25±0,56 |
5 |
1,25±0,56 |
|
|
CuSO4 (28 мг/кг) |
12 |
400 |
13 |
3,25±0,89 |
3 |
3,25±0,89 |
1,9 |
|
Облучение 2Гр |
12 |
400 |
140 |
35,00±2,38 |
98 |
24,50±2,15 |
|
|
CuSO4 + 2Гр |
12 |
400 |
186 |
46,50±2,44 |
136 |
34,00±2,24 |
2,17 |
|
Практическое значение полученных результатов состоит в том, что они позволяют прогнозировать генетические последствия загрязнения окружающей среды антропогенными факторами химической и физической природы и свидетельствуют об опасности использования химических препаратов в ра-
диационно-загрязненных районах.
5.5.Цитогенетические эффекты триазиновых пестицидов
Кпестицидам (от лат. pestis – зараза и caedo – убиваю) относят химические соединения, применяемые для борьбы с сорняками (гербициды), вреди- телями растений, эктопаразитами и распространителями заболеваний челове-
ка и животных. К пестицидам также относят некоторые регуляторы роста растений (ауксины, гиббереллины, ретарданты), ряд веществ облегчающих механизированную уборку урожая (дефолианты, десиканты), а также добавки
ккраскам против обрастания морских судов водорослями.
По своей химической структуре пестициды весьма разнородны, большин- ство из них представляют собой синтетические органические вещества, так-
же есть и неорганические соединения.
Использование пестицидов в качестве эффективного фактора борьбы с сорной растительностью является одним из основных методов химической защиты в сельскохозяйственном производстве. Наряду с неоспоримыми до-
стоинствами этого метода применение пестицидов сопряжено одновременно и с негативными последствиями. Выступая в качестве антропогенного токси-
канта окружающей среды, пестициды представляют потенциальную угрозу
214
для генетических структур человека. Неуклонное расширение использования пестицидов в сельском хозяйстве, недостаточная изученность их комбиниро-
ванного действия с другими факторами антропогенного загрязнения, обуславливает необходимость пристального внимания к этой проблеме.
Токсическое действие гербицидов затрагивает не только растения, но мо- жет проявлять себя и по отношению к другим биологическим объектам. Уста-
новлено, что не менее 50 % используемых пестицидов обладают выраженной мутагенной активностью. Следует также отметить, что потенциальная гене-
тическая угроза связана не только с расширением применения пестицидов в сельском хозяйстве, но и с их кумулятивной способностью. Выступая в ка- честве неучтенного фактора, воздействие пестицидов может существенно ис- казить результаты исследования стабильности генетического аппарата биоло-
гических объектов, подвергнутых воздействию других мутагенных факторов физической и химической природы.
Особый интерес среди пестицидов вызывает зенкор, способный модифи- цировать результаты радиационного воздействия. Зенкор относят к гетероци- клическим соединениям триазиновой химической структуры. Как и ряд дру-
гих триазинов, зенкор используется в качестве гербицида для борьбы с сорной растительностью. Зенкор (синоним бутразин) – производное 1,2,4-триазина (симм-триазина). Зенкор использовался для борьбы со многими однолетними двудольными и злаковыми сорняками [449].
Вработе [450] исследовалось влияние совместного действия ионизирующего излучения и гербицида зенкора на генетическую структуру экспери-
ментальных популяций дрозофилы по локусам алкогольдегидрогеназы (Аdh)
иэстеразы (Est-6). В опытах проводился сравнительный анализ популяций, которые выращивались на стандартной среде, с популяциями, подвергавши- мися облучению в дозе 15 Гр на поколение, а также, с популяциями, культиви- руемыми на среде с добавлением зенкора в концентрации 0,15 мг/л и популя-
циями, подвергнутыми совместному воздействию зенкора и облучения. Авторы показали, что содержание популяций дрозофилы в условиях дли-
тельного облучения приводит к снижению частоты локусов Est-6F с 0,41 до 0,27 по сравнению с контролем. При этом также наблюдается повышение ча- стоты SS-гомозигот приблизительно в два раза и частоты S-аллеля от 0,60 до
0,73. Для локуса Аdh в условиях длительного облучения выявлено повышение частоты аллеля F от 0,50 до 0,68–0,69 по сравнению с контролем. Таким образом, авторы показали, что в популяциях дрозофилы, содержащихся в услови-
ях длительного облучения, наблюдается сдвиг в сторону селективного преимущества аллеля F для локуса Аdh и аллеля S для локуса Est-6.
Вопытах с добавлением гербицида зенкора в питательную среду популя-
ций дрозофилы показано, что в начале мониторинга наблюдается рост частоты гетерозигот по гену Аdh от 0,30 до 0,56 по сравнению с контролем. В дальнейшем, после 10-го поколения, отмечается снижение уровня частоты FF-гомо-
зигот приблизительно в два раза, с 0,30–0,33 до 0,17–0,14. При этом также
215
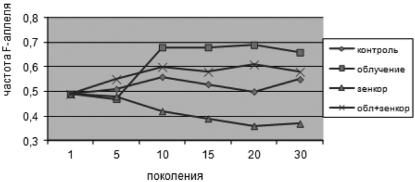
наблюдается рост частоты SS-гомозигот от 0,23–0,30 до 0,37–0,41. Частота гетерозигот на данном этапе сохранялась на уровне 0,46–0,51. Для локуса Est-6 воздействие зенкора привело к эффектам, сходным с действием длительного облучения. Таким образом, полученный результат свидетельствует, что куль- тивирование популяций дрозофилы на среде с зенкором приводит к возраста- нию частот аллелей генотипов Аdh-SS и Est-6-SS.
Что касается совместного действия ионизирующей радиации и зенкора, то в этом случае частоты гетерозигот FS локусов Аdh и Est-6 выше, чем в вариантах с раздельным действием радиации или зенкора. Таким образом, авторы делают вывод, что при комбинированном воздействии ионизирующей радиа- ции и зенкора на популяции дрозофилы, наблюдается селективное возраста-
ние гетерозиготных генотипов локусов Аdh и Est-6, в то время как при раздельном действии этих факторов наблюдается повышение частоты гомозигот
(рис. 5.1).
Выявлено, что наиболее приспособленным к действию ионизирующей ра- диации оказался генотип Adh-FF. В то же время в условиях хронического воз- действия гербицида зенкора на популяции дрозофилы более адаптивно цен-
ным генотипом оказался генотип Adh-SS.
При комбинированном воздействии ионизирующей радиации и зенкора обнаружено возрастание частоты гетерозигот, что проявилось как эффект ан- тагонизма. Однако известно, что увеличение частоты гетерозигот дает адап-
тивные преимущества особям, но на популяционном уровне может оказаться неблагоприятным из-за выщепления и элиминации неадаптивных генотипи-
ческих комбинаций.
В работах [451, 452] исследовалось влияние зенкора и облучения на мута- ционный процесс в экспериментальных популяциях дрозофилы. Зенкор вно-
сили в питательную среду в концентрации 0,15 мг/мл. Облучению подвергали личинок в дозах 5,0; 7,5 и 15 Гр. В опытах анализировалась частота морфоге-
нетически измененных особей, средняя приспособленность и мутационный груз. Учет фенотипических изменений проводили в первоначальной популя-
Рис. 5.1. Динамика частоты Adh-F аллеля в экспериментальных популяциях дрозофилы
при облучении и воздействии зенкором
216
ции и на протяжении 25 поколений. При хроническом воздействии зенкора и при комбинированном действии пестицида и облучения мониторинг произ-
водился на протяжении 30 поколений.
Авторами показано, что при воздействии зенкора, суммарная частота ле- тальных и полулетальных мутаций аутосомы 2 возрастает в первом поколе-
нии от 2,86 до 12,66 % по сравнению с контролем. В 15-м и 30-м поколениях частота мутаций снижается до 4,60–4,69 %, но продолжает оставаться досто-
верно выше, чем в контроле. Облучение в дозе 15 Гр привело к повышению уровня мутаций в 15-м поколении до 16,90 %, а в 30-м до 60,00 %. Комбиниро- ванное воздействие зенкора и облучения в дозе 15 Гр также привело к повы- шению уровня мутаций по сравнению с контролем, но при этом частота мута-
ций была значительно меньше, чем ожидалось, а в 30-м поколении была ниже эффекта отдельного облучения. Так, при комбинированном воздействии зен-
кора и облучения в первом поколении частота мутаций составила 7,15 %, в 15-м – 21,18 %, в 30-м – 21,42 %. Авторы делают вывод о мутагенной актив-
ности зенкора и о проявлении эффекта антагонизма при совместном действии зенкора и облучения. В связи с тем, что частота совместного действия зенкора и облучения была существенно ниже, чем ожидалось при суммировании эффектов обоих факторов, то авторы полагают, что антагонизм является след-
ствием повышенной гибели особей при комбинированном воздействии радиации и пестицида.
Также была произведена оценка динамики морфогенетической изменчиво- сти экспериментальных популяций дрозофилы под влиянием зенкора, облуче-
ния 15 Гр и комбинированного действия этих факторов. Показано, что зенкор повышает уровень морфозов до 13,80 % по сравнению с контролем, в котором частота колебалась от 0,20 до 5,26 %. Облучение оказалось менее эффективным, чем воздействие зенкора, максимальная частота морфозов достигала 4,76 %. При сочетанном воздействии гербицида и радиации уровень морфозов достигал промежуточных величин действия отдельных факторов, т. е., как полагают авторы, в этом случае также наблюдается эффект антагонизма.
Аналогичные данные получены и при изучении динамики частоты мор- фозов при облучении в дозе 5 и 7,5 Гр. Совместное действие пестицида и об-
лучения привело к снижению уровня аберрантных фенотипов по сравнению с действием одного облучения. При этом авторы подчеркивают тот факт, что это явление наблюдается как при воздействии значительных доз (5 и 7,5 Гр), так и при дозе 0,5 Гр. Анализируя спектр морфогенетических изменений, авторы отмечают, что при всех вариантах воздействия преобладают морфозы крыльев. Облучение чаще вызывает изменения в процессах формирования крыльев и щетинок, реже – хитинизацию брюшка. Комбинированное воздей- ствие зенкора и облучения приводит к появлению аномалий крыльев и нару- шению хитинизации брюшка. При различных вариантах воздействия наблю-
дался весь спектр аберрантных генотипов, различия касались только частоты их встречаемости.
217
Авторами также исследовалась динамика плодовитости и жизнеспособно- сти дрозофилы в популяциях разных типов при раздельном и совместном воз- действии зенкора и облучения в дозах 5,0; 7,5 и 15 Гр. В экспериментах наблю-
дается значительное колебание динамики жизнеспособности и плодовитости популяций при всех вариантах воздействия. Облучение во всех исследован- ных дозах статистически уменьшило жизнеспособность, но выраженной за- висимости от дозы радиации не наблюдалось. При воздействии зенкора про-
исходит «выравнивание» плодовитости и жизнеспособности особей в ходе смены поколений, пики «максимума» и «минимума» становятся менее выра-
женными. Для зенкора показано снижение численности особей в популяциях. Авторы полагают, что это связано с нарушением пестицидом естественных циклических колебаний численности, что приводит к изменению колебаний динамики плодовитости и жизнеспособности.
Исследовалось также совместное влияние зенкора и облучения на половые клетки мышей. Зенкор вводили за 3 или 24 ч до облучения в концентрациях 0,1; 0,25; 1,0; 10,0 и 150,0 мг/кг веса животных. Использовалось как перораль- ное, так и внутрибрюшинное введение зенкора. Исследовался выход реци- прокных транслокаций на стадии сперматоцитов. Пероральное введение зен-
кора мышам в концентрациях от 0,1 до 1,0 мг/кг не оказало мутагенного эффекта. Повышение уровня реципрокных транслокаций наблюдалось при концентрации пестицида 10,0 мг/кг (с 0,12 до 0,57 % у линии Аf и с 0,18 до 0,52 % у гибридных мышей) и при концентрации 150,0 мг/кг (0,71 % у ли-
нии Аf).
Проведено сравнение эффективности перорального и внутрибрюшинного введения зенкора, а также дополнительного влияния облучения в дозе 4 Гр. При внутрибрюшинных инъекциях зенкора наблюдался значительно более выраженный мутагенный эффект, чем при пероральном введении. В боль-
шинстве вариантов эффективность внутрибрюшинного введения превышала результативность перорального в два и более раза, также зафиксирована му- тагенная активность препарата и при низких концентрациях зенкора. Что ка- сается совместного действия облучения и внутрибрюшинного введения пе-
стицида, то и в этом случае наблюдались эффекты антогонизма.
При хроническом облучении в течение 20 сут до суммарной дозы 3 Гр зенкор вводился перорально, в концентрациях 0,1; 1,0 и 10 мг/кг в течение всего периода облучения. При комбинированном воздействии пестицида и облучения зафикси-
ровано достоверное снижение выхода реципрокных транслокаций по сравнению с ожидаемой суммарной величиной отдельных эффектов (в три и более раза). По-
лученный результат можно объяснить эффектом антагонизма, обусловленным, очевидно, гибелью клеток, поврежденных обоими факторами (рис. 5.2).
Таким образом, обобщая изложенное выше, следует отметить, что исполь- зуемые в сельскохозяйственной практике триазиновые гербициды, в том чис- ле и зенкор, даже при условии соблюдения рекомендуемых норм концентра-
218
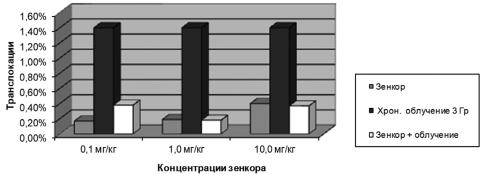
Рис. 5.2. Комбинированное действие зенкора и хронического облучения на уровень реципрок-
ных транслокаций в половых клетках мышей
ций, способны оказывать негативное действие как на растительные организ-
мы, так и на другие биологические объекты.
5.6. Нитриты и нитраты
Нами предпринято исследование генетических последствий сочетанных воздействий ионизирующей радиации с нитритом и нитратом натрия, у жи- вотных и в культивируемых клетках человека [187, 453]. Нитрит и нитрат на-
трия широко используются в качестве удобрений и находятся практически во всех сельскохозяйственных продуктах.
Врезультате изучения генетической активности нитрита и нитрата натрия
уживотных (дрозофила, мыши) по разным тестам (доминантные и рецессив- ные летальные мутации, хромосомные аберрации) выявлено, что эти веще-
ства не являются мутагенами. Однако при совместном действии с ионизирующей радиацией они существенно усиливали мутагенное действие облуче-
ния. Так, при добавлении NaNO2 и NaNO3 в корм дрозофилам частоты доми-
нантных и рецессивных летальных мутаций, индуцированных облучением, возрастали примерно в два раза (рис. 5.3).
Аналогичные данные были получены и на мышах при добавлении нитри- та и нитрата натрия в питьевую воду на протяжении 2,5; 5,0 и 7,5 мес. – часто-
та реципрокных транслокаций, вызванных смешанным гамма-нейтронным облучением, увеличивалась в 2–4 раза (табл. 5.3).
Таким образом, показано, что вещества, не обладающие мутагенной ак- тивностью, могут значительно увеличивать генетическую опасность ионизи-
рующей радиации.
Приведенные данные свидетельствуют о том, что эффекты комбинирован-
ных воздействий химических и радиационных факторов могут отличаться от ожидаемых суммарных результатов. Эти факты необходимо учитывать при оценке генетических последствий сочетанных воздействий факторов различ-
ной природы.
219
