
Радиобиология / Моссэ И. Б., Морозик П. М. Генетические эффекты ионизирующей радиации
.pdfСуществование АО в клетках млекопитающих было показано в начале 1980-х годов [306]. Проводили анализ частоты сестринских хроматидных об-
менов и выживаемости при обработке алкилирующими соединениями клеток СНО и фибробластов кожи человека, трансформированных вирусом S 40. Значения адаптирующей и повреждающей концентраций различались в 100 раз. Авторы показали наличие АО и его зависимость от соблюдения определенно-
го временного интервала между дозами – не более 2–6 ч [307, 308]. Адаптивный ответ при действии ионизирующей радиации был показан
Оливьери с соавт. в 1984 г. Адаптирующее воздействие производили путем инкубации лимфоцитов в присутствии 3Н-тимидина (0,01–0,1 мк Ки/мл). По-
вреждающая доза составила 1,5 Гр. Анализ проводился по частоте выхода хромосомных аберраций [309]. В случае фракционированного облучения эф-
фект оказался гораздо ниже, чем однократное облучение в соответствующей суммарной дозе. Полученный эффект был аналогичен АО, выявленному ранее при помощи химических мутагенов.
Существование радиоадаптивного ответа было подтверждено на лимфо-
цитах человека по частоте возникновения различных перестроек хромосом [310]. Как правило, при одновременной оценке радиоадаптивного ответа по нескольким критериям на одном объекте эффекты коррелировали [311].
Помимо лимфоцитов человека, радиоадаптивный ответ был обнаружен в сперматоцитах и костном мозге мышей, в клетках китайского хомячка, на лимфоцитах кролика, а также на многих других объектах по всем биологиче-
ским критериям [303, 312–314].
Для возникновения АО необходимым условием является наличие между предварительным и последующим облучением временного интервала не ме- нее 4–6 ч. В зависимости от индивидуальных показателей экспериментально-
го объекта АО может быть зафиксирован во временном интервале от 4–24 ч до нескольких недель после предварительного облучения [315].
Например, проведено исследование адаптивной реакции в сперматоцитах мышей при увеличении интервала между облучениями в адаптирующей и по-
вреждающей дозах от 1 до 5 сут (рис. 4.2).
Полученные результаты свидетельствуют о проявлении АО в сперматоци-
тах мышей в отдаленные от первичного воздействия сроки. Так, выраженный эффект снижения выхода реципрокных транслокаций по сравнению с облуче-
нием в однократной дозе с 1,73 до 0,29 %, регистрировался даже спустя 120 ч после облучения в адаптирующей дозе. В то же время при интервале между облучениями менее 4 ч АО в сперматоцитах мышей не наблюдался.
Степень проявления АО существенно зависит от величины адаптирующей дозы – эта зависимость может быть описана кривой, приближающейся к точке максимума и затем убывающей. Наличие подходящей адаптирующей дозы, превышение которой уменьшает проявление радиоадаптивного ответа, отме-
чено во многих работах.
170
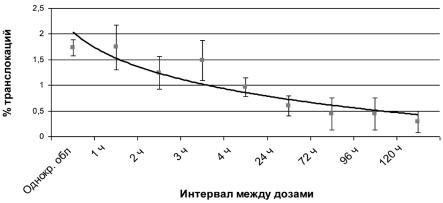
Рис. 4.2. Исследование радиоадаптивного ответа в сперматоцитах мышей при различных ин-
тервалах между адаптирующей и выявляющей дозами
Наиболее оптимальный промежуток времени между двумя облучениями со- ставляет 5–6 ч. При уменьшении времени между облучениями происходит сни-
жение выраженности радиоадаптивного ответа. Что касается сдвига в сторону увеличения времени между облучениями, то имеются противоречивые данные –
внекоторых работах показано сохранение способности клеток к радиоадаптивно-
му ответу в течение десятков часов, хотя в других работах отмечается, что при таких интервалах между облучениями (12–24 ч) АО не наблюдается.
Анализировалась также зависимость выхода хромосомных аберраций
влимфоцитах человека от мощности дозы. Показано отсутствие влияния из- менения мощности повреждающей дозы. Что касается адаптирующего воз- действия, то при величине предварительного воздействия 0,5 Гр радиоадап-
тивный ответ был наиболее выражен при мощности дозы 0,005 Гр/мин, а при дальнейшем увеличении мощности постепенно снижался вплоть до полного снятия радиоадаптивного ответа при мощности дозы 0,05 Гр/мин. Однако при использовании адаптирующей дозы 0,1 Гр наблюдалась другая зависимость. Радиоадаптивный ответ был слабо выражен при низкой мощности, но увели-
чивался при ее повышении. Очевидно, для оптимального проявления радиоадаптивного ответа наиболее эффективно при адаптирующем облучении от- носительно высокими дозами использовать низкую мощность, а при воздей-
ствии более малой адаптирующей дозы – высокую мощность.
4.2.1.Радиоадаптивный ответ в клетках животных
ичеловека при хроническом облучении
Адаптивный ответ выявлен и при хроническом облучении. Так, показано, что облучение мышей в дозе 0,04 Гр в течение 70 сут с дальнейшим однократ-
ным облучением в дозе 2,98 Гр вызывает радиоадаптивный ответ по выходу хромосомных аберраций [316].
171
Аналогичные результаты обнаружены также при исследовании лимфоци- тов крови людей, подвергавшихся длительное время профессиональному об-
лучению в дозах более 14·10–3 сГр в месяц [317].
При изучении выхода хромосомных аберраций в костном мозге крыс, под-
вергнутых разным дозам хронического гамма-облучения (2,9; 8,7 и 40 сГр при мощности дозы 2,9 сГр/сут) и последующего острого облучения (4 и 6 Гр при мощности дозы 27 сГр/ мин) также получена адаптивная реакция. Показано, что величина АО зависит от дозы хронического облучения: максимальная ве-
личина наблюдается при облучении 0,4 Гр [318].
В то же время в работе И. Пелевиной и соавт. получен противоположный результат. Они проводили сравнение индивидуальных величин проявления АО у жителей Москвы и Брянской обл. Отмечено снижение числа индивидуу-
мов с проявлением реакции АО в популяциях, проживающих в загрязненных районах (по частоте лимфоцитов с микроядрами) [319]. Также наблюдается наличие индивидуумов, среди доноров Брянской обл., имеющих повышенную чувствительность к последующему облучению. Подобные субпопуляции от-
сутствуют среди Московских доноров. Таким образом, авторы предполагают, что хроническое облучение в малых дозах не вызывает само по себе адаптив- ной реакции, т. е. не является адаптирующим фактором. Исследователи счи- тают, что хроническое воздействие радиации в малых дозах приводит к изме-
нению в геноме, снижению защитных реакций и репаративной способности, а также подавлению синтеза белков, необходимых для развития адаптивного ответа.
Однако эти результаты могут быть следствием того, что данные группы людей подвергались хроническому облучению еще до первого тестирования, и АО у них уже был индуцирован ранее. Определить первоначальную радио-
чувствительность при этом было невозможно, поэтому и АО выявить не удалось.
4.2.2. Механизмы адаптивного ответа
Что касается механизмов развития АО, то до настоящего времени в этом вопросе нет окончательной ясности. Показано, что формирование АО корре- лирует с появлением в клетке новых белков [315]. Ингибиторы белкового син- теза, такие как циклокгексимид и хлорамфеникол, подавляют реакцию радио-
адаптивного ответа [302].
Характерно, что одни и те же белки образуются при возникновении АО под действием не только радиации и химических мутагенов, но и при воздей- ствии другими разнородными повреждающими факторами: гормонами, те-
пловым шоком, тяжелыми металлами, окислительным стрессом и т. д. [301]. Таким образом, можно сделать вывод о неспецифическом антистрессовом
характере формирования АО под воздействием самых разнообразных повреж-
дающих факторов.
172
Исследования на прокариотах показали активацию репарационной систе- мы при формировании АО [320]. По-видимому, большое значение в этом про- цессе имеют механизмы безошибочной репарации, к которым относятся экс-
цизионная репарация оснований и эксцизионная репарация нуклеотидов [321]. В норме эти виды репарации ответственны за ликвидацию простых повреж-
дений ДНК, таких как модификации оснований и однонитевые разрывы ДНК. Однако не исключено, что при стимулирующем действии радиации возраста-
ет их роль в репарации не только простых, но и более сложных нарушений [321]. Облучение в малых дозах вызывает увеличение уровня репарации дву-
нитевых разрывов ДНК по механизму гомологичной рекомбинации, также представляющему свободный от ошибок путь [322].
Показано, что активация процесса репарации происходит с участием бел-
ка поли(АДФ-рибозо)полимеразы [323]. Считают, что он имеет критическое значение для процесса формирования АО, поскольку при его ингибировании АО не наблюдается [324].
Неотъемлемой характеристикой АО является изменение экспрессии неко-
торых генов, которое может происходить в течение нескольких часов после облучения. В данном случае ионизирующая радиация является индуктором активации ряда неспецифических генов клеточного ответа на повреждение ДНК [325].
При изучении АО, возникающего под действием предобработки малыми концентрациями алкилирующих соединений, были определены ответствен-
ные за реакцию гены. По некоторым генам удалось провести секвенирование и установить первичную структуру белковых продуктов [326, 327].
Центральную роль в процессе формирования клеточного ответа на ДНКповреждающее действие радиации играет ген р53, продукт которого является фактором активации транскрипции для генов репарации, контроля клеточно-
го цикла и апоптоза [328]. Регуляция клеточного цикла в его контрольных точках осуществляется за счет активации продуктов специфических генов, среди которых первостепенное значение имеют PCNA, циклин D1, циклин A, xip8, xip5 и xip13 [329], белки p21/CIPl/WAFl и GADD45 [330]. Недавно гомолог гена р53 млекопитающих обнаружен у Drosophila melanogaster [331].
Кроме того, на начальном этапе облучения происходит индукция генов раннего ответа, к которым относятся cjun, EgrI, cfos, и NFKВ [332]. Их функция заключается в транскрипционной активации генов, имеющих важ- ное значение для адаптации клеток и тканей к повреждающему действию ра-
диации. Потенциальные мишени для них представляют гены факторов роста и цитокинов, гены репарации ДНК. Продукты генов раннего ответа могут также участвовать в регуляции клеточного цикла и контроле процесса про-
граммируемой гибели клеток [332].
Обнаружен ген DIR1, который, по-видимому, имеет специфическое значе- ние в формировании АО. После облучения в малых дозах клеток L132 обнару-
жили временную репрессию данного гена [333]. Исследование молекулярных
173
и клеточных функций гена DIR1 выявило сходство его продукта с семейством белков теплового шока, известных как иммунофилины. Они участвуют в мно-
гочисленных клеточных функциях, включая генерализованную реакцию на повреждение ДНК и контроль клеточного цикла [334].
Дальнейший анализ функций гена DIR1 показал, что он также принимает участие в контроле клеточного цикла. Более того, продукт этого гена вовле- чен в процесс регуляции уровня репарации ДНК [333]. Показано, что репрес- сия DIR1 в клетках, обработанных рентгеновскими лучами в дозе 4 Гр, спо- собствует значительному увеличению уровня репарации однонитевых разры-
вов ДНК, а после действия облучения в дозе 2 Гр приводит к возрастанию уровня выживших клеток [335].
Другим семейством генов, способных к неспецифической активации в от-
вет на действие облучения, являются мобильные генетические элементы (МГЭ) [336]. Наряду с аутоиндуцированной активацией в ответ на повреждение ДНК [337, 338] они способны увеличивать уровень перемещений с использованием многих универсальных белков внутриклеточной реакции на неблагоприятное воздействие, это прежде всего транскрипционный фактор NF-кВ [339] и белки
теплового шока [340].
В ряде работ анализировался выход хромосомных и изохромосомных раз-
рывов при комбинированном воздействии облучения в адаптирующей дозе, а затем химическими мутагенами [341, 342]. Показано, что АО наблюдается по отношению к блеомецину, вызывающему двухнитевые разрывы ДНК, и мито- мицину С, вызывающему сшивки типа ДНК–ДНК. Авторы полагают, что на- копление определенного количества повреждений такого типа, является од-
ним из механизмов инициации АО. Действие алкилирующих агентов (метилили этилметансульфоната) снимало проявление АО, а в ряде случаев повыша-
ло выход генетических нарушений.
При использовании в качестве адаптирующей дозы блеомецина либо пере-
киси водорода формируется АО к последующему облучению, что указывает на возможную роль накопления разрывов ДНК, необходимого для запуска ре-
акции АО [343, 344].
Показано также, что обработка облученных в адаптирующих дозах клеток цисплатином, вызывающим образование сшивок ДНК, снимает проявление АО [342].
Адаптивный ответ не наблюдается и в присутствии бензамида – ингиби- тора фермента АДФ – фосфорибозилтрансферазы, ответственного за репара-
цию разрывов ДНК и АДФ – рибозилирование белков [311]. Активность АДФ – фосфорибозилтрансферазы значительно стимулируется при облучении [345].
Кроме того, показано, что через 4 ч после облучения мышей в дозе 0,01 Гр происходит снижение активности тимидинкиназы в костном мозге на 40 % с постепенным восстановлением исходной активности к 10 ч после облучения. В результате этих процессов наступает временное ингибирование синтеза ДНК, что, вероятно, способствует ее репарации [346].
174
Существует мнение, что основными механизмами АО являются: 1) индук-
ция репарации ДНК; 2) клеточная селекция. Согласно этому представлению, пусковым механизмом радиоадаптивной реакции является активация рецеп- торов факторов роста, в результате радиационно-индуцированных поврежде-
ний плазматической мембраны клеток. В дальнейшем происходит активация транскрипционных факторов C-Jun/AP1 и P53, а также ряда других фермен- тов, выступающих в качестве посредников (в основном это цитоплазматиче-
ские протеинкиназы) при передаче сигнала активирования рецепторов к этим факторам. Ключевым моментом гипотезы является то, что транскрипционные факторы C-Jun/AP1 и P53 принимают участие как в апоптозе, так и в эксцизи- онной репарации ДНК. Это позволяет объединить две гипотезы возникнове-
ния АО: за счет индукции репарации ДНК и за счет клеточной селекции [304].
4.2.3. Влияние модифицирующих факторов на адаптивный ответ
Степень выраженности радиоадаптивного ответа может варьироваться у отдельных индивидуумов [347]. По ряду данных у некоторых здоровых лю-
дей радиоадаптивный ответ вообще не регистрировался. Объясняется это двумя причинами.
Во-первых, феномен АО является, как указано выше, неспецифическим, т. е. слабое химическое воздействие делает организм более устойчивым к после-
дующему воздействию ионизирующей радиации и наоборот. Радиоадаптивный ответ может быть вызван самыми разнообразными факторами, включая вирус-
ные инфекции, стрессы, пищевые добавки и т. д. При этом адаптирующий агент не вызывает цитогенетических эффектов. Следовательно, если перед облучени-
ем организм испытал на себе адаптирующее воздействие какого-либо фактора, то облучение в адаптирующей дозе уже не вызовет адаптивной реакции, по-
скольку она уже была индуцирована неконтролируемым воздействием. Положение осложняется еще и тем, что проявление АО также зависит от
других влияющих на организм факторов. Показано, что различные химиче-
ские вещества модифицируют радиоадаптивную реакцию.
Так, нами обнаружено, что если перед адаптирующей дозой ввести в орга- низм радиопротектор меланин, то АО не проявляется. Выступая в роли буфе-
ра, меланин снимает действие малой дозы радиации, предотвращая АО. Если же ввести меланин между адаптирующей и повреждающей дозами, то прояв- ляется и защитный эффект меланина, и радиоадаптивная реакция, в результа- те чего частота генетических нарушений снижается практически до контроль-
ного уровня (рис. 4.3).
Введение меланина мышам за 2 ч до облучения оказывало одинаковый эф- фект как при однократном, так и при фракционированном облучении в поло-
вых и соматических (костный мозг) клетках. Было не ясно, то ли меланин не снижает мутагенное действие фракционированного облучения, то ли в усло-
виях защиты меланином АО не проявляется [188].
175
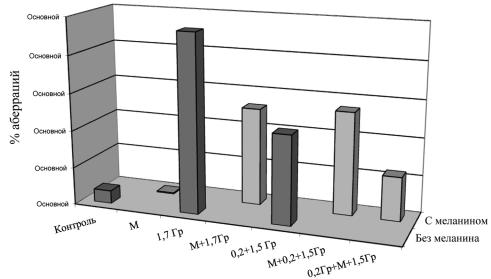
Рис. 4.3. Влияние меланина на адаптивный ответ в клетках костного мозга мышей (М – меланин)
Чтобы выяснить причину полученных данных, мы исследовали влияние меланина, введенного после адаптирующей дозы, за 2 ч до воздействия в ос-
новной дозе 1,5 Гр. В этом случае частота мутаций оказалась в четыре раза ниже, чем при однократном воздействии в той же дозе, что можно объяснить суммированием эффектов АО и протекторного действия меланина. В половых клетках в варианте 0,2 Гр + меланин + 1,5 Гр частота мутаций снизилась поч-
ти до спонтанного уровня. Из полученных данных можно сделать вывод, что меланин, введенный перед адаптирующей дозой, полностью снимает ее эф-
фект, и поэтому реакция АО не проявляется.
Маскировать адаптивный эффект способен и антиоксидант токоферол. В то же время гербицид зенкор, обладающий слабым мутагенным действием, подавляет проявление радиоадаптивной реакции, ингибируя репарационные процессы (рис. 4.4).
Так, при изучении влияния зенкора на фракционированное облучение 0,2 + 1,5 Гр было обнаружено, что уровень хромосомных аберраций в половых и соматических клетках мышей существенно не различался по сравнению с результатами острого облучения в суммарной дозе 1,7 Гр при введении зен-
кора как перед адаптирующей дозой, так и после нее перед выявляющей дозой, т. е. АО в присутствии зенкора не проявлялся [188, 189].
Исследовалась также способность радиопротектора МИГИ-К (мидийного гидролизата) модифицировать АО. Опыты проводились на мышах. Адаптиру- ющая доза составляла 0,05 Гр, повреждающая 5,5 Гр. Интервал между облуче-
ниями 7–11 сут. Препарат МИГИ-К вводили с питьем в течение двух недель до облучения в адаптирующей дозе. О результатах опыта судили по выходу
176
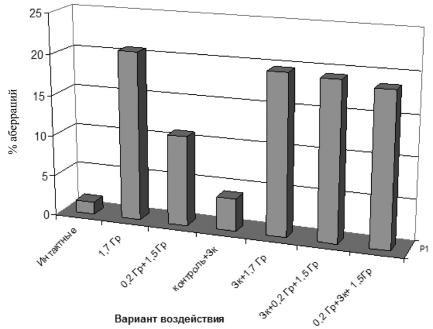
Рис. 4.4. Влияние зенкора на радиоадаптивный ответ в клетках костного мозга мышей (Зк – зенкор)
селезеночных эндоколоний. В эксперименте получена адаптивная реакция. При введении МИГИ-К эта реакция усиливалась.
Таким образом, проявление АО может как усиливаться, так и подавляться под воздействием различных модификаторов [189].
4.3. Радиационно-индуцированный «байстэндер» эффект
До последнего времени считалось, что генетические последствия, вызван-
ные воздействием облучения, связаны с эффектом прямого повреждения ДНК. Классическая догма радиобиологии, интерпретированная из теории ми- шени, постулирует, что генетические повреждения происходят только в про- цессе либо немедленно после передачи энергии ионизирующих частиц ядер- ной ДНК (мишенные эффекты) и являются следствием только прямого эффек- та радиации либо воздействия короткоживущих радиационно-индуцирован-
ных радикалов кислорода; при этом биологические последствия наблюдаются в течение одного или двух клеточных поколений.
Многочисленные данные, которые появились в последние годы, свиде- тельствуют о том, что ионизирующее излучение может вызывать биологиче- ские эффекты (включая повреждение ДНК), не пересекая ядро – т. е. внеми-
шенные. В ряде исследований было показано, что генетические изменения могут происходить в большем количестве клеток, чем ожидалось при облуче-
177
нии культуры клеток млекопитающих слабым потоком альфа-частиц, при ко- тором только через очень малую часть клеток непосредственно проходили ча-
стицы [348–350]. Эти и другие исследования (перенос облученной среды от клеток-доноров необлученным реципиентам [351], инкорпорирование радио-
нуклидов [352] и облучение с использованием пучка заряженных частиц [353]) показали, что облучение клеточного ядра не является необходимым условием для формирования генетических повреждений либо биологического ответа. Необлученные клетки, находящиеся в окружении облученных, либо реципи- енты питательной среды от облученных клеток также могут отвечать на ради-
ационное воздействие (рис. 4.5).
Таким образом, основной чертой «внемишенных» эффектов радиации яв-
ляется то, что прямое облучение ядра (ДНК) не является необходимым для их проявления. Одним из таких внемишенных эффектов является радиационно-
индуцированный «байстэндер» эффект (radiation-induced b stander effect, РИБЭ) –
это явление передачи информации, вызывающей клеточные повреждения, от клеток, пораженных каким-либо агентом, другим клеткам, на которые прямо этим агентом не воздействовали [354]. Соответственно, радиоиндуцирован-
ный «байстэндер» эффект – это явление передачи информации, вызывающей клеточные повреждения, от облученных клеток необлученным.
К настоящему времени накоплено огромное количество эксперименталь-
ных данных, полученных на различных модельных системах, доказывающих наличие «байстэндер» эффекта [355].
4.3.1.«Байстэндер» эффект при облучении
В1954 г. Парсонс показал, что у детей, которым облучали селезенку для лечения лейкемии, наблюдалось поражение костного мозга [356]. Это являет- ся первым свидетельством того, что радиационное поражение не ограничива-
ется облученными клетками.
Впоследние годы в лабораториях всех развитых стран продемонстрирова- но существование вызываемого облучением «байстэндер» эффекта, при кото- ром повреждения возникают в необлученных клетках. В этих работах предпо-
лагается, что эффективное сечение мишеней потока радиоактивных частиц
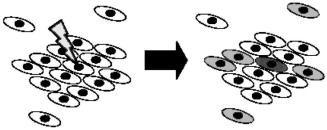
Рис. 4.5. Схема «байстэндер» эффекта: клетка при прямом радиационном поражении выделена темно-серым, при «байстэндер» эффекте – светло-серым
178
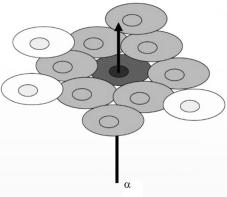
намного больше, чем размер ядра. |
|
В ранних работах Нагасава и Литтл |
|
клетки культур китайского хомячка об- |
|
лучали альфа-частицами в дозах между |
|
0,03 и 0,25 сГр, так, чтобы только около |
|
1 % клеток были подвержены прямому |
|
действию облучения. Однако хромосом- |
|
ные повреждения наблюдались более |
|
чем у 30 % популяции [348]. Таким об- |
|
разом, их данные показали, что повреж- |
|
дение ДНК может быть вызвано в боль- |
|
шем количестве клеток, чем реально |
Рис. 4.6. Демонстрация «байстэндер» эф- |
подверглось облучению (рис. 4.5). |
|
Это было неожиданным и противо- |
фекта при воздействии радиации: одиноч- |
ная альфа-частица проходит через клетку, |
|
речило модели прямого повреждения. |
передавая ей дозу радиации. Это, в свою |
В течение последующих нескольких лет |
очередь, приводит к повреждениям в со- |
результаты, полученные в ряде лабора- |
седних клетках, хотя доза прямого воздей- |
торий, подтвердили данный факт. Кон- |
ствия для них равнялась нулю |
|
цепция «байстэндер» эффекта получи-
ла признание. Клеточные реакции, вызванные с помощью этого эффекта, включают в себя индукцию хромосомных аберраций, генные мутации, инак-
тивацию и гибель клетки, апоптоз (или программируемую клеточную смерть), злокачественную трансформацию и генетическую нестабильность [353, 357–361].
Было показано, что облучение 20 альфа-частицами приводит к увеличе-
нию частоты мутаций в три раза больше, чем ожидалось, полагая, что данный эффект не существует (рис. 4.6).
Множество исследований «байстэндер» эффекта стали возможными бла-
годаря использованию микролучей, позволяющих малому количеству заряда (легких ионов) попасть в единичное клеточное ядро [353].
Последующие работы показали, что клетки, облученные прицельным ми- кропучком альфа-частиц, могут индуцировать мутагенный ответ в близлежа- щих клетках, не подвергшихся прямому облучению [350]; межклеточное взаи-
модействие играет основную роль в возникновении данного феномена [362].
4.3.2. «Байстэндер» эффект, вызванный различными видами излучений
«Байстэндер» эффект в клетках, вызванный воздействием альфачастиц.
Было признано, что альфа-частицы, пересекая ядро клетки и повреждая ДНК, приводят к генетическим нарушениям. Данные повреждения ДНК могут вы- звать мутации или хромосомные аберрации в дочерних клетках. Эксперимен- ты, проводимые Нагасавой и Литтлом в 1992 г., показали, что область генети-
ческих изменений, вызванных «байстэндер» эффектом, в 9–350 раз больше, чем область непосредственного поражения [348]. Механизмы данного эффекта,
179
