
tot_book
.pdf71
Л. Больцман показал, что в необратимых процессах термодинамическая вероятность каждого последующего состояния больше, чем предыдущего. Если считать термодинамический процесс последовательностью состояний, то термодинамическая вероятность w будет возрастающей функцией, т. е. dw > 0 (для обратимых процессов все состояния равновероятны, при этом dw = 0). Формально термодинамическая вероятность и энтропия системы близки по смыслу, что и позволило Л. Больцману представить энтропию системы в форме
s = k ln w, |
(1.86) |
где k = 1,38054·10–26 кДж/кг — постоянная Больцмана.
Л. Больцман полагал, что “природа стремится от состояний, менее вероятных, к состояниям, более вероятным”. Это утверждение также можно считать формулировкой второго начала.
Следует помнить, что принцип возрастания энтропии применим только к изолированным системам. Кроме того, любая термодинамическая система должна быть замкнутой, поэтому использовать его за пределами этих ограничений, например, для анализа процессов во Вселенной, недопустимо.
Соотношение (1.85) в сочетании с уравнением первого начала позволяет объединить оба основных закона (начала) термодинамики. Из уравнения (1.85) следует, что dq ≤Tds ;
объединенное уравнение первого и второго начал термодинамики примет вид
Tds ≥ de + pdv |
(1.87) |
или |
|
Tds ≥ dр−vdp. |
(1.88) |
Соотношения (1.87) и (1.88) справедливы для любых процессов — обратимых и необратимых.
1.5.6. Т–s-диаграмма состояний. Изменение энтропии в процессах идеального газа
72
Из формулы (1.85) следует, что теплота произвольного обратимого процесса, идущего от состояния 1 к состоянию 2,
s2
q1−2 = ∫Tds.
s1
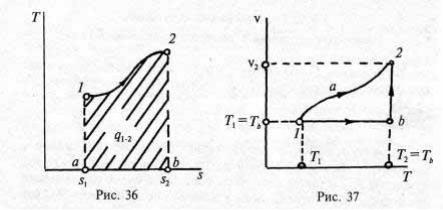
Если по оси абсцисс отложить энтропию системы, а по оси ординат — абсолютную температуру, то площадь под кривой процесса 1–2 в такой диаграмме состояний будет равна теплоте, подведенной (отведенной) в данном процессе (рис. 36). Это обстоятельство делает диаграмму T–s чрезвычайно удобной, и наряду с p–v-диаграммой ее широко используют в термодинамике. По аналогии с диаграммой p–v (рабочей) Т–s-диаграмму называют
тепловой диаграммой состояний.
Рис. 36 Рис. 37
Применим Т–s-диаграмму к анализу процессов идеального газа. Изменение энтропии газа в обратимых процессах х = const можно оценить, используя объединенное уравнение первого и второго начал (1.87):
Tds ≥ de + pdv.
Если подставить в эту формулу значение de = cvdT и поделить обе части на Т, то получим
ds = c |
dT |
+ |
pdv |
, |
|
T |
T |
||||
v |
|
|

73
но для идеального газа Tp = Rv , поэтому
dTT + R dvv .
Рассчитаем изменение энтропии в произвольном обратимого процессе 1–2. При этом вспомним, что разность s2 – s1, не зависит от пути интегрирования, поскольку s — функция состояния. Изобразим процесс 1–2 в диаграмме состояний v–T(она “ничем не хуже”, чем р–v или Т–s-диаграммы, а в данном случае делает рассуждения более наглядными). Переведем рабочее тело из состояния 1 в состояние 2 не по первоначальному пути 1а2, а по ломаной 1b2, состоящей из отрезков изохоры v = const и изотермы Т= const (рис. 37). Поскольку на прямой 1b dv = 0, а на прямой b2 dT
= 0,
|
|
|
|
2 |
|
|
T |
dT |
|
|
|
|
v |
2 |
dv |
|
||||||
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
|
|
|
||||||
∆s1−2 = s2 − s1 = ∫ds = ∫cv |
|
|
|
|
+ ∫ |
R |
|
, |
||||||||||||||
T |
|
v |
||||||||||||||||||||
|
|
|
|
1 |
|
|
T1 |
|
|
|
|
vb |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
но, с другой стороны, Тb = Т2, vb = v1 отсюда |
|
|
|
|
||||||||||||||||||
∆s |
= c |
vm |
|
T2 |
ln |
T2 |
+ R ln |
v2 |
. |
|
|
|
(1.89а) |
|||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
1−2 |
|
|
|
T |
|
|
T1 |
|
|
|
v1 |
|
|
|
||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Аналогично, используя р–Т-диаграмму, получим соотношение |
||||||||||||||||||||||
|
|
|
|
|
T2 |
T |
|
|
|
p |
2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
∆s |
= c |
pm |
|
|
ln |
2 |
− R ln |
|
|
|
. |
|
|
|
(1.89б) |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
1−2 |
|
|
T1 |
|
|
T1 |
|
|
|
p1 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
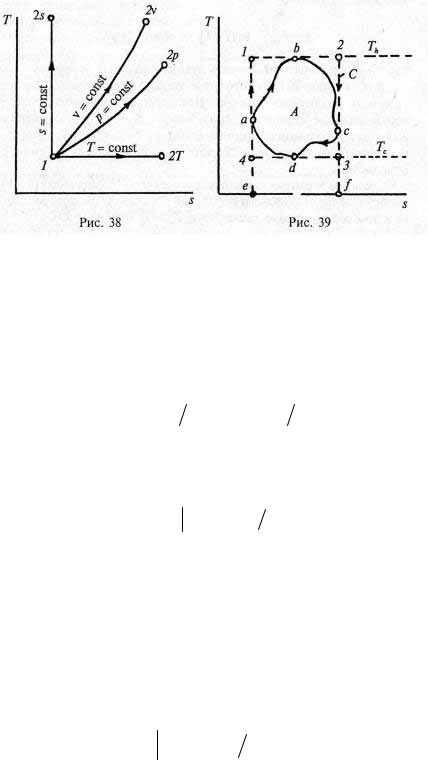
Уравнения (1.89а) и (1.896) справедливы для любого обратимого процесса идеального газа х = const. Рассмотрим частные случаи: Т = const, v = const, p = const, q = 0 и n = const (рис. 38).
74
Изотермический процесс 1–2Т изображен на тепловой ди-
аграмме горизонтальной прямой, его теплота
q1−2T =T (s2T − s1 ),
а изменение энтропии, на основании соотношений (1.89а и 1.89б)
∆sT = s2T − s1 = R ln(v2T v1 )= R ln(p1 p2T ). |
(1.90) |
Чтобы получить уравнение изохорного процесса 1–2v, ис пользуем уравнение (1.89а). При v2 = v1 из него следует, что
∆sv = s2v − s1 |
= cvm TT2v ln(T2v T1 ). |
(1.91) |
|
1 |
|
Если в изохорном процессе заданы начальная и конечная удельные энтропии s1 и s2, то формула (1.91) позволяет определить конечную температуру
T2v =T1 exp[(s2v − s1 )/cvm |
|
TT2v ]. |
(1.92) |
|
|||
|
|||
1 |
|
||
Аналогичный анализ для изобарного процесса 1–2р дает: |
|||
s2 p − s1 = cpm TT2 p ln(T2 p T1 ), |
(1.93) |
||
1 |
|
|
|
Поскольку сpm > cvm, экспонента (1.94) на рис. 39 идет более полого, чем экспонента (1.92).
Адиабата 1–2s на тепловой диаграмме — вертикальная прямая, совпадающая с линией s = const. Теплота в этом процессе не подводится и не отводится (q1–2s = 0), изменение энтропии равно нулю (s2s – s1 = 0).
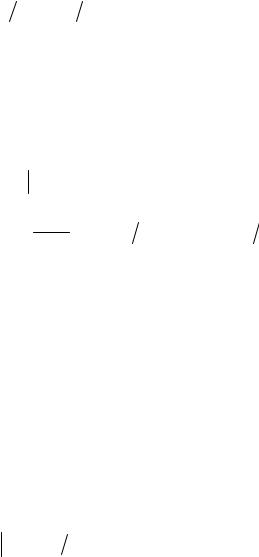
75
В политропном процессе (n = const) из уравнения Tvn–1 = const следует, что
v2n v1 = (T1 T2n )1 (n−1) ;
(n−1) ;
кроме того, политропная теплоемкость
|
|
|
|
c |
n |
= c |
|
n −k |
|
= c − |
R |
|
, |
|
|
|
|||
|
|
|
|
|
n −1 |
n −1 |
|
|
|
||||||||||
|
|
|
|
|
|
|
v |
|
|
v |
|
|
|
|
|||||
поэтому из формулы (1.89а) следует, что при |
|
|
|||||||||||||||||
|
|
|
|
|
|
c |
|
T2 = c |
v |
= const, |
|
|
|
|
|||||
|
|
|
|
|
|
|
vm T |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
∆s |
|
= s |
|
− s = |
|
|
|
− |
|
R |
|
T )= c |
|
ln(T T ). |
(1.95) |
||||
|
|
c |
|
|
ln(T |
|
|||||||||||||
|
n |
|
2n |
1 |
|
|
v |
|
|
n −1 |
2n 1 |
|
n |
2n 1 |
|
||||
Формулы (1.90), (1.91), (1.93), (1.95) позволяют вычислить
изменение энтропии. Истинное же значение энтропии в точке на диаграмме состояний неизвестно: энтропия, как и другие функции состояния, определена с точностью до постоянной. Для того чтобы иметь конкретные значения s, договариваются о точке, где энтропии приписывают нулевое значение. Такая точка для газов соответствует нормальным условиям (TN = 273,15 К; pN = 760 мм рт. ст.). Если энтропию отсчитывать от этой точки, то результаты совпадут с табличными значениями энтропии:
s = cvm TTN ln(T TN )+ R ln(v vN ),
vN ),
где vN — удельный объем газа при нормальных условиях.
В Т–s-диаграмме состояний удобно сравнивать эффективность различных циклов. Покажем, в частности, некоторые важные свойства цикла Карно. В осях Т–s он имеет вид прямоугольника, причем площадь под верхней изотермой равна подведенной теплоте, а под нижней — теплоте отведенной.
Сравним термические КПД двух циклов: обратимого цикла Карно С и произвольного обратимого цикла А, расположенного в том же интервале температур Th и Тс (см. рис. 39).
Термический КПД цикла С зависит только от температур Th и
Тс:
76
ηC =1 |
− q2C |
=1− |
Tc (s3 − s4 ) |
=1− |
Tc |
, |
|
|
|||||
t |
qC |
Th (s3 − s4 ) |
Th |
|||
|
1 |
|
|
|
|
|
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
qC =T (s |
− s |
4 |
); |
qC =T (s |
3 |
− s |
4 |
) — теплота, подведенная |
и |
|||||||||
1 |
h |
3 |
|
|
2 |
c |
|
|
|
|
|
|
|
|||||
отведенная в цикле Карно, соответственно. |
|
|
|
|||||||||||||||
Поскольку в Т–s-диаграмме теплота эквивалентна площади |
||||||||||||||||||
под кривой процесса, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
ηC |
=1− q2C |
=1− пл.e4d3 f ; |
|
|
|
||||||||||
|
|
|
t |
|
|
q1C |
|
|
|
пл.e1b2 f |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
ηA |
=1− q2A |
=1− пл.eadcf , |
|
|
|
||||||||||
|
|
|
t |
|
|
q1A |
|
|
пл.eabcf |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
где q A, q A — теплота, |
|
подведенная |
и |
отведенная |
в |
цикле |
А, |
|||||||||||
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
соответственно. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Согласно рис. 39, |
qC > q A , |
|
|
qC < q A |
, поэтому |
ηC |
> ηA. |
|
||||||||||
|
|
|
|
|
|
1 |
1 |
|
|
2 |
|
2 |
|
|
t |
t |
|
|
Таким образом, термический КПД цикла Карно больше,
чем термический КПД любого другого цикла в том же интервале температур. Другими словами — цикл Карно является своего рода эталоном, поскольку его термический КПД — наивысший из всех возможных в данном температурном интервале. Поэтому о термодинамическом совершенстве реального цикла судят, сравнивая его термический КПД с термическим КПД цикла Карно.
При анализе эффективности циклов часто используют понятие среднеинтегральной температуры подвода и отвода теплоты. Если в процессе 1–2 подводится или отводится теплота

77
Рис. 40.
s2
q1−2 = ∫T1−2ds, s1
где T1−2 — температура процесса (зависящая, в общем случае, от параметров рабочего тела), то, на основании теоремы о среднем,
q1−2 = T1−2 (s2 − s1),
где T1−2 — среднеинтегральная температура процесса 1–2; поэтому
|
|
−2 = q1−2 /(s2 − s1). |
(1.96) |
T1 |
|||
Среднеинтегральная температура процессов подвода и отвода теплоты позволяет рассчитать термический КПД произвольного цикла D (см. рис. 40). На участке abc этого цикла теплота подводится, так как здесь ds > 0 и, поэтому Tds = dq > 0. На участке cda теплота отводится (здесь ds < 0 и dq < 0). Подведенная теплота
q1D = qabc =Th (sc − sa ),
где Th — среднеинтегральная температура подвода теплоты; отведенная теплота
q2D = qcda = Tc (sa − sc ) =Tc (sc − sa ),
где Tc — среднеинтегральная температура отвода теплоты. Следовательно, термический КПД цикла D
|
|
78 |
|
|
|
|
|
− q2D |
|
|
|
|
|
ηD =1 |
=1− |
|
Tc |
. |
||
|
|
|||||
t |
qD |
Th |
||||
|
1 |
|
|
|
|
|
Формулу (1.97) широко используют при эффективности циклов двигателей и холодильных машин.
(1.97)
оценке
1.5.7.Термодинамическая шкала температур
Спомощью цикла Карно можно ввести температурную шкалу, которая не зависит от свойств термометрического тела, —
термодинамическую шкалу температур.
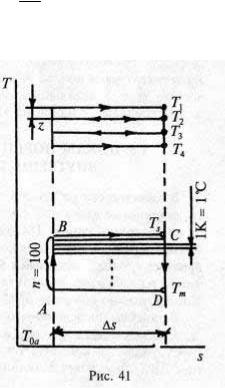
У. Томсон (Кельвин) рассмотрел совокупность элементарных циклов Карно, осуществляемых между температурами Т1 и Т2, Т2 и Т3, Т3 и Т4 и т. д. (рис. 41). Для таких циклов
T1 |
= |
q1 |
; |
T2 |
= q2 |
; |
|
T3 |
= |
q3 |
;... |
||
|
T |
|
|||||||||||
T |
|
q |
2 |
|
T |
q |
|
|
q |
4 |
|
||
2 |
|
|
|
3 |
3 |
|
4 |
|
|
|
|||
После преобразований получим последовательно:
|
T1 −T2 |
= |
q1 −q2 |
; |
T2 −T3 |
|
|
= |
q2 − q3 |
; |
T3 −T4 |
|
= |
q3 −q4 |
;... |
||||||||||||||||
T |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
q |
2 |
|
|
|
|
|
T |
|
|
|
|
|
q |
|
|
|
|
T |
|
|
|
|
q |
4 |
|
||
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
|
|
|||
|
|
|
T1 −T2 |
= |
q1 − q2 |
|
; |
|
T2 |
−T3 |
= |
q2 |
−q3 |
|
;... |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
T −T q |
2 |
− q T −T q −q |
4 |
|
|
|
|
|
|
||||||||||||||||||||
|
|
2 |
|
3 |
|
|
|
|
3 |
|
|
|
3 |
4 |
3 |
|
|
|
|
|
|
|
|||||||||
Если принять, что Т1 – Т2 = T2 – T3 = T3 – T4=z, то в каждом из элементарных циклов Карно термический КПД будет одним и тем же.
Итак, отношение температурных интервалов равно отношению теплоты, преобразуемой в работу в элементарных циклах, а оно никак не связано с родом вещества, используемого в термометрии.
Кельвин зафиксировал нижний температурный уровень на отметке Т0а=–273,15 °С, что соответствует состоянию, когда движение микрочастиц должно прекратиться (абсолютному нулю температур). Если теплота отводится при Т0а=0, ηt =1, что противоречит второму началу, поэтому абсолютный нуль температур недостижим.
79
Пусть цикл Карно ABCD осуществляется в интервале температур от Ts = 100 °С до Тm = 0 °С — между точками кипения воды и таяния льда (индексы соответствуют англ. saturation и melting).
Если разбить цикл ABCD на 100 одинаковых циклов Карно, то работа каждого из них составит 0,01 от общей работы цикла ABCD, причем эта калорическая величина будет соответствовать единице температуры — одному градусу (1 °С совпадает по величине с 1 К).
Практическая реализация термодинамической шкалы потребовала бы точных измерений количества теплоты на изотермах, что связано с большими трудностями в постановке экспериментов. В интервале температур 1…1530 К термодинамическую шкалу температур реализуют с помощью идеально-газовых термометров. Их устройство чрезвычайно просто. В сосуде постоянного объема находится газ, при нагреве давление в сосуде увеличивается, а температуру газа рассчитывают по уравнению Клапейрона-Менделеева
T = vpR = const p.
80
Рис. 41.
Использование идеально-газового термометра не умаляет ценности главного вывода, сделанного Кельвином: существуют
температурные шкалы, не зависящие от свойств термометрического тела, а идеально-газовая температура лишь приближенно совпадает с одной из этих шкал.
1.6. ЦИКЛЫ ПОРШНЕВЫХ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО СГОРАНИЯ
В зависимости от процесса, в котором подводится теплота, поршневые двигатели внутреннего сгорания (ДВС) делятся на несколько типов. ДВС карбюраторного типа работают на бензине, подвод теплоты в них осуществляется в изохорном процессе v = const. Дизельные ДВС работают на тяжелых топливах, теплота в них подводится в изобарном процессе р = const. Конструктивно оба типа ДВС близки друг к другу (рис. 42).
Вспомним последовательность процессов в цилиндре ДВС:
1.Всасывание: поршень 3 из верхнего положения идет вниз, через открытый клапан 1 топливная смесь (воздух в дизельном ДВС), поступает в цилиндр.
2.Сжатие: поршень 3 движется вверх, оба клапана 1 и 2 закрыты, топливная смесь (воздух в дизельном ДВС) сжимается, одновременно повышается температура в цилиндре. В дизельном ДВС в конце сжатия в цилиндр специальным насосом подается порция топлива.
3.Расширение (рабочий ход): оба клапана 1 и 2 закрыты, за счет электрической искры в карбюраторном ДВС (или под воздействием высокой температуры в ДВС дизельном) топливо воспламеняется и сгорает. Продукты сгорания, расширяясь, перемещают поршень 3 вниз. При этом совершается работа, которая может быть использована почти целиком.
4.Выхлоп: клапан 2 открывается (клапан 1 закрыт), поршень 3 идет вверх и выталкивает продукты сгорания.
Далее процессы в цилиндре повторяются.
