
tot_book
.pdf11
в первую очередь так называемые термические параметры: объем, давление и температуру.
Объем V характеризует пространство, занимаемое термодинамической системой. Он тесно связан с параметрами энергетического взаимодействия. В Международной системе единиц (СИ) объем измеряется в кубических метрах (м3). Часто вместо полного объема V используют объем единицы массы вещества m:
V |
|
м3 |
(1.1) |
v = m |
, |
кг , |
где m — масса вещества, заполняющего объем V, кг.
Величину v называют удельным объемом (далее величины, относящиеся к термодинамической системе в целом, будем обозначать прописными буквами, а удельные (по массе) величины — строчными). Удельный объем v не зависит от количества вещества и связан только с термодинамическим состоянием системы. Удельный объем v — величина, обратная
плотности вещества ρ:
v = |
1 . |
(1.2) |
|
ρ |
|
Ясно, что формула (1.1) справедлива для любой термодинамической системы, поскольку вещество (рабочее тело) всегда имеет некоторую массу m и занимает объем V. Соотношение (1.2) носит более узкий характер: плотность вещества в различных точках системы может быть различной (например, плотность жидкого бензина в нижней части топливного бака резко отличается от плотности паров, заполняющих верхнюю часть бака). Поэтому о плотности ρ говорят только применительно к однородным системам, во всех частях которых свойства одинаковы.
Давление р характеризует силовое (механическое) взаимодействие элементов системы друг с другом и с окружающей средой. Давление определяется силой F, приходящейся на единицу поверхности тела f, и измеряется в паскалях (Па):
12
p = Ff .
Кроме паскалей (1 Па = 1 Н/м2) в технике широко используют атмосферы: 1 ат = 1 кгс/см2. Различают абсолютное давление ра, имеющее обозначение эта, и избыточное ре, измеряемое в ати. Связь между этими давлениями простая:
pa = pe + B,
где В — барометрическое давление окружающей среды.
Шкалы технических манометров градуируют именно в единицах избыточного давления ре, что важно помнить при расчетах!
Эти и другие единицы измерения давления сведены в табл. 1.
Таблица 1
Соотношение между единицами давления
Единицы |
|
|
|
|
|
|
|
|
мм |
|
мм |
|
PSI |
измерения |
Па |
|
бар |
|
кгc/см |
2 |
|
|
|||||
давления |
|
|
|
|
рт.ст. |
вод.ст. (lbf/in2) |
|||||||
1 Па |
1 |
|
10–5 |
|
|
|
–5 |
|
–3 |
0,102 |
|
1,45·10–4 |
|
|
|
|
|
|
1,02 10 |
|
|
7,5 10 |
|
|
|
|
|
1 бар |
105 |
|
1 |
|
1,02 |
|
|
|
2 |
|
4 |
14,5 |
|
|
|
|
|
|
|
|
|
|
7,5 10 |
0,102 10 |
|
||
1 кгc/см2 |
|
4 |
0,981 |
|
1 |
|
|
735,6 |
104 |
|
14,223 |
||
|
9,81 10 |
|
|
|
|
|
|
|
|
|
|
|
|
1 мм рт.ст. |
133,3 |
|
|
–3 |
|
|
3 |
1 |
|
13,6 |
|
1,93·10–2 |
|
|
|
|
1,33 10 |
|
1,36 10 |
|
|
|
|
|
|
||
1 мм вод.ст. |
9,81 |
|
|
–5 |
10 |
–4 |
|
|
7,356 10–2 |
1 |
|
1,42·10–3 |
|
|
|
|
9,81 10 |
|
|
|
|
|
|
|
|
|
|
1 PSI (bf/in2) |
6,89·103 |
6,89·10–2 |
7,03·10–2 |
52,2 |
|
7,03·102 |
1 |
||||||
Наиболее физически сложным является понятие температуры Т. В молекулярной и статистической физике температуру считают мерой кинетической энергии молекул или иных микрочастиц. Поскольку термодинамика не связана со структурными понятиями, такое представление для нее неприемлемо. Если два тела привести в соприкосновение, то они могут (хотя и не обязательно)
13
обмениваться энергией. Если первое тело будет отдавать энергию, то принято считать, что оно обладает большей температурой, чем второе, и наоборот. Если же энергообмена нет, то считают, что тела имеют одинаковую температуру. Таким образом, температуру в.
термодинамике считают мерой нагретости тела.
Как же измеряют температуру? Приборов, которые измеряли бы ее непосредственно, не существует. Действие любого термометра основано на том, что с изменением температуры тела изменяются его длина, объем, электрическое сопротивление, работа выхода электронов и т. д. Используется множество типов таких приборов, например, жидкостные и газовые термометры, термометры сопротивления и т. д.
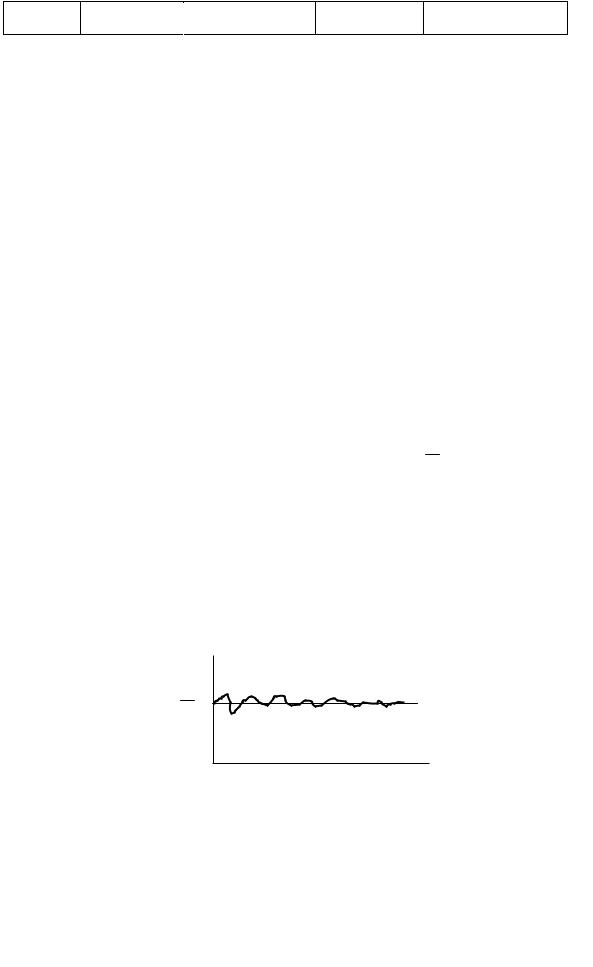
В системе СИ за основу принята шкала Кельвина, в которой началом отсчета служит так называемый абсолютный нуль температур, а точка таяния льда находится на уровне Т = 273,15 К (1 К (кельвин) — единица температуры в этой шкале). Широко распространена также стоградусная шкала Цельсия с единицей 1 °С (совпадающей по величине с 1 К), в которой 0 °С = 273,15 К, а точка кипения воды при атмосферном давлении соответствует температуре + 100 °С = 373,15 К. Далее абсолютную температуру будем обозначать буквой Т, а температуру по стоградусной шкале Цельсия — t. Данные о некоторых других температурных шкалах представлены в табл. 2.
Таблица 2
Соотношение между шкалами температур
Наимен |
Цельсия |
Ренкина |
Фаренгейта |
Реомюра |
ование |
t °С |
t, °Ra |
t, °F |
t, °R |
шкалы |
|
|
|
|
Цельсия |
— |
5/9 t°Ra–273,15 (t °F-32)/l,8 |
1,25 t, °R |
|
Ренкина 1,8(t°С+273,1 |
— |
t °F + 459,67 1,8 |
(1,25 t °R + |
|
|
5) |
|
273,15) |
|
Фаренгей |
1,8 t °С + 32 |
t°Ra+459,67 |
— |
9/4 t °R |
та |
|
|
|
|
Реомюра |
0,8 t °С |
0,8 (5/9 t °Ra |
- 4/9 (t °F -32) |
— |
14
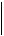 273,15)
273,15)
1.2.2. Термодинамическое равновесие и равновесный термодинамический процесс
Если в различных частях термодинамической системы термические параметры состояния неодинаковы, то состояние такой системы называют неравновесным. В дальнейшем не будем рассматривать эти случаи, предполагая, что во всех точках термодинамической системы параметры состояния выровнялись. Если система, кроме того, находится в равновесии с окружающей средой, то все ее параметры остаются неизменными во времени, взаимодействия в системе прекращаются, а ее состояние называют
равновесным.
В действительности же, с течением времени каждый параметр, например, температура Т, может в небольших пределах
отклоняться от своего среднего значения T (рис. 1). Эти отклонения (флуктуации) весьма малы по сравнению со средним значением и в рамках термодинамического метода не рассматриваются.
T
T
τ
Рис. 1.
Если изменение хотя бы одного параметра заметно превышает уровень флуктуации, говорят о термодинамическом процессе — совокупности последовательных состояний термодинамической системы. Все процессы разделяют на равновесные и
15
неравновесные. Равновесным называют процесс, представляющий собой последовательность равновесных состояний термодинамической системы, т. е. процесс, в каждой “точке” которого система находится в равновесии. Если же при изменении состояния равновесие в системе нарушается, процесс становится неравновесным.
Если, например, твердое тело привести в соприкосновение с другим телом, имеющим более высокую температуру, то первое тело начнет нагреваться. Вначале нагреются лишь поверхностные слои тела, и температура по всему его объему станет неодинаковой, следовательно, тело будет находиться в неравновесном состоянии. По истечении достаточного времени все слои достигнут одинаковой температуры, и система придет к новому равновесному состоянию.
Чем меньше отличаются температуры рассматриваемых тел, тем меньше будет и различие температур отдельных слоев; в пределе, когда разность температур устремится к нулю, теплообмен приблизится к равновесному; он будет идти чрезвычайно (точнее — бесконечно) медленно. Реальные процессы, близкие к равновесным, называют квазистатическими. В термодинамике равновесных состояний и процессов (в равновесной термодинамике) не используют понятие времени, а все процессы считают бесконечно медленными.
Но насколько применимы эти допущения на практике? Рассмотрим сжатие газа в цилиндре с поршнем (рис. 2).
F
n
n
∆
16
Рис. 2.
Будем считать, что поршень притерт настолько тщательно, что протечек газа нет. Если с помощью внешней силы F быстро переместить поршень вниз, то вблизи его дна появится область повышенного давления (таким образом, равновесие нарушится), затем эта область начнет расширяться, а через некоторое время давление повысится и станет одинаковым во всем объеме (будет достигнуто новое равновесие). Здесь та же закономерность, что и в предыдущем примере: вначале состояние неравновесное, а затем постепенно достигается равновесие. Оценим, какое время для этого необходимо. Известно, что фронт повышенного давления n–n перемещается со скоростью звука а, которая для воздуха близка к
300 м/с. Значит, время достижения равновесия τ ≈ ∆ 300 (∆ — высота цилиндра под поршнем).
300 (∆ — высота цилиндра под поршнем).
В реальных двигателях и компрессорах поршень совершает полный ход ∆ за время τ = 10–3…10–2 с. Если принять ∆ = 0,3 м, то
τ =10−4 c < τ. Следовательно, равновесие устанавливается значительно быстрее, чем перемещается поршень, и процесс можно считать квазистатическим.
В термодинамике часто рассматривают процессы, в которых не меняется один из термических параметров: р, v или Т. Особый интерес представляют процессы, в результате которых рабочее тело возвращается в исходное состояние — циклы. Они реализуются в двигателях, холодильных машинах, их используют также для вывода некоторых фундаментальных соотношений термодинамики.
1.2.3. Термическое уравнение состояния.
Термодинамическая поверхность и диаграммы состояний
Состояние термодинамической системы можно определить, задав ее термические параметры р, v и Т. Сколько же параметров необходимо задать, чтобы однозначно определить состояние?
17
Если, например, указать, что рассматривается химическое соединение Н2O при температуре 120 °С, то этого недостаточно для ответа на вопрос, пар это или жидкость: необходимо дополнительно сообщить о давлении или объеме. Так, при давлении р = 0,1 МПа и при температуре t = 120 °С термодинамическая система представляет собой пар, и все его свойства могут быть определены, а при давлении р = 5,0 МПа и t = 120 °С мы имеем дело с жидкостью; ее свойства также могут быть определены.
Более того: при р = 0,2 МПа вещество превратится в смесь жидкости и пара переменного (в зависимости от удельного объема v) состава; речь о таких состояниях пойдет в разделе 1.8.
Установлено, что в однородных термодинамических системах (см. разд. 1.2.1) любые два термических параметра однозначно определяют третий, а вся их совокупность задает состояние термодинамической системы в целом. Поэтому произвольно задавать третий параметр однородной термодинамической системы нельзя. Связь термических параметров выражают формулы
v = f ( p,T ), p = (v,T ), T = ( p,v). |
(1.3) |
Все три равенства (1.3) можно объединить: |
|
F( p,v,T ) = 0. |
(1.4) |
Уравнение (1.4), связывающее между собой термические параметры состояния, называют термическим уравнением состояния. Следует подчеркнуть, что термодинамика
постулирует наличие уравнения состояния, но не определяет его вид. Форма термического уравнения состояния зависит от природы рабочего тела, ее можно определить либо методами статистической физики, либо по опытным данным. Термодинамика исследует уравнение (1.4) как некоторую математическую функцию, не интересуясь ее физическим смыслом. Уравнение (1.4) определяет поверхность в координатах р–v–Т, которую называют
термодинамической поверхностью (рис. 3).
Однако пользоваться трехмерным изображением на практике неудобно, и поэтому обычно используют метод сечений, дающий
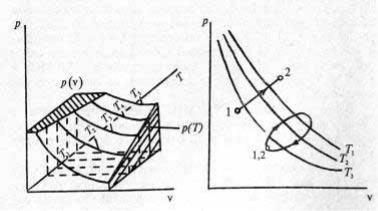
18
семейства кривых на плоскостях р–v, р–Т, и Т–v; такие двумерные системы кривых называют диаграммами состояний.
Рис. 3. Рис. 4.
Два термических параметра, например, р и v, являются осями диаграммы, а третий параметр Т считают фиксированным и проставляют его значение у каждой кривой (рис. 4).
На диаграммах состояний процессы изображают линиями, идущими, например, от точки 1, характеризующей начальное состояние термодинамической системы, до точки 2, соответствующей конечному состоянию. Циклы, естественно, изображают замкнутыми линиями.
Вид уравнений состояния реальных веществ чрезвычайно сложен, и к настоящему времени эти уравнения составлены далеко не для всех из них.
В связи с этим термодинамика широко использует физические модели рабочих тел, для которых уравнение состояния (1.4) выглядит достаточно просто. Исторически первой явилась модель идеального газа. С позиций статистической физики идеальный
газ — совокупность частиц, представляющих собой математические точки (т. е. не имеющих объема), все взаимодействие которых сводится к соударениям (притяжение и отталкивание отсутствуют). Идеальный газ подчиняется
уравнению Клапейрона–Менделеева
pV = m R T; |
(1.5) |
|
µ |
u |
|
19
где m — масса газа в системе; µ — молярная масса газа; Ru — универсальная газовая постоянная.
Чтобы оценить величину Ru, вспомним закон Авогадро: при нормальных условиях (pN = 760 мм рт. ст. = 101325 Па, TN = 0 °С = 273,15 К) 1 кмоль любого газа занимает одинаковый объем VN = 22,4 м3. Из уравнения (1.5) для нормальных условий получим
R |
= p |
N |
V |
N |
/T = 101325 22,4 |
= 8314 |
Дж |
. |
|
|
|||||||||
u |
|
|
N |
273,15 |
|
кмоль К |
|||
|
|
|
|
|
|
|
|||
Уравнение (1.5) формально объединяет три закона, ранее установленных экспериментальным путем: закон Бойля–
Мариотта
pv = const при T = const;
закон Гей-Люссака
v1 |
= |
|
T1 |
при p = const; |
|
|
T |
||||
v |
2 |
|
|
||
|
|
2 |
|
||
закон Шарля
p1 |
= |
T1 |
при v = const. |
|
|
||||
p |
2 |
|
T |
|
|
|
2 |
|
|
Теперь ясно, что в качестве примера на рис. 3 была показана именно термодинамическая поверхность идеального газа: в осях р– v изотермы являются гиперболами, а в осях Т–v и р–Т — прямыми линиями.
Более сложные уравнения состояния рассмотрим в разделе 1.8.1, а пока отметим, что уравнение (1.5) удовлетворительно описывает поведение большинства газов (и их смесей) при не слишком высоких давлениях и не очень низких температурах. В эту область, в частности, входят процессы в двигателях внутреннего сгорания и в газотурбинных установках, поэтому при расчетах силовых установок транспортных систем представления об идеальном газе имеют большую практическую ценность.
1.2.4. Смеси идеальных газов
20
Нередко рабочим телом является смесь газов (например, воздух), каждый из которых можно считать идеальным; такая смесь также является идеальным газом и подчиняется уравнению
Клапейрона-Менделеева для смеси
|
|
|
p |
|
V |
= mmix R T |
= m |
R |
T , |
(1.6) |
||
|
|
|
|
mix mix |
µmix |
u mix |
mix |
mix |
mix |
|
||
где |
R |
= |
Ru |
|
— газовая постоянная смеси (индекс “mix” везде |
|||||||
µmix |
||||||||||||
|
mix |
|
|
|
|
|
|
|
|
|||
относится к параметрам газовой смеси, образован от англ.
mixture — смесь), a µmix — кажущаяся молярная масса |
смеси. |
Масса смеси равна сумме масс всех компонентов: |
|
n |
|
mmix = ∑mi . |
(1.7) |
i=1 |
|
Здесь mi — масса i-го компонента; n — число компонентов в смеси. Величину pmix определяет закон Дальтона:
n |
|
pmix = ∑ pi , |
(1.8) |
i=1
где pi — парциальное давление i-го компонента, т. е. давление, которое имел бы i-й компонент, если бы он один занимал весь объем смеси при той же температуре.
Поскольку модель идеального газа пренебрегает размерами микрочастиц, объем, занимаемый каждым компонентом, равен объему всей смеси:
Vi =Vmix.
Для определения величины µmix зададим состав смеси массовыми долями компонентов:
g = |
m1 |
, g |
2 |
= |
m2 |
,..., g |
n |
= |
mn |
. |
|
|
|
||||||||
1 |
mmix |
|
|
mmix |
|
|
mmix |
|||
|
|
|
|
|
|
|
||||
n
Как следует из уравнения (1.7), ∑gi =1.
i=1
Для каждого компонента можно использовать уравнение Клапейрона-Менделеева:
