
tot_book
.pdf51
1 |
2 |
|
v2 |
pdv; |
|
|
∫ |
(1.69) |
|||
l − |
|
= |
v1 |
||
|
|
|
|
|
а общая работа, подводимая к газу в компрессоре,
l |
|
= l |
|
− |
+l |
|
− |
|
+l − |
= p v |
− p |
|
v |
|
+ |
v2 |
pdv. |
(1.70) |
|
ст |
a |
2 |
b |
2 |
2 |
∫ |
|||||||||||||
|
|
1 |
|
|
1 2 |
1 1 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v1 |
|
|
Возьмем интеграл в правой части равенства (1.70) по частям:
v2 |
|
p2 |
|
∫ |
pdv = p2v2 |
− p1v1 − |
∫vdp, |
v1 |
|
|
p1 |
откуда
p2
lст = − ∫vdp.
p1
Изобразим работу la−1, l2−b , l1−2 причем, поскольку la−1 > 0, a
соответствующие площадки
(1.71)
p–v-диаграмме (см. рис. 20), заштрихуем Поскольку
|
la−1 |
|
= пл.0a1c, |
|
l1−2 |
|
= пл.d 21c, |
|
l2−b |
|
= пл.d 2b0, |
то |
площадь, |
|
|
|
|
|
|
покрытая двойной штриховкой, из расчета исключается, следовательно, lст = пл.a12b, что совпадает с интегралом (1.71).
Выражение (1.71) уже рассматривалось; оно входило, в частности, в уравнение первого начала (1.31). Такую функцию, которая учитывает не только работу основного процесса, но и энергетический вклад впуска и выпуска рабочего тела, называют
технической (или располагаемой) работой.
В диаграмме р–v она эквивалентна площадке, опирающейся на ось ординат: lст = пл.a12b.
Остается выяснить, какой характер имеет процесс сжатия 1–2. Он может идти при различных условиях: при отсутствии теплообмена (адиабатное сжатие) и при интенсивном охлаждении цилиндра компрессора, из-за чего температура сжимаемого газа не изменяется

52
Рис. 21.
(изотермическое сжатие) (рис. 21). Работа, затраченная на привод компрессора при адиабатном сжатии, lстq = пл.a12b , а при
изотермическом |
′ |
> lстT , работа, |
lстT = пл.a12 b . Поскольку lстq |
затраченная на изотермическое сжатие, меньше работы на сжатие адиабатное на величину, эквивалентную площади пл.122'.
Добиться изотермического сжатия обычно не удается, поскольку цилиндр охлаждается недостаточно. Реальный процесс идет по кривой 1–2" и носит политропный характер:
p vn = pvn ; |
|
|
p |
1 n |
v = v |
1 |
. |
||
|
||||
1 1 |
1 |
|
p |
|
|
|
|
|
|
После подстановки v в уравнение (1.71) и интегрирования получим
|
|
|
RT1 |
|
|
|
|
p2 |
|
(n−1) n |
|
|
|
|
|
|
|
|
|
|
|
||||
l |
|
′′ = |
|
− |
|
|
, |
(1.72) |
||||
|
|
|
||||||||||
n1−2 |
n −1 |
1 |
|
p |
|
|
||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
что в n раз превышает работу политропного сжатия, рассчитанную по формуле (1.64).
53
Рис. 22.
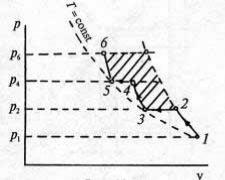
Итак, термодинамический анализ показал, что наиболее эффективным будет изотермическое сжатие, но осуществить его в одном цилиндре не удается, поскольку время процесса и поверхность теплоотвода оказываются недостаточными. Чтобы приблизить процесс к изотермическому, его проводят в несколько стадий и в различных цилиндрах, между которыми устанавливают промежуточные теплообменники (холодильники) (рис. 22).
Рис. 23.
Вместо одноступенчатого сжатия от точки 1 до точки 2' по политропе n = const (рис. 23) газ сжимают до некоторого промежуточного давления р2 (при том же показателе политропы) в процессе 1–2, а затем изобарно охлаждают до первоначальной температуры (процесс 2–3) и подают во вторую ступень, где опять сжимают по политропе до давления р3 = р2, снова охлаждают и т. д. Выигрыш в работе привода для многоступенчатого компрессора по сравнению с одноступенчатым эквивалентен заштрихованной на рис. 23 площадке. Чем больше число ступеней сжатия, тем ближе процесс к изотермическому. На практике применяют до четырех ступеней сжатия, дальнейшее увеличение числа ступеней неоправданно усложняет компрессор.
1.5.ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
1.5.1.Обратимые и необратимые процессы
54
Ранее мы называли процесс равновесным, если равновесными были все состояния, через которые проходит рабочее тело. Требовали, чтобы такой процесс шел весьма медленно — по крайней мере, настолько, чтобы успевали выравниваться параметры состояния термодинамической системы. Посмотрим теперь на термодинамические процессы с другой стороны.
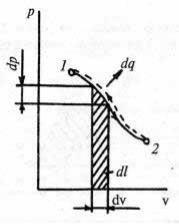
Пусть процесс 1–2 протекает так, что на каждом его элементарном участке, где термические параметры v и р изменяются на dv и dp соответственно, совершается некоторая работа dl и подводится (или отводится) теплота dq (рис. 24).
Рис. 24.
Если на каждом бесконечно малом участке обратного процесса (от точки 2 к точке 7) подводить к термодинамической
системе ту же теплоту, которая отводилась прежде, и компенсировать работу, которая совершалась на этом участке в прямом процессе 1–2, то это далеко не всегда позволит вернуть термодинамическую систему в исходное состояние 1.
Если после прямого и обратного процессов термодинамическая система возвращается в исходное состояние и при этом не происходит энергетических изменений в окружающей среде (т. е. сумма теплоты и работы прямого процесса равна по величине и противоположна по знаку сумме теплоты и работы обратного процесса), то процессы 1–2 и 2–1 называют обратимыми. Если же для возвращения термодинамической системы в исходную точку требуются дополнительные затраты энергии извне, процессы называют необратимыми.
55
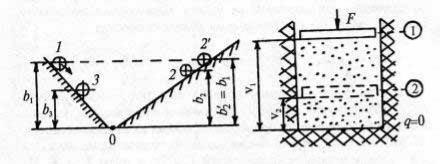
Рис. 25. Рис. 26.
Примером необратимого процесса может служить перемещение шарика по конструкции из двух наклонных плоскостей (рис. 25). При движении шарика под действием силы тяжести из точки 1 (с высоты b1) его потенциальная энергия полностью переходит в кинетическую в точке 0, а затем, по мере движения к точке 2', вновь превращается в потенциальную. Если бы силы трения шарика о плоскости равнялись нулю, а сопротивление воздуха отсутствовало, то он поднялся бы вновь на высоту b2 = b1 (положение 2'), затем процесс повторился бы, и шарик снова вернулся в исходное состояние без дополнительных затрат энергии. В реальных условиях из-за трения и сопротивления воздуха шарик достигает точки 2 (b2 < b1), а при обратном движении — лишь точки 3 (b3 < b1,); для возвращения в точку 1 потребовалась бы дополнительная работа извне. Процесс, как видим, необратим.
Рассмотрим второй пример. В цилиндре с теплоизолированными (адиабатными) стенками под поршнем находится газ (рис. 26). В начальный момент газ занимает объем v1, а его давление равно давлению окружающей среды р. Под действием силы F поршень из положения 1 перемещается в положение 2, а газ сжимается до объема v2. Затем силу F “убирают”, и поршень возвращается в положение 1. Обратимы ли процессы в цилиндре? Оценим работу сжатия l1–2 и расширения l2–1 газа под поршнем. При сжатии
56
v2 |
v2 |
v2 |
|
l1−2 = ∫( p |
+ ∆p1−2 )dv = ∫ pdv − ∫∆p1−2dv, |
|
|
v1 |
v1 |
v1 |
|
где ∆p1−2 — добавочное давление, вызванное действием силы F. |
|||
При расширении |
|
|
|
v |
v |
v1 |
|
l2−1 = ∫1( p − ∆p2−1)dv = ∫1 pdv − ∫∆p2−1dv |
|
||
v2 |
v2 |
v2 |
|
(смысл величины ∆p2−1 очевиден). Суммарная работа |
|
||
|
v2 |
|
|
l1−2−1 = l1−2 +l2−1 = ∫(∆p1−2 + ∆p2−1)dv ≠ 0. |
|
||
|
v1 |
|
|
Кроме того, |
∆p1−2 > 0, |
∆p2−1 > 0, dv < 0 |
(поскольку |
интегрирование идет от большего объема v1, к меньшему v2), поэтому l1−2−1 < 0, при сжатии тратится больше работы, чем возвращается при расширении. Термодинамическая система вернется в начальное состояние только при добавлении энергии, следовательно, процесс 1–2 является необратимым.
Если процессы 1–2 и 2–1 идут с конечными скоростями, то давление под поршнем не успеет выровняться по объему газа (см. разд. 1.2.2). При весьма малых скоростях
v2 |
|
|
∆p1−2 → dp1; ∆p2−1 → dp2; l1−2−1 = ∫ |
(dp1 |
+ dp2 )dv |
v1 |
|
|
с точностью до величины второго порядка малости работа l1−2−1 равна нулю, процесс становится обратимым. Значит, в основе необратимости процессов заложена их неравновесность.
Можно рассмотреть также задачу о теплообмене двух тел 1 и 2 с различными температурами Т1 и Т2, причем Т1 > Т2. Из опыта известно, что теплота будет передаваться только в одном направлении — от тела 1 к телу 2, такой процесс необратим. Но если Т1 = Т2 + dT, то процесс передачи теплоты пойдет бесконечно медленно и в пределе станет обратимым.
57
Отметим, что необратимость всегда приводит к потерям энергии, но, с другой стороны, без необратимости (точнее, без неравновесности начального состояния) термодинамическая система вообще не сможет участвовать в передаче теплоты или в совершении работы — работоспособность равновесной системы равна нулю.
Изложенного достаточно, чтобы сформулировать второе начало термодинамики, однако для удобства дальнейших рассуждений введем еще некоторые понятия, связанные с круговыми процессами, или циклами.
1.5.2.Циклы и их КПД
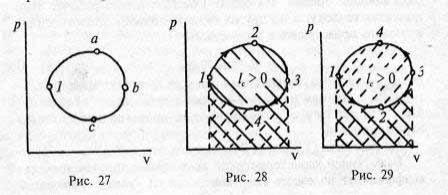
Вразделе 1.2.2 мы назвали циклом процесс, в результате которого рабочее тело возвращается в исходное состояние 1 (рис. 27).
По направленности процессов (т. е. идет цикл по кривой labсl или совершается в противоположном направлении, по кривой 1cba1) все циклы делят на прямые и обратные.
Впрямом цикле (рис. 28) линия расширения 1–2–3 находится выше линии сжатия 3–4–1, при этом работа цикла lc > 0, (индекс с соответствует англ. cycle), а сам цикл в рабочей диаграмме совершается по часовой стрелке.
Рис. 27. Рис. 28. Рис. 29.
58
Впроцессе расширения работа положительна, т. е. dv > 0; она численно равна площади под кривой 1–2–3 и показана на рис. 28 сплошной штриховкой. При сжатии dv < 0, работа отрицательна; прерывистая штриховка под кривой 3–4–1 покрывает площадку, эквивалентную затрате работы на сжатие. Суммарной работе (работе цикла lc) соответствует площадка, ограниченная кривой 1– 2–3–4; в прямом цикле lc > 0. Прямые циклы реализуются в тепловых двигателях (иногда их называют циклами двигателей,
или энергетическими).
Вобратных циклах (рис. 29) линия сжатия находится выше линии расширения, работа обратного цикла отрицательна, lc < 0 (т. е. для реализации цикла необходимо подводить энергию извне). Обратные циклы носят еще название холодильных, поскольку реализуются в холодильных машинах.
Для любого цикла первое начало термодинамики можно представить в виде
∫dq = ∫de + ∫dl,
причем интегрирование идет по контуру цикла. Согласно уравнению (1.29), ∫de =0, поэтому
∫dq = ∫dl, qc = lc , |
(1.73) |
где qc = ∫dq, lc = ∫dl — теплота и работа в цикле. Следовательно, суммарная теплота, полученная рабочим
телом за цикл, равна работе, совершенной рабочим телом над окружающей средой. На одних участках цикла рабочее тело получает теплоту, а на других отдает, поэтому теплоту цикла qc можно представить в виде суммы
(1.74)
где q1 — теплота, полученная на всех участках цикла; q2 — теплота, отданная на всех участках цикла. Знак (–) показывает, что теплота q2 отводится, т. е. является для системы отрицательной.
Из равенств (1.73) и (1.74) следует, что lc = q1 − q2.
59
Важнейшей характеристикой всех прямых циклов является
коэффициент полезного действия (КПД) η, характеризующий эффективность преобразования подведенной теплоты в работу:
η = |
lc |
= |
q1 −q2 |
=1− |
q2 |
. |
(1.75) |
q1 |
q1 |
|
|||||
|
|
|
q1 |
|
|||
Формула (1.75) может применяться при анализе как обратимых циклов (полностью состоящих из обратимых процессов), так и циклов необратимых. КПД обратимого цикла называется термическим и обозначается ηt, (от англ. thermal).
1.5.3. Формулировки второго начала
Первое начало позволяет установить количественные соотношения между работой, теплотой и внутренней энергией термодинамической системы, однако оно не указывает на качественное различие процессов передачи теплоты и совершения работы и не определяет направления самопроизвольных термодинамических процессов. На эти вопросы дает ответ второе начало термодинамики.
Второе начало, как и первое, является обобщением человеческого опыта: критерием достоверности обоих начал является отсутствие каких-либо процессов, в которых бы они нарушались.
Никаких иных доказательств первого и второго начал быть не может. Это — постулаты, на которых строится вся термодинамика.
Единой общепринятой формулировки второго начала до настоящего времени не существует, хотя попытки создать ее весьма многочисленны. Однако всегда можно показать, что при выполнении постулата, указанного в одной из формулировок, выполняется постулат из любой другой формулировки.
Р. Клаузиус утверждал, что невозможен самопроизвольный переход теплоты от менее нагретого тела к более нагретому. Это утверждение соответствует человеческому опыту и не противоречит представлению о том, что все реальные процессы
60
необратимы: мы видели, в частности, что процесс передачи теплоты при конечной разности температур необратим.
Иначе сформулировал второе начало М. Планк. Чтобы лучше понять его мысль, вспомним, что под окружающей средой мы договорились понимать все объекты материального мира, окружающие термодинамическую систему (см. разд. 1.1.). Однако при этом не требовалось, чтобы среда окружала систему “со всех сторон” или имела одинаковую во всех своих частях температуру. Если, например, в жаркий день автомобиль переезжает через ручей, то колеса машины соприкасаются с холодной водой, а прочие части — с теплым воздухом. Автомобиль вполне можно считать термодинамической системой, а воду и воздух — окружающей средой. Налицо даже две среды: одна из них холоднее, чем термодинамическая система, другая — горячее. Назовем холодной средой все объекты материального мира, соприкасающиеся с термодинамической системой, если их температура ниже, чем температура системы. Горячая среда, естественно, должна иметь температуру более высокую, чем температура термодинамической системы.
М. Планк утверждал, что невозможно создать периодически работающую машину, все действия которой сводились бы к поднятию груза (т. е. к совершению работы) и к охлаждению одной только горячей среды. Эта формулировка очень важна, так как она по существу утверждает, что в цикле нельзя полностью преобразовать теплоту в работу: в любом цикле кроме участков, на которых теплота подводится, должны быть участки, где она отводится. Таким образом, в формуле (1.74) второе слагаемое справа не равно нулю (q2 ≠ 0), и КПД любого цикла
η =1−q2  q1 <1.
q1 <1.
Второе начало устанавливает качественное различие между теплотой и работой. Действительно, работу можно полностью превратить в теплоту (например, посредством трения), а теплоту, полученную от горячей среды, полностью в работу превратить нельзя, некоторую ее часть необходимо передать холодной среде.
