
tot_book
.pdf
21
p1Vmix = (m1  µ1 )RuTmix ;
µ1 )RuTmix ;
......................................
......................................
pnVmix = (mn  µn )RuTmix.
µn )RuTmix.
Сложим левые и правые части этих уравнений, получим
n |
|
|
|
m2 |
|
|
|
|
n |
mi |
|
||
|
m1 |
|
|
mn |
|
|
|||||||
Vmix ∑ pi = RuTmix |
|
+ |
|
|
+... + |
|
|
|
= RuTmix ∑ |
|
|
. |
|
µ |
µ |
|
µ |
|
µ |
|
|||||||
i=1 |
|
1 |
|
|
2 |
|
|
n |
i=1 |
|
i |
|
|
откуда на основании закона Дальтона (1.8)
n |
m |
|
|
pmixVmix = RuTmix ∑ |
i |
. |
(1.9) |
|
|||
i=1 |
µi |
|
|
Левые части уравнений (1.6) и (1.9) одинаковы, поэтому должны быть одинаковы и правые. После необходимых сокращений разделим обе части уравнения (1.9) на mmix, получим:
µmix = |
1 |
|
, |
(1.10) |
n |
|
|||
|
∑gi |
µi . |
|
|
|
i=1 |
|
|
|
|
n |
|
|
|
Rmix = Ru ∑gi |
µi . |
(1.11) |
||
i=1
Таким образом, при заданном составе смесь рассматривают как обычный идеальный газ, кажущаяся молярная масса которого определяется формулой (1.10), а газовая постоянная — формулой
(1.11).
1.2.5. Энергия, работа, теплота
Фундаментальное для многих областей науки понятие энергии тесно связано с представлением о движущейся материи и до настоящего времени не имеет общепринятого определения. Можно рассматривать энергию как объективную меру всякого движения материи в любых ее формах, но такой подход мало, что дает для термодинамического анализа.

22
Для замкнутых систем, изучаемых термодинамикой, важно выделить энергию термодинамической системы в целом (кинетическую и потенциальную), которую принято называть внешней энергией; все другие виды энергии, связанные с движением микрочастиц, назовем внутренней энергией системы.
Часто система неподвижна и не меняет своей потенциальной энергии, в этом случае внутренняя энергия приобретает особое значение и полностью характеризует энергетическое состояние системы. Внутреннюю энергию системы обозначим через Е, а
удельную внутреннюю энергию (отнесенную к массе системы m) — через e = mE . В системе единиц СИ внутреннюю энергию
измеряют в джоулях (Дж), а удельную внутреннюю энергию — в джоулях на килограмм (Дж/кг).
Существуют два вида взаимодействия термодинамических систем друг с другом или с окружающей средой: путем
совершения работы и путем передачи теплоты.
Если одна система воздействует на другую и при этом происходит передача энергии, связанная с некоторым
макроскопически упорядоченным процессом, то говорят, что первая система совершает над второй работу. Пусть, например, к газу, заключенному в цилиндре под поршнем, извне приложена сила (см. рис. 2). При этом происходит сжатие газа, объем его уменьшается, т.е. идет макроскопически упорядоченный процесс, внешняя среда совершает работу над термодинамической системой.
Если же взаимодействие не приводит к макроскопически упорядоченному процессу, т. е. работа не совершается, то говорят о передаче теплоты. Например, при взаимодействии нагретого тела с газом, замкнутым в жесткую оболочку, произойдет нагрев газа, т. е. увеличатся среднеквадратичные скорости движения его молекул, возрастут температура и давление. Эти процессы протекают на микроскопическом уровне, происходит обмен энергией посредством передачи теплоты, а макроскопического, заметного глазу перемещения не наблюдается. Если же, например, нагревать

23
воздушный шарик, то оболочка заметно растянется: будет совершена работа, и произойдет передача теплоты.
Подчеркнем, что теплота и работа появляются только в процессах взаимодействия термодинамических систем. Нельзя говорить, что сами системы обладают определенным запасом теплоты или работы. Термодинамическая система обладает запасом энергии, а сколько теплоты будет передано другой системе при взаимодействии и какую работу первая система при этом совершит, будет зависеть от того, как пойдет процесс взаимодействия. Отсюда следует важный вывод: работа и теплота являются функциями процесса. Энергия же зависит только от того, в каком состоянии находится термодинамическая система (например, каковы ее давление и температура); значит, энергия — функция состояния.
В технической термодинамике работа L, совершаемая всей системой, измеряется, как и энергия, в джоулях (Дж). Удобнее рассматривать удельную работу т. е. работу, совершаемую
единицей массы рабочего тела: l = mL , Джкг .
Работу термодинамической системы будем считать положительной (l > 0), если она совершается над другой системой или над окружающей средой. Если окружающая среда или другая термодинамическая система совершают работу над “нашей” системой, то работа отрицательна (l < 0).
Теплоту Q, отданную или полученную термодинамической системой, также измеряют в джоулях. Удельная теплота —
теплота, приходящаяся на единицу массы: q = Qm , Джкг .
Если термодинамическая система получает теплоту извне, то q > 0, и наоборот, если система отдает теплоту другой системе или окружающей среде, то q < 0.
Как было показано, оба вида взаимодействия — совершение работы и передача теплоты — могут идти одновременно; в реальных процессах именно так и происходит. Однако часто считают, что в некоторых процессах все взаимодействие термодинамической системы с другими системами и с окружающей
24
средой сводится только к совершению работы, а отдаваемая или воспринимаемая системой теплота равна нулю. Такую термодинамическую систему называют адиабатической, а процессы, протекающие в ней — адиабатными. Термодинамическую систему, которая не может обмениваться с окружающей средой ни теплотой, ни работой, называют
изолированной.
1.2.6.Теплоемкость
Вклассической механике хорошо известно, как измерить работу, измерение же теплоты представляет некоторую трудность хотя бы потому, что связано с особенностями рабочего тела.
Для расчета теплоты в термодинамических процессах еще в XVIII веке использовали понятие “теплоемкость”. Из самого слова ясно, что появилось оно в эпоху, когда теплоту считали особой жидкостью: тело может иметь некоторое ее количество и тогда “обладает” запасом теплоты и т. д. Название “теплоемкость” сохранилось в силу традиции, и никто, разумеется, не понимает его буквально.
Под истинной полной теплоемкостью вещества (рабочего тела) понимают отношение количества теплоты dQ, полученного веществом при бесконечно малом изменении его состояния в каком-либо процессе, к изменению температуры dT этого вещества. Как отмечалось, теплота зависит от процесса, значит, от процесса должна зависеть и теплоемкость.
Допустим для определенности, что некоторый параметр системы х (например, р или v) в процессе не меняется, тогда
истинная полная теплоемкость
Cx = dQ |
|
|
= |
dQx |
, |
Дж |
. |
(1.12) |
|
||||||||
|
|
|
|
|||||
dT |
|
x=const |
|
dT |
К |
|
||
|
|
|
|
|
||||
Еще раз отметим, что уравнение (1.12) определяет теплоемкость Сх как функцию процесса, поскольку подвод теплоты возможен только в термодинамическом процессе. Однако

25
производная — всегда предел, поэтому при заданном условии х = const теплоемкость приближенно можно считать функцией состояния (в окрестностях точки на термодинамической поверхности, где температура меняется на dT).
Пользоваться полной теплоемкостью в расчетах не очень удобно, поскольку не ясно, к системе какой массы относится эта величина. Удобнее использовать удельную теплоемкость, т. е. теплоемкость единицы массы, объема и т. д. Наиболее распространены:
удельная массовая теплоемкость
cx = |
Cx |
= |
dq |
|
|
|
= |
dqx |
, |
Дж |
; |
(1.13) |
|
|
|
|
|||||||||||
|
|
|
|
||||||||||
|
m dT |
|
x=const |
|
dT |
кг К |
|
|
|||||
|
|
|
|
|
|
|
|||||||
удельная мольная теплоемкость
cxµ = |
Cx |
, |
Дж |
, |
|
кмоль К |
|||
|
M |
|
||
где M = mµ — число молей вещества в термодинамической системе
массой m (легко заметить, что cxµ = CMx = Cmx µ = cxµ).
Удельные массовые и мольные теплоемкости, характерные для ряда процессов, например, для процессов р = const и v = const, определяют экспериментально или на основании теоретических расчетов и задают в форме таблиц и графиков как функции температур. По таким таблицам можно рассчитать теплоту, если известны значения температуры Т1 и Т2 в начале и в конце процесса
х = const:
T2 |
|
qx = ∫cxdT. |
(1.14) |
T1 |
|
Расчет qx, связанный с интегрированием правой части равенства (1.14), заметно упрощается, если известно среднее значение cxm (от англ. middle — средний) в интервале температур от Т1 до Т2. В этом случае на основании теоремы о среднем

26
T |
|
||
qx = ∫2cxdT = cxm |
|
TT2 (T2 −T1), |
(1.15) |
|
|||
1 |
|
||
T1 |
|
||
где cxm T2 — средняя теплоемкость в интервале температур от Т1 до
T1
Т2.
Однако построение таблиц, в которых произвольными являются оба предела интегрирования, нерационально, удобнее полагать одну из температур фиксированной. Чтобы составить такие таблицы, выражение (1.15) необходимо преобразовать, введя в него температуру по стоградусной шкале Цельсия t = Т–273,15 К, а затем представить интеграл (1.15) в виде
|
|
t2 |
|
|
|
t2 |
|
|
|
t1 |
|
qx = ∫cxdt = |
∫cxdt − ∫cxdt. |
|
|||||||||
|
|
t1 |
|
|
|
0 |
|
0 |
|
||
Далее вновь применим теорему о среднем и получим |
|
||||||||||
q |
x |
= c |
xm |
|
t2 t |
|
−c |
xm |
|
t1 t . |
(1.16) |
|
|
|
|||||||||
|
|
|
0 |
2 |
|
|
0 1 |
|
|||
|
|
|
|
|
|
||||||
Величина cxm t0 т. е. среднее значение теплоемкости
от 0 °С до t °С, приводится в таблицах для процессов р = const
и v = const и обозначается соответственно c |
pm |
|
t |
и c |
vm |
|
t |
. При |
|
|
|||||||
|
|
0 |
|
|
0 |
|
||
|
|
|
|
|
необходимости, пользуясь выражениями (1.15) и (1.10), можно вычислить
|
tt2 = |
c |
xm |
|
t2 t |
|
−c |
xm |
|
t1 t |
|
|||
|
|
|
|
|
||||||||||
cxm |
|
|
0 |
|
2 |
|
|
0 |
1 |
. |
(1.17) |
|||
|
|
|
|
|
||||||||||
|
|
|
|
t2 |
−t1 |
|
||||||||
|
1 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
Теперь оценим теплоемкость газовой смеси. Отметим, прежде всего, что температура всех компонентов смеси одинакова: если в начале процесса х = const она составляла t1 , то к концу его примет значение t2. Кроме того, количество теплоты, подведенное к смеси,
Qx mix = m1qx |
+ m2qx |
2 |
+... + mnqx |
, |
(1.17) |
1 |
|
n |
|
|
27
где m1,m2 ,...,mn — массы компонентов смеси; qx1 ,qx2 ,...,qxn —
теплота, подводимая к единице массы каждого компонента в процессе х = const. Применяя выражение (1.17), получим
n |
|
n |
|
|
|
Qx mix = t2 ∑cxim |
|
t02 mi −t1∑cxim |
|
t01 mi , |
(1.18) |
|
|
||||
|
|
||||
i=1 |
|
i=1 |
|
|
|
где cxim — теплоемкость cxm для i-го компонента смеси.
С другой стороны, суммарная теплота, подведенная к смеси,
Qx mix = qx mixmmix .
Разделив обе части уравнения (1.18) на суммарную массу смеси mmix, получим
n |
|
n |
|
|
|
qx mix = t2 ∑cxim |
|
t02 gi −t1∑cxim |
|
t01 gi . |
(1.19) |
|
|
||||
|
|
||||
i=1 |
|
i=1 |
|
|
|
Суммы, входящие в формулу (1.19), представляют средние теплоемкости смеси в интервале температур от 0 °С до t1 и от 0 °С до t2, соответственно, поэтому средняя теплоемкость смеси в интервале температур от 0 °С до t
|
t |
n |
|
t |
|
|
cx m mix |
= ∑cxim |
|
gi |
(1.20) |
||
|
||||||
|
0 |
i=1 |
|
0 |
|
|
|
|
|
|
|
|
Отметим в заключение, что теплоемкость мы пока рассматриваем как величину, полученную в ходе эксперимента или расчета. Если она задана, то можно рассчитать количество теплоты в процессе, но большего мы сделать не можем. С этой точки зрения понятие теплоемкости носит вспомогательный характер: его используют в расчетах, но не могут с его помощью объяснить характер механических и тепловых взаимодействий в термодинамической системе.
1.3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Первым началом термодинамики является закон сохранения энергии для термодинамических систем: в любых процессах энергия не исчезает и не создается, а лишь переходит из одного
28
вида в другой. Для дальнейшего анализа необходимо иметь формальную запись этого закона — уравнение первого начала, пригодное для анализа процессов в любых термодинамических системах.
1.3.1. Уравнение первого начала
При взаимодействии с окружающей средой термодинамическая система “не знает” о причинах, видах и мере воздействия на нее извне: при любых внешних воздействиях могут меняться только ее внутренняя энергия и объем. Если, в частности, термодинамическая система изолирована от среды, то обмена энергией вообще не происходит, ни внутренняя энергия, ни объем системы не меняются: ∆е = 0, ∆v = 0.
В термодинамике рассматривают только два вида взаимодействия — передачу теплоты q и совершение работы l,
поэтому для неизолированной термодинамической системы
изменение внутренней энергии ∆е может быть вызвано только этими причинами. С учетом знаков, которые имеют величины q и l,
∆e = q −l или q = ∆e +l. |
(1.21) |
Уравнение (1.21) выражает первое начало термодинамики:
подведенная к термодинамической системе теплота расходуется на изменение внутренней энергии системы и на совершение работы. Под работой l понимаем, в первую очередь, работу сил давления, поскольку именно эти силы являются наиболее важными в большинстве тепловых двигателей и холодильных машин. Будем считать, что в рассматриваемых термодинамических системах все прочие виды работы, кроме работы, связанной с изменением объема, отсутствуют. Если взаимодействие с окружающей средой приводит термодинамическую систему из состояния 1 в состояние 2, то для процесса 1–2 равенство (1.21) примет вид
q1−2 = ∆e1−2 +l1−2 , |
(1.22) |
29
где величина ∆e1−2 по-прежнему не зависит от характера процесса и определяется только значениями удельной внутренней энергии в состояниях 1 и 2 ∆e1−2 = e2 −e1.
Уравнение (1.22) справедливо для конечного процесса (т. е. выражено в интегральной форме). Для процесса, точки начала и конца которого бесконечно близки на термодинамической поверхности, уравнение первого начала принимает дифференциальную форму:
dq = de +dl. |
(1.23) |
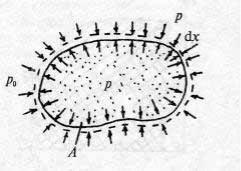
Выразим величину l1−2 через параметры состояния. Для этого представим, что термодинамическая система массой 1 кг с внутренним давлением р заключена в эластичную оболочку с поверхностью А и находится в среде с давлением р0 (рис. 5). Если давление р0 < р , то система начнет расширяться, совершая работу против сил внешнего давления. Пусть при этом поверхность А переместится на бесконечно малое расстояние dx. Работу расширения dl можно рассчитать как произведение растягивающей оболочку силы F на перемещение dx, поэтому dl = Fdx = p0Adx. Но поскольку с точностью до бесконечно малых высших порядков Adx
= dv,
Рис. 5. |
|
dl = p0dv, |
(1.24) |
а для конечного процесса, в котором оболочка растягивается от начального положения 1 до конечного 2,
30
v2
l1−2 = ∫ p0dv.
v1
Для того, чтобы процесс был квазистатическим, давления р и р0 должны отличаться на бесконечно малую величину: р = р0 ± dp (знак перед dp определяет направление процесса: плюс соответствует расширению термодинамической системы, минус — сжатию). При этом с точностью до бесконечно малой
1 |
2 |
|
v2 |
p |
0 |
dv = |
v2 |
pdv, |
|
|
∫ |
∫ |
(1.25) |
||||||
l − |
|
= |
v1 |
|
v1 |
||||
|
|
|
|
|
|
|
|
т. е. работа является функцией объема v и давления р в системе (мы, конечно, помним, что значения и р и v в ходе процесса 1–2 могут меняться!).
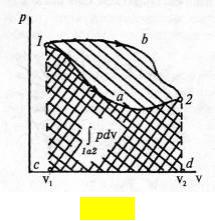
Изобразим процесс 1а2 в р–v-диаграмме состояний (рис. 6.). Пусть, например, он идет через точку а (кривая 1а2). Площадь под кривой эквивалентна интегралу в формуле(1.25):
v2
пл. c1a2d = ∫ pdv,
v1
Рис. 6.
т. е. работе расширения в равновесном процессе 1а2. Эта особенность позволяет называть диаграмму р–v рабочей диаграммой состояний. Из точки 1 в точку 2 термодинамическую систему можно перевести с помощью разных процессов (например, по кривой 1b2), при этом работа расширения для каждого процесса будет своя (то же относится и к переданной в процессе теплоте,
