
- •Содержание
- •10. Записать ответ 32
- •7. По формуле 63
- •Лабораторная работа № 4 определение момента инерции тела при помощи крутильных колебаний
- •Лабораторная работа № 30 определение момента инерции твердго тела и проверка основного закона динамики вращательного движения
- •Лабораторная работа № 5 проверка закона сохранения энергии
- •Лабораторная работа № 2 определение момента инерции твердых тел методом крутильных колебаний
- •10. Записать ответ
- •Лабораторная работа № 1 изучение стоячих волн в натянутой струне
- •Лабораторная работа № 39 определение скорости звука в воздухе интерференционным методом
- •Лабораторная работа № 10 определение коэффициента линейного расширения полимерных материалов
- •Лабораторная работа № 15 определение коэффициента теплопроводности воздуха
- •Лабораторная работа № 16 определение средней длины свободного пробега и эффективного диаметра молекул
- •Лабораторная работа № 17 определение коэффициента внутреннего трения жидкости методом стокса
- •Лабораторная работа № 18 определение коэффициента вязкости воздуха
- •Лабораторная работа № 13 определение отношения теплоемкостей воздуха методом адиабатического расширения
- •Лабораторная работа № 19 изменение энтропии при изохорическом охладжении воздуха
- •Лабораторная работа № 20 изменение энтропии при нагревании и плавлении твердых тел
- •Лабораторная работа № 38 измерение молекулярной теплоемкости твердого тела
- •Лабораторная работа № 22 экспериментальная проверка закона сохранения и превращения энергии
- •( И подставляются в (1.6) в радианах).
- •Лабораторная работа № 25 экспериментальная проверка теоремы гюйгенса-штейнера
- •Описание теоретической части работы
- •Теорема гюйгенса-штейнера
- •Методика измерения
- •Контрольные вопросы
- •Лабораторная работа № 26 определение плотности сыпучих и пористых тел
- •Описание установки
- •Цель работы
- •Порядок выполнения работы
- •Табличные данные
- •Правила работы в лаборатории
Лабораторная работа № 13 определение отношения теплоемкостей воздуха методом адиабатического расширения
Для характеристики тепловых свойств тел в термодинамике пользуются понятием теплоемкости
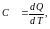 (1)
(1)
Теплоемкость газов существенным образом зависит от условий нагревания: различают теплоемкость газов при постоянном объеме Сv и при постоянном давлении Cp. Отношение этих теплоемкостей = Cp / Cv является характерной величиной для каждого газа и входит в уравнение адиабатического процесса (уравнение Пуассона)
 (2)
(2)
Из теории [1] известно, что
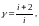 (3)
(3)
где i - число степеней свободы газовых молекул.
В настоящей лабораторной работе величина показателя адиабаты воздуха измеряется методом адиабатического расширения.
ОПИСАНИЕ УСТАНОВКИ И МЕТОДА ИЗМЕРЕНИЙ
Экспериментальная установка, изображенная на рис. 1, состоит из стеклянного баллона 1 с пробкой 2, соединенного с манометром 3 и через кран (зажим) с насосом 5.
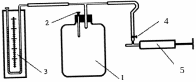
Рис. 1
Если при закрытой пробке 2 в баллон при помощи насоса быстро накачать некоторое количество воздуха, то давление и температура воздуха внутри баллона повысятся. Вследствие теплообмена с окружающей средой через некоторое время температура воздуха внутри баллона сравнивается с комнатной температурой Т1, а давление станет равным
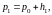
где p0 - атмосферное давление; h1 - избыточное давление, измеряемое разностью уровней жидкости (воды) в манометре.
Таким образом, состояние воздуха внутри баллона характеризуется параметрами p1, V1, T1 (точка 1 на рис. 2).
Если теперь открыть на короткое время пробку 2, то воздух в баллоне быстро расширится. Этот процесс можно считать адиабатическим (кривая 1-2 на рис. 2). Строго говоря, адиабатическими называются процессы, протекающие без теплообмена с окружающей средой. В нашей же установке теплоизоляция баллона далеко не идеальна. Тем не менее очевидно, что в силу быстроты расширения теплообменом за время расширения можно пренебречь. В результате этого процесса давление воздуха в баллоне станет равным атмосферному p0, а температура и объем соответственно Т2 и V2 (точка 2 на рис. 2). Для адиабатического перехода воздуха из состояния 1 в состояние 2 справедливо уравнение Пуассона
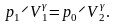 (4)
(4)
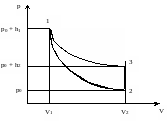
Рис. 2
Тотчас же после расширения воздуха пробку закрывают, и охладившийся при адиабатическом расширении воздух в баллоне через некоторое время нагревается вследствие теплообмена до комнатной температуры Т1; при этом его давление повышается до p0 + h2, где h2 - новая разность уровней жидкости в манометре. Этот процесс происходит при постоянном объеме и изображается прямой 2-3 на рис. 2.
Точки 3 и 1 расположены на одной изотерме 1-3, соответствующей комнатной температуре Т1, то есть
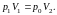 (5)
(5)
Исключая из уравнения (4) и (5) отношение V2/V1, получим
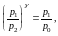 (6)
(6)
откуда
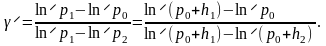 (7)
(7)
Учитывая, что значения h1 и h2 значительно меньше р0, воспользуемся для вычисления логарифмов приближенными формулами:
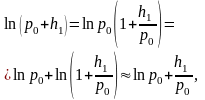 (8)
(8)
и аналогично
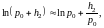 (9)
(9)
Подставляя эти выражения в (7), окончательно получим
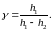
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Убедившись в том, что пробка 2 плотно закрыта, осторожно с помощью насоса накачайте воздух в баллоне до тех пор, пока разность уровней жидкости не достигнет 20-25 см.
2. Перекрыв сообщение между баллоном с помощью зажима 4, выждите, пока разность уровней жидкости в манометре перестанет уменьшаться и сделайте отсчет h1.
3. На очень короткое время (порядка одной секунды) откройте пробку 2 - уровни жидкости в манометре сравняются - и тотчас ее закройте.
4.После закрытия пробки давление воздуха в баллоне начнет расти в результате нагревания; при этом разность уровней жидкости в манометре будет увеличиваться. Выждав, пока давление перестанет меняться, сделайте отсчет разности уровней h2.
5. Повторите опыт (пункты 1-4) не менее 7 раз; результаты измерений занесите в прилагаемую ниже таблицу.
6. По рабочей формуле (10) вычислите с точностью до 3-4 значащих цифр для каждого опыта в отдельности.
7. Считая величину в каждом опыте случайной величиной, дальнейшую обработку результатов производите как при невоспроизводимых косвенных измерениях (то есть аналогично обработке прямых многократных измерений).
Таблица
Номер опыта |
h1, см |
h2, см |
i |
i |
(i)2 |
1 2 3 4 |
|
|
|
|
|
= (i)2=
8. Округлив надлежащим образом доверительную погрешность и среднее значение , запишите окончательный результат с указанием доверительной вероятности.
9. Считая воздух идеальным двухатомным газом, по формуле (3) вычислите теоретическое значение , сравните его с полученным экспериментально и сделайте выводы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Почему теплоемкость газов при постоянном давлении Ср больше, чем при постоянном объеме Сv? Как связаны между собой соответствующие молярные теплоемкости газов ср и сv?
2. Каков физический смысл универсальной газовой постоянной? Как она связана с постоянной Больцмана?
3. Что такое число степеней свободы молекулы? Чему оно равно для одноатомной молекулы? для двухатомной? для многоатомной?
4. Каково теоретическое значение для одноатомных газов? для двухатомных? для многоатомных?
5. Что такое адиабатический процесс? Как его осуществить на практике?
6. Напишите уравнение Пуассона для адиабатического процесса. Как отличаются графики адиабатического и изотермического процессов для одной и той же массы газа?
7. Объясните ход работы и выведите рабочую формулу (10).
8. На графике p(v) изобразите последовательно все процессы, реализуемые в данной работе.
1. Савельев И.В. Курс общей физики. - М.: Наука, 1982, т. 1, § 87, 88, 97.
2. Гусев Г.В., Буркова Л.А. Учебное пособие. Обработка и анализ результатов лабораторного физического эксперимента. - СПб.: СПГУТД, 1995.
Составитель доц. Ю.И.Соколов
