
- •Введение
- •Обработка результатов физико-химических измерений Погрешность измерений
- •Выражение результатов измерений и расчетов
- •Термохимия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Коллигативные свойства растворов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 4. Криометрия
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в однокомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №5. Давление насыщенного пара
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в двухкомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №6. Получение кривой разгонки
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Распределение вещества в двухфазной системе. Экстракция Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Электропроводность растворов электролитов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №11. Определение чисел переноса ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Термодинамика электрохимических систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 12. Определение стандартных электродных потенциалов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Определение коэффициента активности электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Ионометрия и рН-метрия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Строение вещества. Молекулярные спектры Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Химическая кинетика Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 16. Определение константы скорости реакции окисления иодида калия персульфатом аммония
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
- •Молекулярная адсорбция
- •Адсорбция на поверхности раздела жидкость – газ
- •Адсорбция на поверхности твердого тела
- •Ионообменная адсорбция
- •Контрольные вопросы
- •Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор пав - воздух
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная работа № 19. Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 20. Исследование обменной адсорбции ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №22. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Устойчивость дисперсных систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 23. Получение лиофобных золей
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 24. Определение порога коагуляции визуальным методом
- •Выполнение работы
- •I. Приблизительное определение порога коагуляции
- •Содержание протокола лабораторной работы
- •II. Уточнение значения порога коагуляции
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом Краткие теоретические сведения
- •Контрольные вопросы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Обработка результатов эксперимента
1. Построить график зависимости Т = f(τ), отражая показания температуры по начальному и конечному периодам.
2. Соединить последнюю точку начального периода с начальной точкой конечного периода.
3. Полученную линию разделить пополам.
4. Через точку середины провести перпендикуляр к оси абсцисс.
5. Продлить температурные зависимости начального и конечного периодов до пересечения с перпендикуляром – получим значение изменения температуры Т.
6. Рассчитать теплоемкость калориметрической установки по уравнению:
Сcal = Cр-р(mp-p + mщ) + СHgVHg + Cстm, Дж/К,
где Cр-р – удельная теплоемкость раствора, 4,18 Дж/гК; mp-p – масса раствора во внутреннем стакане, г; mщ – масса раствора щелочи в пипетке, г; СHg – объемная теплоемкость ртути и стекла, 1,92 Дж/см3К, VHg – объем баллона термометра, содержащего ртуть, мл; Cст – удельная теплоемкость стекла, 0,79 дж/гК; m – общая масса стеклянных частей калориметрической установки, г.
7. Вычислить тепловой эффект процесса нейтрализации по уравнению:
![]() ,
Дж/моль,
,
Дж/моль,
где nщ – количество вещества щелочи в пипетке, моль.
8. Пользуясь справочными данными рассчитать процесса нейтрализации Н+ + ОН = Н2О и сравнить с экспериментальной величиной.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Коллигативные свойства растворов Краткие теоретические сведения
Коллигативные свойства раствора зависят только от концентрации растворенного вещества. К коллигативным свойствам относятся понижение давления насыщенного пара растворителя, повышение температуры кипения раствора, понижение температуры замерзания и осмотическое давление.
Давление насыщенного пара растворителя над раствором всегда меньше, чем давление насыщенного пара растворителя над ним самим:
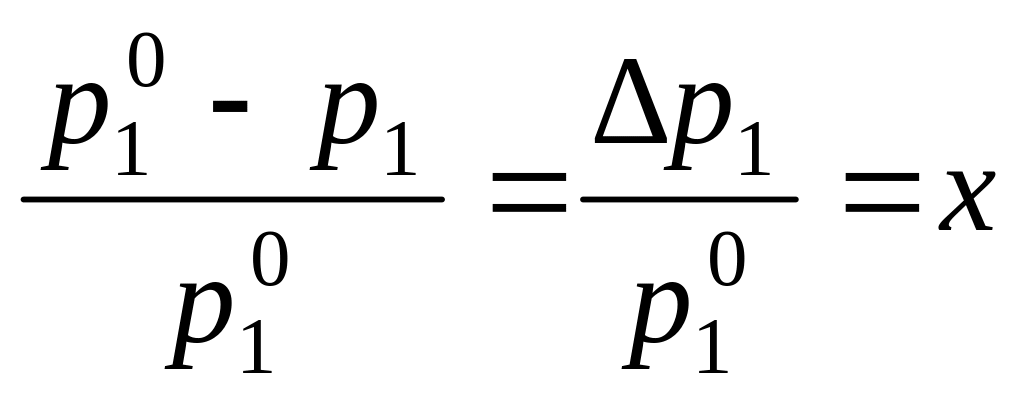 ,
,
где p1
– давление насыщенного пара растворителя
над раствором,
![]() – давление насыщенного пара растворителя
над ним самим, x – мольная доля
растворенного вещества.
– давление насыщенного пара растворителя
над ним самим, x – мольная доля
растворенного вещества.
Раствор всегда кипит при температуре, большей, чем чистый растворитель:
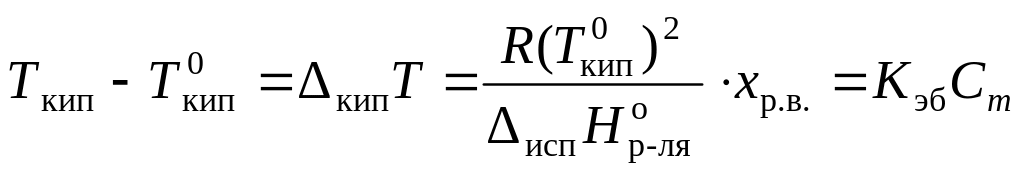 ,
,
где Ткип
– температура кипения раствора;
![]() – температура кипения чистого
растворителя; R – универсальная
газовая постоянная;
– температура кипения чистого
растворителя; R – универсальная
газовая постоянная;
![]() – молярная теплота испарения растворителя;
xр.в. – мольная доля растворенного
вещества; Cm – моляльная
концентрация растворного вещества; Kэб
– эбуллиоскопическая постоянная
растворителя (или константа кипения),
которая может быть вычислена по формуле:
– молярная теплота испарения растворителя;
xр.в. – мольная доля растворенного
вещества; Cm – моляльная
концентрация растворного вещества; Kэб
– эбуллиоскопическая постоянная
растворителя (или константа кипения),
которая может быть вычислена по формуле:
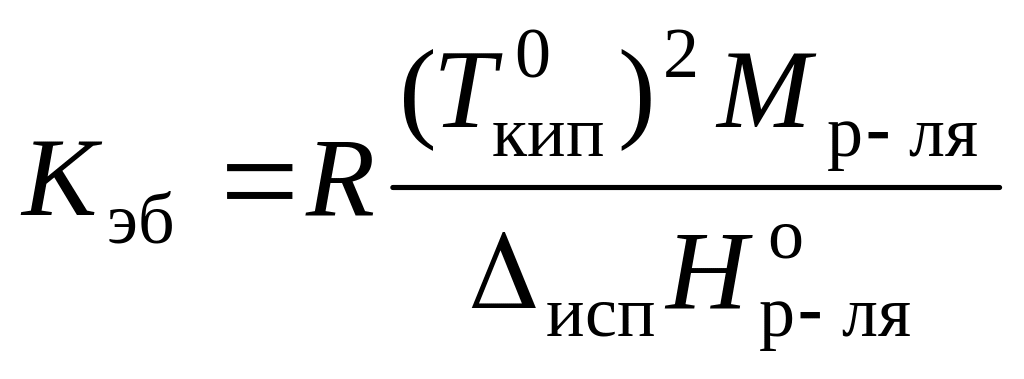 ,
,
где Мр-ля – молярная масса растворителя, кг/моль.
Раствор замерзает при температуре меньшей, чем чистый растворитель:
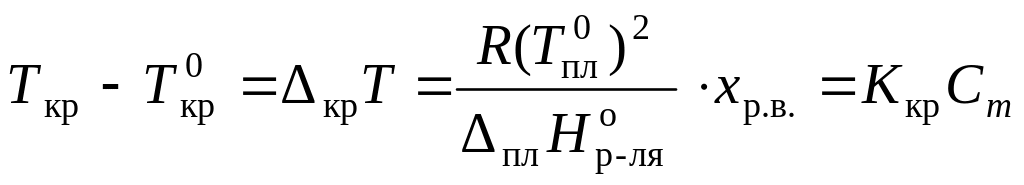 ,
,
где Ткр
– температура кристаллизации раствора;
![]() – температура кристаллизации (плавления)
чистого растворителя; R – универсальная
газовая постоянная;
– температура кристаллизации (плавления)
чистого растворителя; R – универсальная
газовая постоянная;
![]() – молярная теплота плавления растворителя;
xр.в. – мольная доля растворенного
вещества; Cm – моляльная
концентрация растворного вещества; Kкр
– криоскопическая постоянная растворителя
(или константа замерзания), которую
можно вычислить по уравнению:
– молярная теплота плавления растворителя;
xр.в. – мольная доля растворенного
вещества; Cm – моляльная
концентрация растворного вещества; Kкр
– криоскопическая постоянная растворителя
(или константа замерзания), которую
можно вычислить по уравнению:
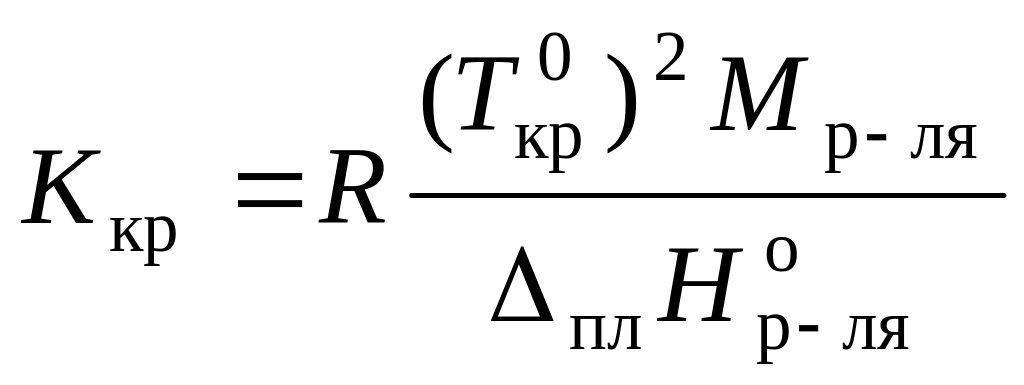 .
.
Например, для воды криоскопическая постоянная равна 1,86 K·кг/моль, для бензола – 5,07, диоксана – 4,71 и т.д.
Осмотическое давление:
![]() ,
,
где R –
универсальная газовая постоянная; Т
– температура; xр.в. – мольная
доля растворенного вещества; СМ
– молярная концентрация раствора;
![]() − молярный объем растворителя (объем
1 моль вещества), м3.
− молярный объем растворителя (объем
1 моль вещества), м3.
Коллигативные свойства определяются свойствами чистого растворителя и не зависят от свойств растворенного вещества.
Для того, чтобы сделать существующие уравнения пригодными для расчетов растворов электролитов, Вант-Гофф ввел в них множитель i, названный изотоническим коэффициентом. Изотонический коэффициент является показателем увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). Значение i >1 свидетельствует о наличии процесса диссоциации, а i < 1 – о процессе ассоциации. С учетом изотонического коэффициента для растворов электролитов получим:
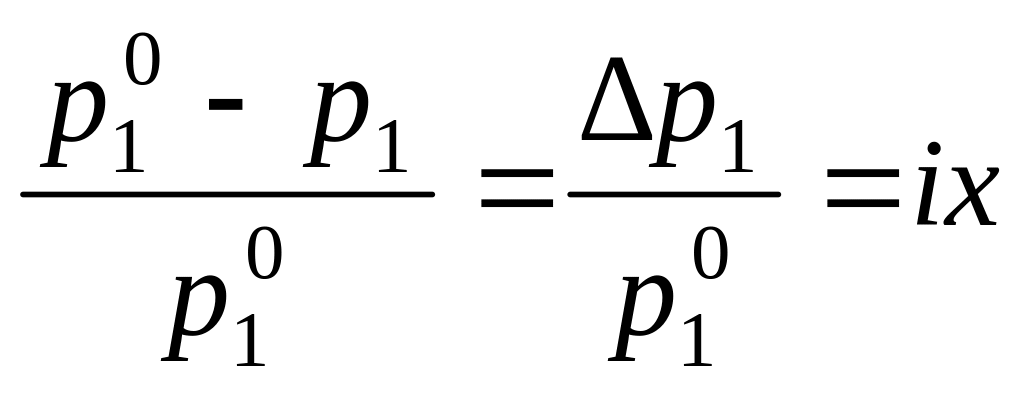 ,
,
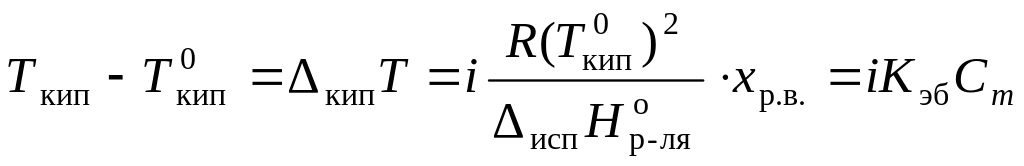 ,
,
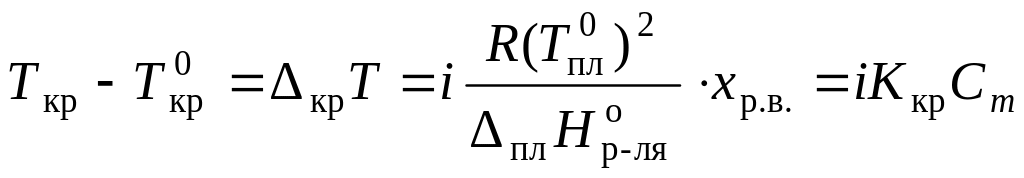 ,
,
![]() .
.
Численное значение изотонического коэффициента позволяет для случая диссоциации вычислить степень диссоциации :
![]() ,
,
для случая ассоциации вычислить степень ассоциации :
![]() ,
,
где
![]() – число частиц, получающихся из одной
частицы при диссоциации;
– число частиц, получающихся из одной
частицы при диссоциации;
![]() – число частиц, объединяющихся в одну
при ассоциации.
– число частиц, объединяющихся в одну
при ассоциации.
Коллигативные свойства растворов используются для определения молярной массы растворенных веществ, а также для определения изменения состояния вещества в растворе по сравнению с чистым веществом.
