
- •Введение
- •Обработка результатов физико-химических измерений Погрешность измерений
- •Выражение результатов измерений и расчетов
- •Термохимия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Коллигативные свойства растворов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 4. Криометрия
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в однокомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №5. Давление насыщенного пара
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в двухкомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №6. Получение кривой разгонки
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Распределение вещества в двухфазной системе. Экстракция Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Электропроводность растворов электролитов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №11. Определение чисел переноса ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Термодинамика электрохимических систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 12. Определение стандартных электродных потенциалов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Определение коэффициента активности электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Ионометрия и рН-метрия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Строение вещества. Молекулярные спектры Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Химическая кинетика Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 16. Определение константы скорости реакции окисления иодида калия персульфатом аммония
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
- •Молекулярная адсорбция
- •Адсорбция на поверхности раздела жидкость – газ
- •Адсорбция на поверхности твердого тела
- •Ионообменная адсорбция
- •Контрольные вопросы
- •Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор пав - воздух
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная работа № 19. Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 20. Исследование обменной адсорбции ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №22. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Устойчивость дисперсных систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 23. Получение лиофобных золей
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 24. Определение порога коагуляции визуальным методом
- •Выполнение работы
- •I. Приблизительное определение порога коагуляции
- •Содержание протокола лабораторной работы
- •II. Уточнение значения порога коагуляции
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом Краткие теоретические сведения
- •Контрольные вопросы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Содержание протокола лабораторной работы
Название экстрагента:
Концентрация экстрагента:
Растворитель:
Название соли металла:
Химическая формула соли металла:
Концентрация раствора щелочи (NaOH) СNaOH = _________
Концентрация раствора трилона Б СТ = ___________
Объем аликвоты, взятый для анализа Vа = _______мл.
Таблица экспериментальных данных
№ п/п |
VNaOH, мл |
рН |
V трилона Б, мл |
|
V1 |
V2 |
|||
исходный |
нет |
нет |
|
|
1 |
1,0 |
|
|
|
2 |
1,5 |
|
|
|
3 |
2,0 |
|
|
|
4 |
2,5 |
|
|
|
Обработка результатов эксперимента
1. Рассчитать исходную и равновесные концентрации металла (2+) по уравнению:
![]() ,
,
где VT и СТ – объем, мл и концентрация, моль/л трилона Б, Va – объем аликвоты, мл.
2. Вычислить концентрацию металла (2+) в органической фазе по уравнению:
![]() ,
,
где
![]() и Vисх
концентрация, моль/л, и объем, мл,
исходной соли металла, взятой для
экстракции; Vaq – объем
водной фазы, мл, Vaq = Vисх
+ VNaOH; Vorg – объем
органической фазы, мл.
и Vисх
концентрация, моль/л, и объем, мл,
исходной соли металла, взятой для
экстракции; Vaq – объем
водной фазы, мл, Vaq = Vисх
+ VNaOH; Vorg – объем
органической фазы, мл.
3. Рассчитать коэффициент распределения
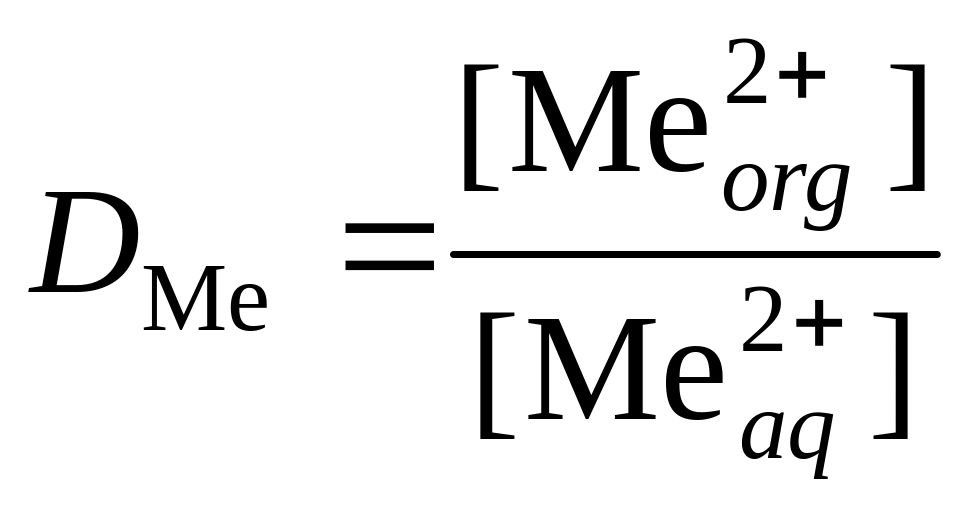 .
.
4. Заполнить таблицу:
№ п/п |
VNaOH, мл |
рН |
VТрБ, мл (средний по двум измерениям) |
|
|
DMe |
lgDMe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Построить график зависимости lgDMe = f(pH).
6. По графику определить коэффициенты K (константу равновесия) и z уравнения зависимости логарифма коэффициента распределения от рН: lgD = lgK + zpH
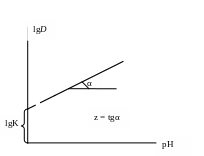
7. Сравнить полученную величину z с зарядом иона и сделать вывод о справедливости принятой модели.
8. Сравнить значения lgK для других металлов и сделать вывод о сравнительной экстрагируемости катионов металлов нафтеновыми кислотами.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Электропроводность растворов электролитов Краткие теоретические сведения
Электропроводность растворов обусловлена подвижностью ионов, образующихся при диссоциации электролитов в полярных растворителях. Электропроводность растворов электролитов зависит от многих факторов: природы электролита, природы растворителя, концентрации раствора, температуры и др.
Электропроводностью называется величина, обратная сопротивлению:
![]() ,
,
где R – сопротивление раствора, Ом; W – электропроводность раствора, Ом−1 или См (сименс).
В кондуктометрии используют удельную и эквивалентную электропроводность
Удельная электропроводность представляет собой величину, обратную удельному сопротивлению:
![]() .
.
Повышение температуры на 1 К увеличивает удельную электропроводность примерно на 2 – 2,5 %. Это объясняется уменьшением вязкости раствора и уменьшением гидратации ионов, а для растворов слабых электролитов – увеличением степени диссоциации.
Эквивалентная электропроводность:
![]() ,
,
где СN – нормальная концентрация электролита, экв/л. Единицы измерения удельной электропроводности соответственно См·м2·экв−1.
Перенос электричества в растворах электролитов осуществляется ионами и электропроводность раствора зависит от подвижности ионов. Подвижностью иона называют скорость движения данного иона в электрическом поле при разности потенциалов 1 В.
Взаимосвязь подвижности и удельной электропроводности описывает уравнение:
![]() ,
,
где – степень диссоциации электролита (для разбавленных растворов сильных электролитов = 1); СN – нормальная концентрация электролита, экв/м3; F – число Фарадея; u+ и u– - подвижности катиона и аниона соответственно.
Эквивалентная электропроводность связана с подвижностью иона выражением:
i = Fui , ()
где i – удельная электропроводность катиона либо аниона; ui – подвижность катиона либо аниона.
Эквивалентная электропроводность раствора определяется уравнением:
![]() .
.
При бесконечно большом разбавлении степень диссоциации → 1 и эквивалентная электропроводность стремится к наибольшему значению ∞. В этом случае:
![]()
предельная эквивалентная электропроводность равна сумме предельных эквивалентных электропроводностей ионов при бесконечном разбавлении (закон Кольрауша). Предельные эквивалентные электропроводности ионов являются справочными величинами.
Отношение эквивалентной электропроводности раствора сильного электролита к ее предельному значению ∞ называют коэффициентом электропроводности или «кажущейся степенью диссоциации».
![]() .
.
Отношение эквивалентной электропроводности раствора слабого электролита к ее предельному значению ∞ представляет собой степень диссоциации:
![]() .
.
В случае сильного электролита = 1. Изменение эквивалентной электропроводности с концентрацией обусловлено коэффициентом электропроводности f, т.е. влиянием электростатического взаимодействия ионов на скорость их движения. Уменьшение эквивалентной электропроводности растворов сильных электролитов с ростом концентрации объясняется торможением движения ионов в электрическом поле – с увеличением концентрации раствора ионы сближаются и электростатическое взаимодействие между ними возрастает.
Для растворов слабых электролитов эквивалентная электропроводность зависит от концентрации электролита из-за изменения степени диссоциации. С увеличением концентрации электролита степень диссоциации уменьшается и это приводит к уменьшению эквивалентной электропроводности.
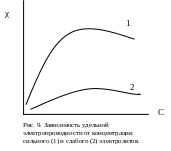
В разбавленных растворах удельная электропроводность увеличивается почти пропорционально концентрации. В более концентрированных растворах f уменьшается, что приводит к снижению электропроводности (рис. 9).
Величина удельной электропроводности в растворах слабых электролитов пропорциональна произведению αС. При небольших концентрациях это произведение увеличивается с ростом концентрации, и удельная электропроводность растет. Однако при дальнейшем увеличении концентрации это произведение уменьшается из-за снижения степени диссоциации, вследствие чего удельная электропроводность слабых электролитов, как и сильных, после достижения максимального значения снижается (рис. 9).
Для оценки участия данного вида ионов в переносе электричества *.Гитторфом было введено понятие числа переноса иона. Число переноса иона – это отношение количества электричества, перенесенное данным видом ионов qi к общему количеству электричества qобщ, перенесенному всеми видами ионов:
![]() .
.
Число переноса зависит от природы не только данного иона, но и противоиона. Сумма чисел переноса всех видов ионов в растворе равна единице.
При протекании электрического
тока через раствор в приэлектродном
пространстве происходит изменение
концентрации электролита вследствие
движения ионов в электрическом поле и
участия ионов в электродных процессах.
Допустим, что через раствор электролита
MeAn, в котором Mez+
– катион металла, Anz−
– кислотный остаток бескислородной
кислоты, проходит некоторое количество
электричества q. На катоде
происходит восстановление катионов
металлов:
![]() .
Изменение концентрации Меz+
в катодном пространстве
.
Изменение концентрации Меz+
в катодном пространстве
![]() .
На аноде протекает процесс окисления
анионов:
.
На аноде протекает процесс окисления
анионов:
![]() .
Изменение содержания электролита в
анодном пространстве:
.
Изменение содержания электролита в
анодном пространстве:
![]() .
.
Число переноса иона любого знака равно отношению убыли электролита у электрода противоположного иону знака к количеству разложенного электролита:
![]() ;
;
![]() .
.
