
- •Введение
- •Обработка результатов физико-химических измерений Погрешность измерений
- •Выражение результатов измерений и расчетов
- •Термохимия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Коллигативные свойства растворов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 4. Криометрия
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в однокомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №5. Давление насыщенного пара
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в двухкомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №6. Получение кривой разгонки
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Распределение вещества в двухфазной системе. Экстракция Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Электропроводность растворов электролитов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №11. Определение чисел переноса ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Термодинамика электрохимических систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 12. Определение стандартных электродных потенциалов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Определение коэффициента активности электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Ионометрия и рН-метрия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Строение вещества. Молекулярные спектры Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Химическая кинетика Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 16. Определение константы скорости реакции окисления иодида калия персульфатом аммония
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
- •Молекулярная адсорбция
- •Адсорбция на поверхности раздела жидкость – газ
- •Адсорбция на поверхности твердого тела
- •Ионообменная адсорбция
- •Контрольные вопросы
- •Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор пав - воздух
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная работа № 19. Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 20. Исследование обменной адсорбции ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №22. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Устойчивость дисперсных систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 23. Получение лиофобных золей
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 24. Определение порога коагуляции визуальным методом
- •Выполнение работы
- •I. Приблизительное определение порога коагуляции
- •Содержание протокола лабораторной работы
- •II. Уточнение значения порога коагуляции
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом Краткие теоретические сведения
- •Контрольные вопросы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Содержание протокола лабораторной работы
Концентрация стандартного раствора соли железа
Объем стандартного раствора соли железа, взятый для приготовления рабочих растворов в колбах на 50 мл
Концентрация раствора роданида калия (аммония)
Толщина кюветы
Длина волны
Таблица 1
Зависимость оптической плотности от количества роданида калия
VKSCN, мл |
D |
|
|
Обработка результатов эксперимента
1. Заполнить таблицу:
[Fe]общ, моль/л |
VKSCN, мл |
D |
|
[KSCN], моль/л |
[KSCN]−1 |
[KSCN]−2 |
[KSCN]−3 |
|
|
|
|
|
|
|
|
![]() ,
,
где СKSCN = 1 моль/л; 50 – объем мерной колбы, мл; VKSCN – берется из условий эксперимента, мл;
![]() ,
,
где С(Fe)ст. – концентрация стандартного раствора соли железа, моль/л, в пересчете на железо; V(Fe)ст – объем стандартного раствора соли железа, взятый для приготовления рабочих растворов, мл; 50 – объем мерной колбы, мл.
2. По данным таблицы построить график в координатах:
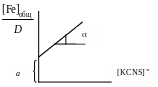
где n = 1, 2 или 3. т.е. требуется построить три графика и выделить тот, где зависимость будет наиболее прямолинейная для дальнейшей работы.
3. Выделить линейный участок графической зависимости и экстраполировать его до пересечения с осью ординат. Найти tg и а, по значениям которых вычислить Kn и по формулам и .
4. Определить значение
![]() по формуле:
по формуле:
.
5. Сделать вывод об устойчивости роданидного комплекса железа.
Химическая кинетика Краткие теоретические сведения
Кинетика изучает скорости и механизмы химических превращений. Скоростью реакции по данному компоненту называют изменение числа молей dni этого компонента в единицу времени d отнесенное для реакций, протекающих в объеме (или гомогенных), к единице объема V
![]() ,
,
где dCi – изменение концентрации вещества при условии V = const; i – стехиометрический коэффициент, для исходных веществ i < 0, а для продуктов реакции i > 0.
Для реакций, протекающих на поверхности (гетерогенных), к единице поверхности S:
![]() .
.
Скорость реакции зависит от исходной концентрации реагентов, температуры, удельной поверхности, наличия катализаторов, примесей и т.д.
Зависимость скорости процесса от концентрации реагирующих веществ описывается кинетическим уравнением или уравнением баланса масс. Для гипотетической реакции aA + bB = … кинетическое уравнение запишется следующим образом:
![]() .
.
где k – константа скорости реакции, по физическому смыслу равная скорости реакции при единичных молярных концентрациях реагирующих веществ; величина k не зависит от концентрации реагирующих веществ, но показывает зависимость скорости реакции от температуры; показатели степени n1 и n2 являются порядком реакции по компонентам А и В соответственно; порядок реакции определяют из эксперимента путем математической обработки зависимости Сi = f() и величина порядка реакции (n = n1 + n2) не обязательно представляет собой целое число.
Чаще всего реакции, подчиняющиеся просты кинетическим уравнениям, бывают первого, второго или третьего (очень редко) порядков.
Порядок реакции можно установить, например, графически. Для этого из эксперимента получают зависимость концентрации вещества от времени, затем по экспериментальным данным строят зависимости: для первого порядка – lnC = f(), для второго порядка – 1/С = f(), для третьего порядка – 1/С2 = f() и отмечают, какой из графиков будет представлять собой прямолинейную зависимость. Прямолинейная зависимость указывает на соответствующий порядок реакции.
Порядок и константа скорости
реакции связаны между собой несложными
соотношениями. Для реакции первого
порядка
![]() ,
второго порядка
,
второго порядка
![]() ,
третьего порядка
,
третьего порядка
![]() .
.
Таким образом, зная порядок реакции можно определить ее константу скорости и, в итоге, установить кинетическое уравнение данного химического процесса. Зная формулу кинетического уравнения можно выполнять математическое моделирование данного процесса с целью определить оптимальные условия проведения той или иной технологической операции.
