
- •Введение
- •Обработка результатов физико-химических измерений Погрешность измерений
- •Выражение результатов измерений и расчетов
- •Термохимия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Коллигативные свойства растворов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 4. Криометрия
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в однокомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №5. Давление насыщенного пара
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в двухкомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №6. Получение кривой разгонки
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Распределение вещества в двухфазной системе. Экстракция Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Электропроводность растворов электролитов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №11. Определение чисел переноса ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Термодинамика электрохимических систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 12. Определение стандартных электродных потенциалов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Определение коэффициента активности электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Ионометрия и рН-метрия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Строение вещества. Молекулярные спектры Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Химическая кинетика Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 16. Определение константы скорости реакции окисления иодида калия персульфатом аммония
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
- •Молекулярная адсорбция
- •Адсорбция на поверхности раздела жидкость – газ
- •Адсорбция на поверхности твердого тела
- •Ионообменная адсорбция
- •Контрольные вопросы
- •Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор пав - воздух
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная работа № 19. Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 20. Исследование обменной адсорбции ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №22. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Устойчивость дисперсных систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 23. Получение лиофобных золей
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 24. Определение порога коагуляции визуальным методом
- •Выполнение работы
- •I. Приблизительное определение порога коагуляции
- •Содержание протокола лабораторной работы
- •II. Уточнение значения порога коагуляции
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом Краткие теоретические сведения
- •Контрольные вопросы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Обработка экспериментальных данных
1. По результатам измерения показателя преломления исходных растворов, построить градуировочный график в координатах показатель преломления – объемная доля φ компонента «В».
2. По градуировочному графику определить состав дистиллята и кубового остатка для каждой пробы. Состав дистиллята соответствует содержанию компонента «В» в равновесной паровой фазе, Содержание компонента «В» в кубовом остатке соответствует составу равновесной жидкой фазы.
3. Вычислить массовую ω и мольную х долю компонента «В» в равновесных паре и жидкости.
Объемная доля вещества в растворе определяется формулой:
![]() ,
,
где Vi – объем компонента в растворе, VΣ – объем раствора.
Массовая доля компонента в растворе определяется уравнением:
![]() ,
,
где mi – масса компонента в растворе, mΣ – масса раствора; для бинарной системы mΣ = mA + mB.
Масса вещества связана с его объемом соотношением:
m = dV,
где d – плотность вещества, г/см3.
Мольная доля вычисляется по формуле:
![]() ,
,
где ni – количество вещества компонента в растворе, моль; Σni – суммарное количество вещества по всем компонентам раствора; для бинарной системы Σni = nA + nB.
Количество вещества и его масса связаны соотношением:
mi = niMi,
где Мi – молярная масса компонента, г/моль.
4. Заполнить таблицу:
№ п/п |
φисх(В), %(об.) |
Ткип,, °С |
Содержание компонента «В» |
|||||
Состав равновесного пара |
Состав равновесной жидкости |
|||||||
φВ, %(об.) |
ωВ, %(масс.) |
хВ |
φВ, %(об.) |
ωВ, %(масс.) |
хВ |
|||
|
20 |
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
|
5. Построить диаграммы состояния изучаемой системы в координатах «температура кипения – состав» и «состав пара – состав жидкости», на которых указывают давление, при котором проводился опыт. Полученную диаграмму кипения анализируют, пользуясь правилом фаз Гиббса.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Распределение вещества в двухфазной системе. Экстракция Краткие теоретические сведения
С распределением вещества между двумя фазами встречаются во многих технологических процессах – растворения, выщелачивания, экстракции, сорбции и т.д. Экстракция – процесс переноса растворенного вещества из одной жидкой фазы в другую, при условии, что обе жидких фазы не смешиваются друг с другом. Обычно распределение (перенос) растворенного вещества осуществляется между водным и органическим растворами. Жидкостная экстракция используется для разделения компонентов гомогенных жидких систем.
В случае системы с физическим распределением компонентов отсутствует химическое взаимодействие между распределяемым веществом и экстрагентом. Экстракция идет за счет различной растворимости компонентов в органической и водной фазах. В процессах физического распределения, как правило, участвуют простые вещества или соединения с малополярными ковалентными связями. Такие экстракционные системы чаще используют для разделения смеси органических веществ или выделения органических компонентов из водных растворов, грунтов и др. Экстракция за счет химического взаимодействия сопровождается образованием сложных комплексных соединений экстрагируемого вещества с органическим компонентом. Эффективность процесса определяется прочностью комплексов, образуемых компонентами. Данный метод в основном используется для извлечения и разделения ионов металлов. Здесь экстрагент – органический раствор экстракционного реагента, способного к образованию химических соединений с ионами или молекулами извлекаемого вещества, в органическом растворителе. Образующееся химическое соединение должно быть нерастворимо в воде и хорошо растворяться в выбранном органическом растворителе. Молекула экстракционного реагента должна иметь гетерополярное строение и состоять из неполярного углеводородного радикала и полярной функциональной группы. Углеводородный радикал обеспечивает малую растворимость в воде и высокую растворимость в разбавителе, а функциональная группа – образование химической связи с целевым компонентом. В качестве разбавителей обычно применяют ароматические или алифатические углеводороды, хлорпроизводные углеводородов, спирты, нитробензол и др. В зависимости от реакции, лежащей в основе процесса экстракции различают следующие основные типы химических экстракционных систем.
Катионообменная экстракция экстракция металлов, находящихся в водных растворах в виде катионов (простых и комплексных) за счет обмена экстрагируемого катиона на протон или другой катион экстрагента. Экстрагенты – карбоновые кислоты или их соли
Анионообменная экстракция – экстракция металлов, находящихся в водных растворах в виде анионов за счет обмена экстрагируемого аниона на анион экстрагента. Экстрагенты – органические основания и их соли.
Экстракция с образованием хелатных комплексов или координационная экстракция. Экстрагируемое соединение образуется в результате комплексообразования между молекулами или ионами экстракционного агента и ионом экстрагируемого металла-комплексообразователя.
Экстракция ионных ассоциатов – экстракция неорганических молекул из водного раствора нейтральными молекулами экстрагента за счет образования в экстракте ионных ассоциатов (солей), состоящих из органических катионов и неорганических анионов.
Экстракция посредством сольватации катионов металла или водорода. Экстрагенты содержат полярный атом кислорода, связанный либо с углеродом, либо с фосфором. Вместо кислорода в этих соединениях может быть любой другой донорный атом.
Для количественной характеристики полноты и селективности извлечения целевого компонента в процессе экстракции используют следующие показатели.
1. Коэффициент распределения, который подчиняется закону распределения Нернста: «каждое из растворенных веществ распределяется между жидкими несмешивающимися фазами со своим индивидуальным коэффициентом распределения». Коэффициент распределения представляет собой соотношение активностей вещества в органической и водной фазе:
![]() .
.
При небольших концентрациях растворов и отсутствии процессов диссоциации, ассоциации и других химических превращений активность вещества можно заменить на его концентрацию:
![]() .
.
Если D>1, то растворенный компонент будет концентрироваться в органической фазе. Для определения коэффициента распределения в широком диапазоне концентраций и предельной емкости экстрагента части используют изотерму экстракции, представляющую собой зависимость равновесной концентрации целевого компонента в экстракте (Сorg) от равновесной концентрации в рафинате (Сaq).
2. Степень извлечения. Представляет собой отношение количества вещества в органической фазе к его общему содержанию в системе.
![]() .
.
3. Если при экстракции происходит химическая реакция растворенного вещества с экстрагентом, количественным показателем процесса экстракции, также является константа равновесия процесса экстракции.
Для физико-химической характеристики процесса экстракции следует знать, какие параметры будут влиять на экстракционное равновесие и, как следствие, на величину коэффициента распределения. Например, при экстракции ионов металла Mez+ нафтеновой кислотой HR, не смешивающейся с водой, можно записать такую схему реакции:
![]() .
.
При не слишком высоких концентрациях ионов можно считать 1. Тогда константу равновесия можно записать в виде уравнения:
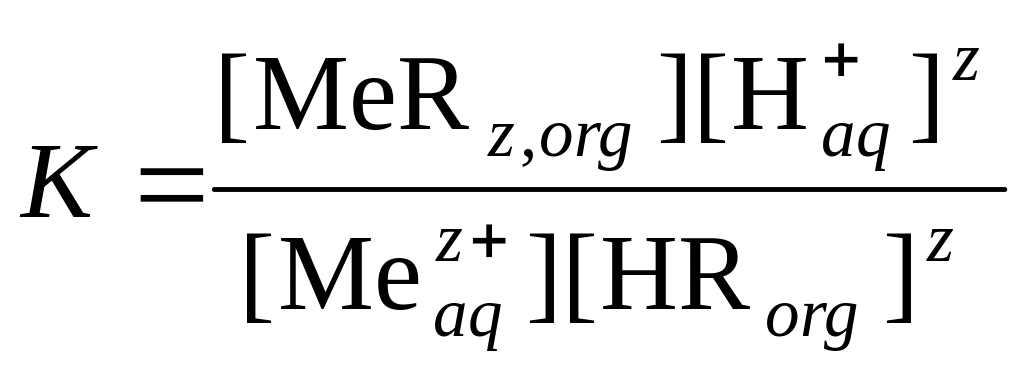 .
.
![]() ,
,
тогда
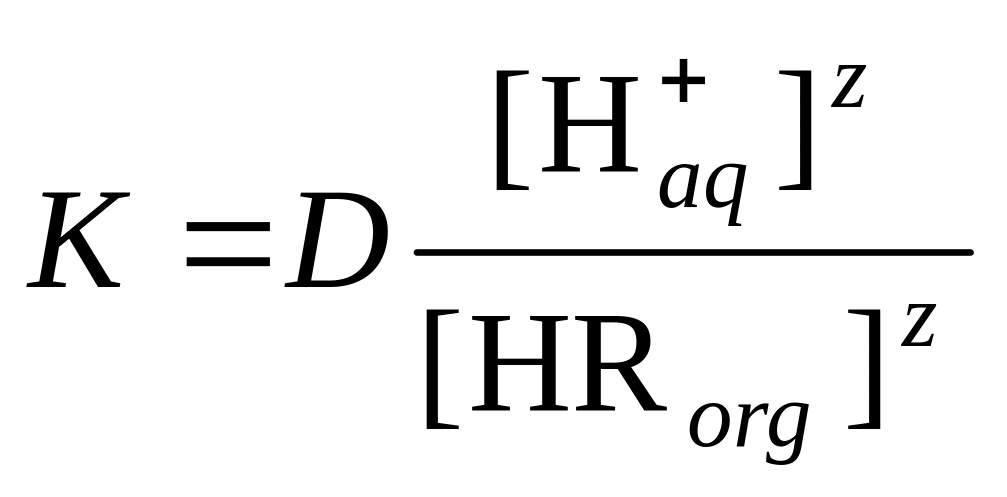 .
.
После логарифмирования и небольших преобразований получаем уравнение
![]() ,
,
которое связывает константу равновесия и коэффициент распределения, а также показывает зависимость коэффициента распределения от концентрации экстрагента и рН.
Получив экспериментальную зависимость коэффициента распределения от, например, рН при постоянной концентрации экстрагента можно определить сольватное число z и константу равновесия процесса экстракции.
