
- •Введение
- •Обработка результатов физико-химических измерений Погрешность измерений
- •Выражение результатов измерений и расчетов
- •Термохимия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Коллигативные свойства растворов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 4. Криометрия
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в однокомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №5. Давление насыщенного пара
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в двухкомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №6. Получение кривой разгонки
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Распределение вещества в двухфазной системе. Экстракция Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Электропроводность растворов электролитов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №11. Определение чисел переноса ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Термодинамика электрохимических систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 12. Определение стандартных электродных потенциалов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Определение коэффициента активности электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Ионометрия и рН-метрия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Строение вещества. Молекулярные спектры Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Химическая кинетика Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 16. Определение константы скорости реакции окисления иодида калия персульфатом аммония
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
- •Молекулярная адсорбция
- •Адсорбция на поверхности раздела жидкость – газ
- •Адсорбция на поверхности твердого тела
- •Ионообменная адсорбция
- •Контрольные вопросы
- •Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор пав - воздух
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная работа № 19. Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 20. Исследование обменной адсорбции ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №22. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Устойчивость дисперсных систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 23. Получение лиофобных золей
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 24. Определение порога коагуляции визуальным методом
- •Выполнение работы
- •I. Приблизительное определение порога коагуляции
- •Содержание протокола лабораторной работы
- •II. Уточнение значения порога коагуляции
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом Краткие теоретические сведения
- •Контрольные вопросы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Содержание протокола лабораторной работы
Объем воды, V(H2O) = …, мл.
Масса воды, m(H2O) = …, г.
Температура замерзания чистой воды:
Tкр(Н2О)1 = …;
Tкр(Н2О)2 = …;
Tкр(Н2О)средняя = …
Название исследуемого вещества и его химическая формула.
Масса навески mр.в., г.
Температура кристаллизации раствора:
Tкр(р-р)1 = ……
Tкр(р-р)2 = ……
Tкр(р-р)средняя = ……
Обработка результатов эксперимента
В зависимости от задания (по указанию преподавателя)
1. рассчитать молярную массу растворенного вещества по уравнению:
![]() ,
,
где mр.в. – масса растворенного вещества, г; mр-ля – масса растворителя (вода), кг; Kкр криоскопическая постоянная растворителя, 1,86 Ккг/моль; крТ – изменение температуры замерзания раствора.
2. Вычислить изотонический коэффициент по уравнению:
![]() ,
,
где
![]() – молярная масса вещества до растворения
(по таблице Менделеева), г/моль; М2
– молярная масса вещества в растворе
(см. п. 1).
– молярная масса вещества до растворения
(по таблице Менделеева), г/моль; М2
– молярная масса вещества в растворе
(см. п. 1).
3. Оценить относительную инструментальную погрешность измерения молярной массы растворенного вещества или изотонического коэффициента:
 ,
,
где – абсолютная погрешность измерения данной величины.
4. Определить абсолютную инструментальную погрешность отдельного измерения М и i и записать окончательно ответ в виде:
Мр.в. = Мр.в. Мр.в. = ……., г/моль;
i = i i = ……..
5. Сделать вывод о состоянии растворенного вещества в растворе.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Фазовые равновесия в однокомпонентных системах Краткие теоретические сведения
При изучении свойств гетерогенных систем широко используется метод, получивший название физико-химический анализ и основанный на графическом изображении зависимости между составом и свойствами системы с помощью диаграммам состояния. Поскольку однокомпонентные системы отражают свойства одного вещества, простого или сложного, химический состав которого постоянен и на свойства которого влияют лишь внешние независимые переменные (температура Т и давление Р), диаграммы состояния таких систем могут быть изображены на плоскости в координатах Р-Т или P-V.
На рис.8 в качестве примера изображена простейшая диаграмма состояния однокомпонентной системы, например Н2О в координатах Р-Т.
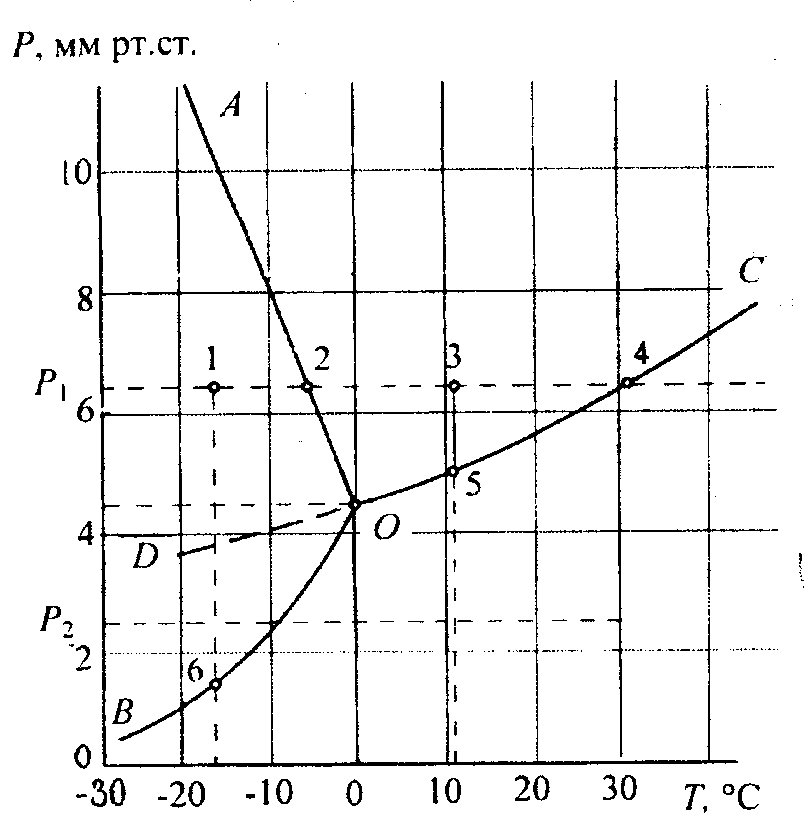
Рис. __________. Диаграмма состояния воды при низком давлении Р0 = 4,6 мм рт. ст. Т0 = 0,0076°С
Линии ОА, ОС и ОВ разделяют диаграмму на три поля, показывающие области существования трех устойчивых агрегатных состояний вещества: твердого, жидкого и газообразного. На линиях диаграммы в равновесии находятся две фазы: на линии испарения (или конденсации) OС – газ и жидкость, на линии плавления (или кристаллизации) ОА – жидкая и твердая фазы, а на линии возгонки (сублимации) ОB – твердая фаза и пары. Каждая линия диаграммы показывает зависимость температуры соответствующего фазового превращения от внешнего давления или давления насыщенных паров над жидкой (линия ОС) или твердой (линия ОВ) фазами. Наклон этих линий определяется соотношением плотностей фаз, находящихся в равновесии. Точка О, в которой пересекаются три линии фазовых переходов называется тройной точкой, показывающей температуру Т0 и давление Р0, при которых могут сосуществовать в безвариантном равновесии одновременно три фазы.
Ход линий диаграммы описывается уравнением Клаузиуса–Клапейрона, которое в дифференциальной форме имеет вид:
![]() ,
,
где ΔtrH – изменение энтальпии (теплота) фазового перехода, Дж/моль; Ttr – температура фазового перехода, K; ΔV – изменение объема в процессе фазового перехода, м3.
На практике используют различные формы уравнения Клаузиуса-Клайперона, учитывающие особенности протекания того или иного процесса.
Для описания переходов между конденсированными фазами (процессы плавления-кристаллизации), учитывая сравнительно небольшую зависимость температуры перехода между конденсированными фазами от давления применяют следующую форму уравнения Клаузиуса-Клапейрона:
![]() ,
,
где Tm – температура плавления, K; ΔmH – теплота плавления, Дж/моль.
При фазовых превращениях жидкость – газ (испарение, конденсация) и твердое – газ (возгонка, сублимация), если процесс протекает вдали от критической точки, то объем данного количества вещества в парообразном состоянии намного больше его объема в жидком и тем более твердом состоянии и ΔV ≈ Vg = RT/p. В этом случае уравнение Клаузиуса-Клапейрона может быть преобразовано к виду:
![]() или
или
![]() ,
,
где ΔvН – теплота испарения, Дж/моль; ΔsН – теплота сублимации (возгонки), Дж/моль.
При температуре кипения жидкости или температуре, необходимой для возгонки твердого вещества, давление насыщенного пара равно внешнему давлению, поэтому по уравненю Клаузиуса-Клапейрона можно определить зависимость температуры кипения (возгонки) от внешнего давления.
Теплота при испарении (возгонке)
также зависит от температуры: с повышением
температуры теплота уменьшается. При
критической температуре теплота
испарения становится равной нулю. Однако
при температуре, далекой от критической,
влияние ее на теплоту испарения
незначительно и поэтому для сравнительно
узкого интервала температур среднее
значение теплоты испарения (возгонки)
можно принять постоянным. В этом случае
![]() ,
которое является уравнением прямой в
координатах lnp
– 1/T.
,
которое является уравнением прямой в
координатах lnp
– 1/T.
По зависимости давления насыщенного пара от температуры можно также определить изменение энтропии процесса. Для этого строят зависимость в координатах lnp – 1/T, по величине углового коэффициента прямой определяют среднюю теплоту процесса испарения и вычисляют изменение энтропии испарения по формуле:
![]() ,
,
где Tv – температура кипения жидкости при нормальном (1 атм.) давлении, принимая при этом, что в небольшом температурном интервале значение ΔvН остается постоянным.
По правилу Трутона для многих недиссоциированных жидкостей изменение энтропии составляет 88±4 Дж·моль−1·K−1. Значительные положительные отклонения от этого значения указывают на заметную ассоциацию молекул жидкости.
Способы измерения давления пара различных жидкостей зависят от того, насколько летучим является исследуемое вещество. Для мало летучих веществ часто пользуются методом уноса, заключающимся в том, что над поверхностью жидкости медленно пропускают сухой газ, например, воздух, который при этом насыщается парами жидкости. Увлеченные газом пары улавливаются поглотителем (для паров воды можно использовать, например, безводный хлорид кальция), а затем по объему пропущенного газа и массе уловленных поглотителем паров вычисляется давление пара по уравнению Менделеева-Клапейрона.
Для легко летучих веществ применяют статический способ, заключающийся в непосредственном измерении давления пара над жидкостью манометром в замкнутой системе, откуда предварительно удалены посторонние газы и пары.
Для жидкостей средней летучести применяют динамический метод, основанный на том, что давление насыщенного пара при температуре кипения жидкости равно внешнему давлению. Зависимость давления паров жидкости от температуры получают, доводя жидкость до кипения при различных внешних давлениях и измеряя соответствующие им температуры кипения.
