
- •Введение
- •Обработка результатов физико-химических измерений Погрешность измерений
- •Выражение результатов измерений и расчетов
- •Термохимия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Коллигативные свойства растворов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 4. Криометрия
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в однокомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №5. Давление насыщенного пара
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Фазовые равновесия в двухкомпонентных системах Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа №6. Получение кривой разгонки
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Распределение вещества в двухфазной системе. Экстракция Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Электропроводность растворов электролитов Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №11. Определение чисел переноса ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Термодинамика электрохимических систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 12. Определение стандартных электродных потенциалов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Определение коэффициента активности электролита
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Ионометрия и рН-метрия Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Строение вещества. Молекулярные спектры Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Химическая кинетика Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 16. Определение константы скорости реакции окисления иодида калия персульфатом аммония
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
- •Молекулярная адсорбция
- •Адсорбция на поверхности раздела жидкость – газ
- •Адсорбция на поверхности твердого тела
- •Ионообменная адсорбция
- •Контрольные вопросы
- •Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор пав - воздух
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная работа № 19. Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 20. Исследование обменной адсорбции ионов
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа №22. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Устойчивость дисперсных систем Краткие теоретические сведения
- •Контрольные вопросы
- •Лабораторная работа № 23. Получение лиофобных золей
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 24. Определение порога коагуляции визуальным методом
- •Выполнение работы
- •I. Приблизительное определение порога коагуляции
- •Содержание протокола лабораторной работы
- •II. Уточнение значения порога коагуляции
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом Краткие теоретические сведения
- •Контрольные вопросы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Содержание протокола лабораторной работы
Концентрация стандартного раствора хлорида аммония
Концентрация раствора серной кислоты (титранта)
Объем пробы раствора аммиака, взятой для его анализа титрованием, мл
Объем серной кислоты, израсходованный для титрования пробы аммиака, мл: V1, V2, Vсреднее.
Таблица 1
Данные измерений ЭДС контрольных растворов
№ раствора |
С(), моль/кг |
Е, В |
1 |
|
|
2 |
|
|
3 |
|
|
Таблица 2
Результаты измерений ЭДС и рН растворов аммиака
№ раствора |
С, моль/л |
Е, В |
рН |
1 |
«исходный» |
|
|
2 |
1/10 |
|
|
3 |
1/100 |
|
|
Обработка экспериментальных данных
1. Определить аналитическую концентрацию исходного раствора аммиака по формуле:
![]()
и вычислить концентрации разбавленных растворов.
2. Построить градуировочную зависимость в координатах Е – рС по данным ионометрического анализа контрольных растворов, где рС = −lgC( ).
3. По градуировочной зависимости определить концентрацию ионов аммония в каждом растворе аммиака.
4. Вычислить степень диссоциации
1 по полученным
экспериментальным данным по формуле:
![]()
5. Определить по данным рН концентрации гидроксид-ионов для каждого раствора:
[OH−] = 10 – (14 – pH)
6. Вычислить степень диссоциации
2:
![]() .
.
7. По полученным значениям 1
и 2 рассчитать
значения констант диссоциации Kd1
и Kd2:
![]() .
.
7. Результаты вычислений занести в таблицу:
№ |
[NH4OH], моль/л |
Е, В |
рNH4 |
[ |
1 |
Kd1 |
pH |
[OH−], моль/л |
2 |
Kd2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() ,
,
Результат представляют в конечном виде:
K = Kd, ср K = …..
И определяют отклонение от справочных данных:
![]() .
.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Строение вещества. Молекулярные спектры Краткие теоретические сведения
Спектры возникают при переходе системы (например, молекулы) из одного стационарного состояния в другое. При этом система поглощает или испускает энергию в виде кванта, величина которого равна разности энергий двух состояний:
h = E2 − E1,
где h – постоянная Планка, - частота света.
Благодаря поглощению веществом лучистой энергии в определенной области спектра свет, прошедший через индивидуальную жидкость или раствор, имеет в этой области интенсивность I меньшую, чем интенсивность падающего света I0. Уменьшение интенсивности светового потока зависит от числа поглощающих молекул, т.е. от толщины светопоглощающего слоя l и концентрации вещества в растворе С. Для монохроматического излучения зависимость интенсивности поглощаемого света от числа поглощающих молекул описывается законом Бугера-Ламберта-Бера:
![]() в экспоненциальной форме
в экспоненциальной форме
или
![]() в логарифмической форме,
в логарифмической форме,
где - коэффициент поглощения, зависящий от единиц измерения концентрации и толщины слоя: если концентрация выражена в моль/л, то называют молярным коэффициентом поглощения; численно равен обратной толщине слоя жидкости с единичной концентрацией (например, 1 моль/л), уменьшающей интенсивность света в 10 раз. D – оптическая плотность, соотношение (I/I0) называется пропусканием.
Закон Бугера-Ламберта-Беера справедлив только для газов и достаточно разбавленных растворов в инертных растворителях.
Оптическая плотность зависит от длины волны поглощаемого света. График этой зависимости называется спектром поглощения. Спектр поглощения вещества обычно представляет собой набор полос различной интенсивности и ширины. Каждая полоса связана с электронными переходами внутри молекулы поглощающего свет вещества. Положение максимума определяется происходящим при поглощении изменением энергии системы. Чем меньше энергия, требуемая для переноса электрона, тем ниже частота поглощенного кванта света, и максимум поглощения находится в более длинноволновой части спектра. Вещества, избирательно поглощающие свет в области 380 – 780 нм, окрашены.
С помощью фотометрического исследования окрашенных комплексов в растворах можно определить состав и константу нестойкости этих комплексов. Константой нестойкости называют константу равновесия диссоциации комплекса на составляющие его ионы или молекулы. При этом различают ступенчатые и общие Kn константы нестойкости. Ступенчатые константы описывают процессы последовательного, постадийного отделения лигандов по схеме:
![]() ,
,
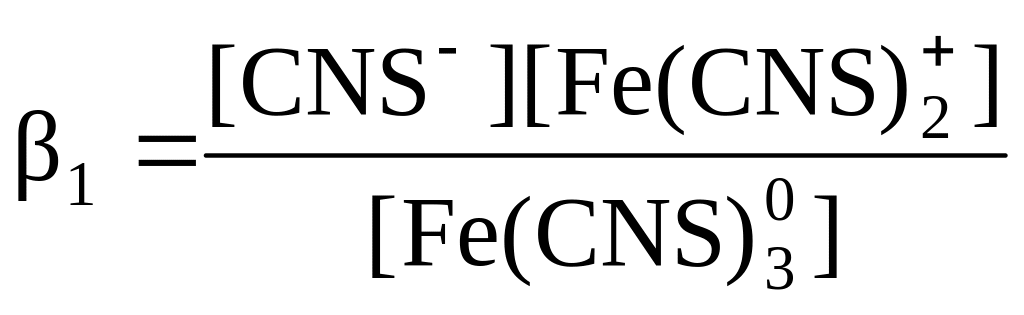 .
.
![]() ,
,
![]() .
.
![]() ,
,
![]() .
.
Суммарный процесс описывает уравнение:
![]()
с общей константой нестойкости:
![]() .
.
В условиях избытка тиоцианат-иона,
т.е. при
![]() ,
можно считать концентрацию тиоцианат-ионов
приближенно равной заданной в системе
концентрации тиоцианата калия (аммония):
[CNS]
[KCNS], а убылью тиоцианат-ионов за счет
связывания в комплекс с железом
пренебречь. Согласно закону
Бугера-Ламберта-Бера:
,
можно считать концентрацию тиоцианат-ионов
приближенно равной заданной в системе
концентрации тиоцианата калия (аммония):
[CNS]
[KCNS], а убылью тиоцианат-ионов за счет
связывания в комплекс с железом
пренебречь. Согласно закону
Бугера-Ламберта-Бера:
![]()
и концентрация свободных ионов железа может быть вычислена по уравнению:
![]() .
.
Подставим полученные выражения для концентраций и в уравнение для константы нестойкости:
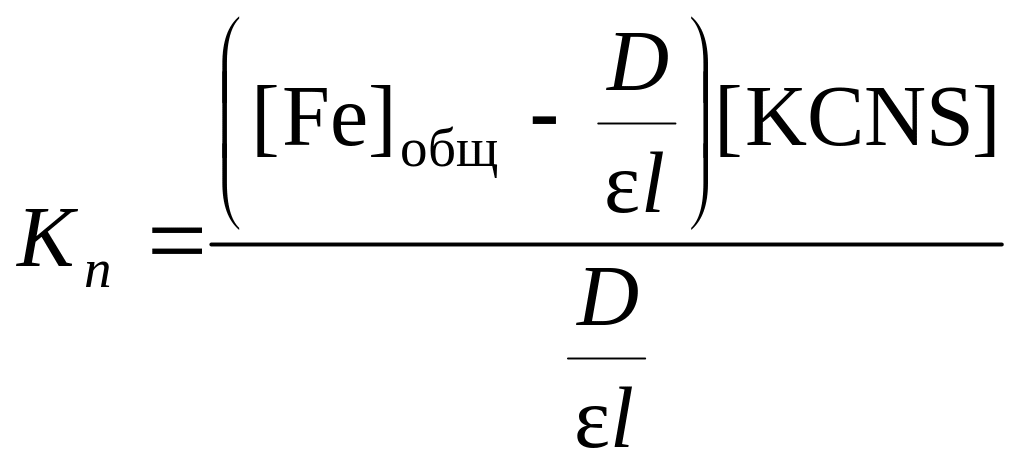 .
.
Данное уравнение можно привести к виду:
![]() .
.
З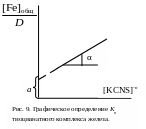 адавая
ряд значений концентрации тиоцианата
калия, строят графическую зависимость
в координатах, указанных на рис. 9.
Экстраполяцией линейной зависимости
на нуль получают на оси ординат отрезок
адавая
ряд значений концентрации тиоцианата
калия, строят графическую зависимость
в координатах, указанных на рис. 9.
Экстраполяцией линейной зависимости
на нуль получают на оси ординат отрезок
![]() ,
а тангенс угла наклона позволяет
вычислить константу нестойкости:
,
а тангенс угла наклона позволяет
вычислить константу нестойкости:
![]() .
Таким образом:
.
Таким образом:
![]() и
и
![]() .
.
Следует отметить, что данная зависимость будет линейной только в той области концентраций тиоцианат-иона, в которой в растворе преобладает комплекс с определенным координационным числом n. В общем случае на графике по оси абсцисс следует откладывать значения [KSCN]−n, где n = 1, 2, 3, 4. Кривые будут иметь линейные участки в области преобладания в растворе комплексов с данным n, которым можно определить и Kn этих комплексов.
По значениям констант нестойкости определяют энергии Гиббса образования тиоцианатных комплексов железа (III) по n ступеням:
![]() ,
,
![]() .
.
Свободная энергия диссоциации комплекса на ионы равна:
![]() .
.
С другой стороны, по закону Гесса:
![]()
отсюда свободная энергия образования комплексов равна:
![]()
Значения энергий Гиббса образования ионов железа (3+) и тиоцианат-иона берут из справочника.
Таким образом, фотометрический метод позволяет определить константы нестойкости и энергии образования комплексных ионов в растворах, которые используют для расчета ионных равновесий, например, растворимости солей и минералов в присутствии комплексообразующих лигандов.
