
- •Работа 1 растворы. Кислотно-основное титрование
- •Основные теоретические положения
- •Индикаторы кислотно-основного титрования
- •Порядок выполнения работы
- •Часть 1. Определение состава анализируемого раствора методом прямого титрования
- •Экспериментальные и расчетные данные, полученные по методу прямого титрования
- •Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования
- •Экспериментальные и расчетные данные, полученные методом потенциометрического титрования
- •Изменение рН анализируемого раствора от объема титранта
- •Часть 1. Определение состава анализируемого раствора методом прямого титрования
- •Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования.
- •Контрольные задания Вариант 1
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 произведение растворимости
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 3 гидролиз солей
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение среды растворов различных солей
- •Часть 2. Смещение гидролитических равновесий
- •Экспериментальные и расчетные данные
- •Экспериментальные и расчетные данные
- •Часть 1. Определение среды растворов различных солей
- •Часть 2. Смещение гидролитических равновесий
- •Контрольные задания
- •Комплексные соединения
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Определение жесткости воды
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение временной жесткости воды
- •Определение временной жесткости воды
- •Часть 2. Определение общей жесткости воды
- •Определение общей жесткости воды
- •Часть 1. Определение временной жесткости воды
- •Часть 2. Определение общей жесткости воды
- •Часть 3. Определение постоянной жесткости воды
- •Определение жесткости воды
- •Контрольные задания
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Приложение 1 Метрологическая карта средств измерения
- •Приложение 2 Значения произведения растворимости труднорастворимых в воде веществ при температуре 25 °с
- •Приложение 3 Константы диссоциации воды
- •Приложение 4 Константы диссоциации некоторых электролитов в водных растворах (при температуре 25 °с)
- •Часть 2
- •162600, Г. Череповец, пр. Луначарского, 5
Изменение рН анализируемого раствора от объема титранта
V(Т), см3 |
0 |
|
|
|
|
|
|
|
|
|
рН |
|
|
|
|
|
|
|
|
|
|
Обработка экспериментальных данных
Часть 1. Определение состава анализируемого раствора методом прямого титрования
1.
Найти средний объем титранта
![]() ,
см3,
израсходованный на титрование, по
формуле
,
см3,
израсходованный на титрование, по
формуле
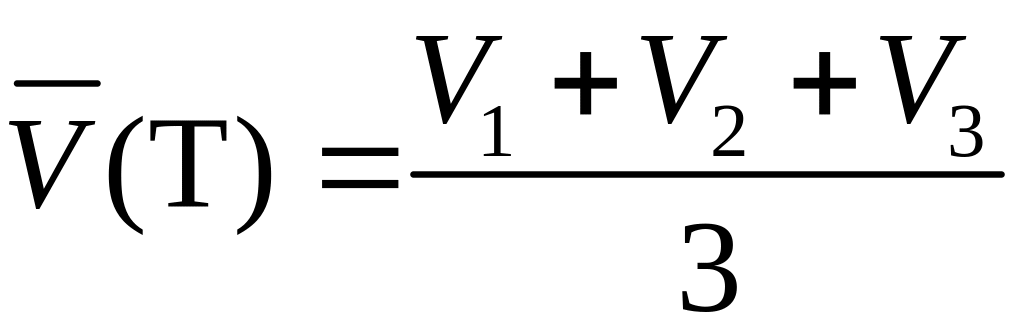 ,
,
где V1, V2 и V3 – объем титранта в см3, определенный в первом, втором и третьем опытах соответственно.
2. Экспериментальную молярную концентрацию эквивалента анализируемого раствора Сэ (А)эксп, моль/дм3, определить, исходя из уравнения (1), по формуле
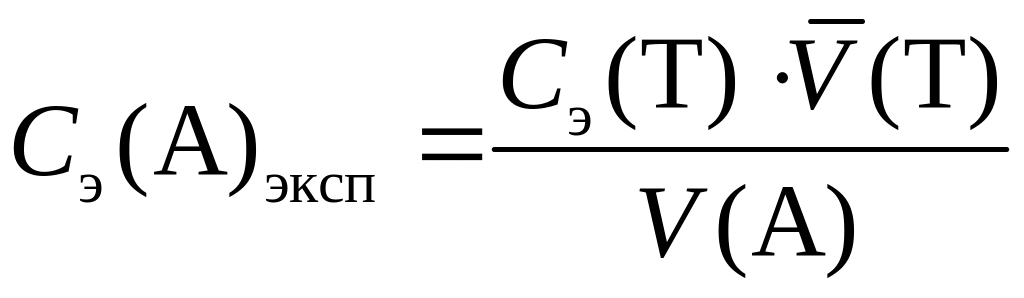 .
.
3. Вычислить относительную погрешность определения концентрации по методу прямого титрования по формуле
П =
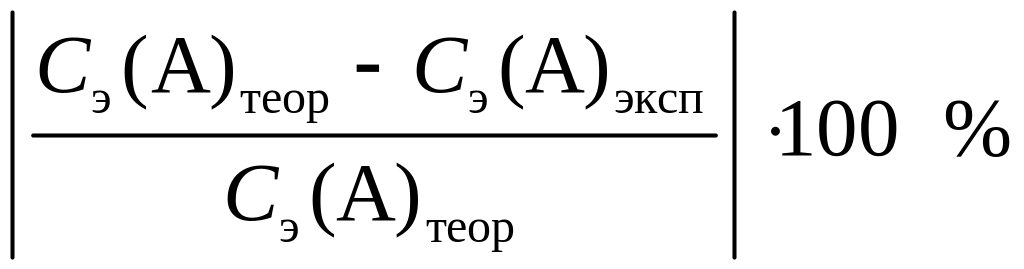 .
(2)
.
(2)
5. Результаты расчетов занести в табл. 2.
6. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы.
Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования.
1. По данным табл. 4 на масштабно-координатной бумаге построить интегральную кривую титрования, откладывая по оси ординат значения рН, а по оси абсцисс – значения объема титранта V(Т) в см3.
2. На графике провести прямую линию (иначе линию нейтральности), параллельную оси абсцисс, при значении рН = 7 до пересечения с кривой титрования. Точка пересечения кривой титрования с линией нейтральности называется точкой нейтральности.
3. На графике провести вторую прямую линию, параллельную оси ординат, через точку нейтральности. Данная линия называется линией эквивалентности.
4. Точка пересечения линии нейтральности с линией эквивалентности – точка эквивалентности. По графику в точке эквивалентности определить объем раствора титранта V(Т) в см3. Данные занести в табл. 3.
5. Экспериментальную молярную концентрацию эквивалента анализируемого раствора Сэ (А)эксп, моль/дм3, определить, исходя из уравнения (1), по формуле
 .
.
6. Вычислить относительную погрешность определения концентрации методом прямого титрования по формуле (2).
7. Результаты расчетов занести в табл. 3.
8. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы.
Контрольные задания Вариант 1
1. Сколько литров раствора НCl c эквивалентной концентрацией 0,5 моль/дм3 потребуется для реакции с 5 л раствора NaOH, эквивалентная концентрация которого равна 1,3 моль/дм3.
2. Найти массовое процентное содержание нитрата серебра в растворе, если эквивалентная концентрация такого раствора равна 0,64 моль/дм3. Плотность раствора принять равной 1,088 г/см3.
3. Вычислить молярную концентрацию сульфата калия, в 0,02 л которого содержится 2,74 г растворенного вещества.
Вариант 2
1. На нейтрализацию 1 л раствора, содержащего 25 г Н2SO4, требуется 250 см3 раствора щелочи. Вычислить эквивалентную концентрацию раствора щелочи.
2. Рассчитать молярную и эквивалентную концентрации 49 %-ного раствора фосфорной кислоты, плотность которого равна 1,33 г/см3.
3. К 100 г 25 %-ного раствора прилили 50 г воды. Вычислить процентную концентрацию полученного раствора.
Вариант 3
1. Для нейтрализации 30 мл раствора щелочи с концентрацией 0,15 моль/дм3 потребовалось 12 мл раствора кислоты. Определить концентрацию кислоты.
2. Вычислить молярную и эквивалентную концентрации 96 %-ного раствора серной кислоты (ρ = 1,84 г/см3).
3. Какая масса хлорида бария содержится в 0,025 л раствора с эквивалентной концентрацией 0,25 моль/л.
Вариант 4
1. На нейтрализацию 100 мл раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислить эквивалентную концентрацию раствора кислоты.
2. Определить молярную и эквивалентную концентрации 50 %-ного раствора серной кислоты (ρ = 1,40 г/см3).
3. К 250 г 15 %-ного раствора добавили 100 г воды и 3 г соли. Рассчитать процентную концентрацию полученного раствора.
Вариант 5
1. На нейтрализацию 30 см3 раствора щелочи с эквивалентной концентрацией 0,16 моль/дм3 требуется 217 см3 раствора H2SO4. Вычислить эквивалентную концентрацию раствора H2SO4.
2. Рассчитать молярную и эквивалентную концентрации 10 %-ного раствора хлорида бария (ρ = 1,012 г/см3).
3. В 500 мл раствора содержится 45 г сульфата алюминия. Определить молярную и эквивалентную концентрации раствора.
