
- •Работа 1 растворы. Кислотно-основное титрование
- •Основные теоретические положения
- •Индикаторы кислотно-основного титрования
- •Порядок выполнения работы
- •Часть 1. Определение состава анализируемого раствора методом прямого титрования
- •Экспериментальные и расчетные данные, полученные по методу прямого титрования
- •Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования
- •Экспериментальные и расчетные данные, полученные методом потенциометрического титрования
- •Изменение рН анализируемого раствора от объема титранта
- •Часть 1. Определение состава анализируемого раствора методом прямого титрования
- •Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования.
- •Контрольные задания Вариант 1
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 произведение растворимости
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 3 гидролиз солей
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение среды растворов различных солей
- •Часть 2. Смещение гидролитических равновесий
- •Экспериментальные и расчетные данные
- •Экспериментальные и расчетные данные
- •Часть 1. Определение среды растворов различных солей
- •Часть 2. Смещение гидролитических равновесий
- •Контрольные задания
- •Комплексные соединения
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Определение жесткости воды
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение временной жесткости воды
- •Определение временной жесткости воды
- •Часть 2. Определение общей жесткости воды
- •Определение общей жесткости воды
- •Часть 1. Определение временной жесткости воды
- •Часть 2. Определение общей жесткости воды
- •Часть 3. Определение постоянной жесткости воды
- •Определение жесткости воды
- •Контрольные задания
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Приложение 1 Метрологическая карта средств измерения
- •Приложение 2 Значения произведения растворимости труднорастворимых в воде веществ при температуре 25 °с
- •Приложение 3 Константы диссоциации воды
- •Приложение 4 Константы диссоциации некоторых электролитов в водных растворах (при температуре 25 °с)
- •Часть 2
- •162600, Г. Череповец, пр. Луначарского, 5
Работа 3 гидролиз солей
Цель работы: получить общие представления о гидролизе солей; познакомиться с различными случаями гидролиза; изучить факторы, влияющие на сдвиг гидролитических равновесий.
Основные теоретические положения
Гидролизом соли называют процесс взаимодействия ионов соли с молекулами воды, который сопровождается изменением рН раствора. Гидролиз протекает только тогда, когда при взаимодействии ионов соли и воды образуются малодиссоциированные вещества. Известны следующие виды гидролиза солей.
Гидролиз по аниону
В этом случае гидролизуются соли сильного основания и слабой кислоты, при этом реакция среды становится щелочной (рН > 7).
Например:
СН3СООK ® СН3СОО – + K+;
K+ + HOH ® реакция практически не идет;
СН3СОО – + HOH Û СН3СООН + ОН –, рН > 7 .
Молекулярное уравнение гидролиза имеет вид
СН3СООK + HOH Û СН3СООН + KОН .
Если анион многозарядный, то гидролиз протекает ступенчато.
Например:
Na2S + HOH Û NaHS + NaOH;
I ступень гидролиза: S2– + HOH Û HS – + OH –;
II ступень гидролиза: HS – + HOH Û H2S + OH – .
Накапливающиеся в растворе ионы ОН – препятствуют протеканию II ступени гидролиза, поэтому практически гидролиз идет только по I ступени.
Гидролиз по катиону
В этом случае гидролизуются соли слабого основания и сильной кислоты, при этом реакция среды становится кислой (рН < 7).
Например:
NH4Cl ® NH4+ + Cl – ;
Cl – + HOH ® реакция практически не идет;
NH4+ + HOH Û NH4OH + H+, рН < 7.
Молекулярное уравнение гидролиза
NH4Cl + HOH Û NH4OH + HCl .
Гидролиз по катиону и аниону одновременно
Такому виду гидролиза подвергаются соли слабого основания и слабой кислоты. В реакции участвуют и катион, и анион соли. Реакция среды определяется относительной силой образующихся слабой кислоты и слабого основания. При этом возможны три случая:
– если константа диссоциации кислоты Kкислоты больше константы диссоциации основания Kосн, то преобладает гидролиз по катиону и рН < 7;
– если Kкислоты < Kосн , то преобладает гидролиз по аниону и рН > 7;
– если Kкислоты Kосн , то рН » 7.
Необратимый полный гидролиз
Если кислота и основание, образующие соль, являются не только слабыми электролитами, но и малорастворимы в воде или неустойчивы и разлагаются с образованием газообразных продуктов, то гидролиз, как правило, протекает практически необратимо.
Например:
Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S ;
2Al3+ + 3S2– + 6HOH ® 2Al(OH)3¯ + 3H2S .
Количественными характеристиками глубины протекания гидролиза являются степень гидролиза h и константа гидролиза Kг.
Степень гидролиза h показывает, какая часть соли находится в гидролизованном состоянии и выражается в долях единицы или в процентах
h = Сг / С2 ,
где Сг – концентрация гидролизованной части соли, моль/дм3; С2 – общая концентрация растворенной соли, моль/дм3.
Расчет константы гидролиза Kг , степени гидролиза h и рН раствора следует вести по формулам:
при гидролизе по аниону
Kг
=
 ;
h
=
;
h
=
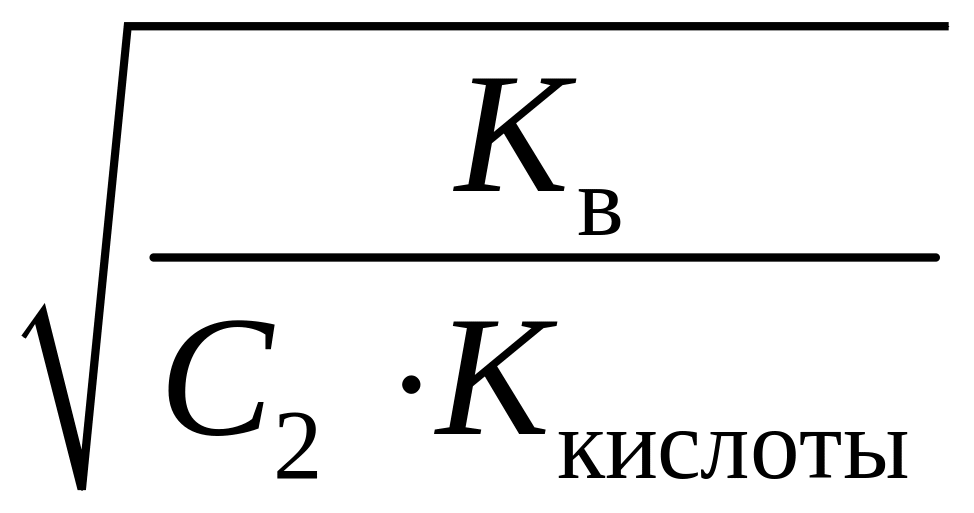 =
=
![]() ,
(5)
,
(5)
где Kкислоты – константа диссоциации слабой кислоты; Kв – ионное произведение воды.
рН
= 14 + lg![]() ;
(6)
;
(6)
2) при гидролизе по катиону
Kг
=
![]() ;
h
=
;
h
=
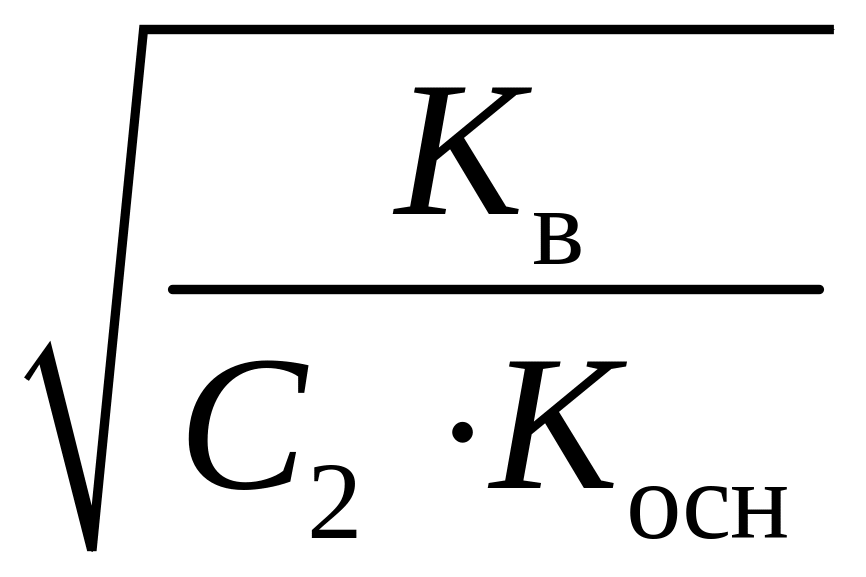 =
;
рН = –lg
,
(7)
=
;
рН = –lg
,
(7)
где Kосн – константа диссоциации слабого основания;
3) при гидролизе по катиону и аниону одновременно:
Kг
=
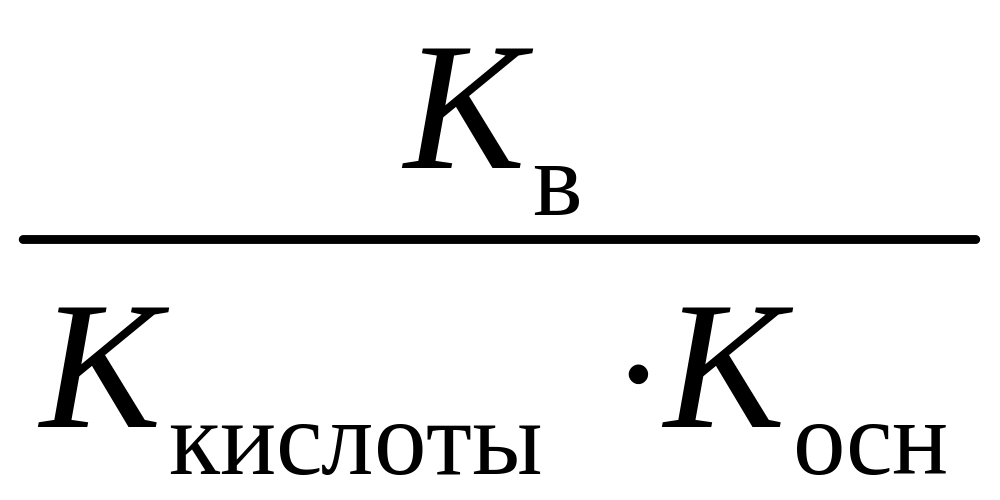 ;
h
=
;
h
=
![]() ;
рН = –lg
;
рН = –lg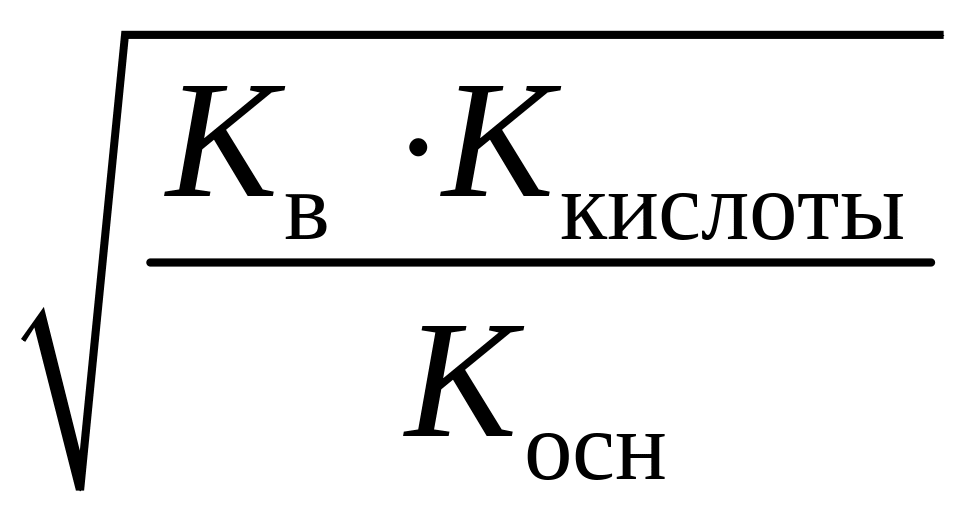 .
(8)
.
(8)
Гидролиз – это частный случай реакций ионного обмена, поэтому на равновесие этого процесса оказывают влияние все факторы, от которых зависят ионные равновесия. Таким образом, смещение гидролитических равновесий может происходить в следующих случаях:
– при добавлении в равновесную смесь одного из продуктов гидролиза (кислоты при гидролизе по катиону или основания при гидролизе по аниону), тогда в соответствии с принципом Ле Шателье равновесие смещается в обратном направлении, то есть в сторону «подавления» гидролиза соли;
– при уменьшении концентрации соли в растворе (при разбавлении системы) равновесие гидролиза смещается в сторону образования продуктов;
– при нагревании растворов солей гидролиз усиливается.
