
- •Работа 1 растворы. Кислотно-основное титрование
- •Основные теоретические положения
- •Индикаторы кислотно-основного титрования
- •Порядок выполнения работы
- •Часть 1. Определение состава анализируемого раствора методом прямого титрования
- •Экспериментальные и расчетные данные, полученные по методу прямого титрования
- •Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования
- •Экспериментальные и расчетные данные, полученные методом потенциометрического титрования
- •Изменение рН анализируемого раствора от объема титранта
- •Часть 1. Определение состава анализируемого раствора методом прямого титрования
- •Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования.
- •Контрольные задания Вариант 1
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 произведение растворимости
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 3 гидролиз солей
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение среды растворов различных солей
- •Часть 2. Смещение гидролитических равновесий
- •Экспериментальные и расчетные данные
- •Экспериментальные и расчетные данные
- •Часть 1. Определение среды растворов различных солей
- •Часть 2. Смещение гидролитических равновесий
- •Контрольные задания
- •Комплексные соединения
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Определение жесткости воды
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение временной жесткости воды
- •Определение временной жесткости воды
- •Часть 2. Определение общей жесткости воды
- •Определение общей жесткости воды
- •Часть 1. Определение временной жесткости воды
- •Часть 2. Определение общей жесткости воды
- •Часть 3. Определение постоянной жесткости воды
- •Определение жесткости воды
- •Контрольные задания
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Приложение 1 Метрологическая карта средств измерения
- •Приложение 2 Значения произведения растворимости труднорастворимых в воде веществ при температуре 25 °с
- •Приложение 3 Константы диссоциации воды
- •Приложение 4 Константы диссоциации некоторых электролитов в водных растворах (при температуре 25 °с)
- •Часть 2
- •162600, Г. Череповец, пр. Луначарского, 5
Порядок выполнения работы
Приборы и реактивы: иономер, стеклянный и хлорсеребряный электроды, магнитная мешалка, стакан химический вместимостью 100 см3, электрическая плитка, термометр, мерные колбы вместимостью 100 см3, штатив с пробирками, пипетка Мора на 10 см3, дистиллированная вода, навески солей: Na2CO3, AlCl3, Na3PO4, ZnSO4, NH4Cl; 5 %-ные растворы солей: KCl, Na2SO4, Na2CO3, Na3PO4, Al2(SO4)3, ZnSO4, Cr2(SO4)3; 0,1 M раствор CH3COONa; индикаторы: растворы фенолфталеина и лакмуса.
Х о д р а б о т ы
Часть 1. Определение среды растворов различных солей
Опыт 1. Налить в две пробирки по 1 см3 растворов солей: хлорида калия и сульфата натрия, а в третью пробирку – дистиллированной воды. В каждую пробирку добавить по 2 капли лакмуса. Как изменился цвет индикатора? Указать среду каждого раствора. Подвергаются ли данные соли гидролизу?
Опыт 2. Налить в две пробирки по 1 см3 растворов карбоната натрия и фосфата натрия, а в третью пробирку – дистиллированной воды. В каждую пробирку добавить по 2 капли фенолфталеина. Оценить окраску и определить среду в каждом растворе. Подвергаются ли данные соли гидролизу?
Опыт 3. Налить в две пробирки по 1 см3 растворов сульфата алюминия и сульфата цинка, а в третью пробирку – дистиллированной воды. В каждую пробирку добавить по 2 капли лакмуса. Отметить, как изменился цвет индикатора, и определить среду в растворах. Подвергаются ли данные соли гидролизу?
Опыт 4. Полный необратимый гидролиз. В пробирку поместить 1 см3 раствора сульфата хрома (III) и прибавить по каплям раствор карбоната натрия до образования осадка малорастворимого соединения. Отметить цвет осадка. Почему при взаимодействии растворов этих солей гидролиз протекает практически необратимо?
Часть 2. Смещение гидролитических равновесий
Опыт 5. Смещение равновесия под действием температуры. В химический стакан налить 100 см3 0,1 М раствора ацетата натрия. В раствор поместить магнитную мешалку и электроды. Через 1–2 минуты измерить начальную температуру раствора. Измерить значение рН раствора, данные занести в табл. 5. Раствор подогреть до температуры 70 ºC и снова измерить рН раствора. Данные внести в табл. 5. Нагреть раствор еще на 10 ºC, измерить рН и записать значения в табл. 5.
Таблица 5
Экспериментальные и расчетные данные
Формула соли |
Температура, ºC |
Kг |
Значение рН |
|
расчетное |
экспериментальное |
|||
|
Тначальная |
|
|
|
70 |
|
|
|
|
80 |
|
|
|
|
Опыт 6. Смещение равновесия при изменении концентрации раствора.
1. Получить (по указанию преподавателя) навеску одной из солей (m2): карбоната натрия, хлорида алюминия, фосфата натрия, сульфата цинка, хлорида аммония.
2. Растворить навеску соли в мерной колбе вместимостью 100 см3 (раствор № 1).
3. Рассчитать молярную концентрацию раствора № 1 по формуле
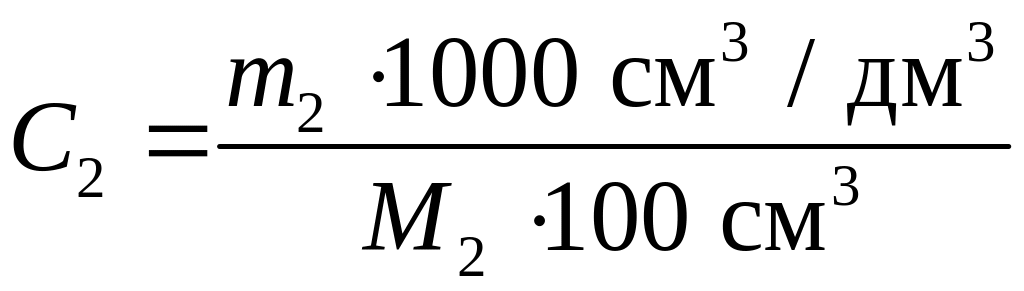 ,
,
где M2 – молярная масса растворенной соли, г/моль. Данные внести в табл. 6.
4. Разбавить раствор № 1 в 10 раз (раствор № 2).
5. Разбавить раствор № 1 в 100 раз (раствор № 3).
6. Измерить рН растворов № 1, 2 и 3. Данные занести в табл. 6.
Таблица 6
