
- •Психогенетика
- •Раздел I. Психогенетика как область науки тема 1. Введение в предмет
- •1.1. Психогенетика как область науки. Предмет психогенетики
- •1.2. История возникновения психогенетики
- •1.3. Евгеническое движение
- •1.4. Генетика и общество
- •1.5. Психогенетика в проекте "Геном человека"
- •1.6. Психогенетика и генетика поведения животных
- •1.7. Основные этапы становления и развития психогенетики
- •1.8. Психогенетика в России
- •1.1. Психогенетика как область науки. Предмет психогенетики
- •1.2. История возникновения психогенетики
- •1.3. Евгеническое движение
- •1.4. Генетика и общество
- •1.5. Психогенетика в проекте "Геном человека"
- •1.6. Психогенетика и генетика поведения животных
- •1.7.Основные этапы становления и развития психогенетики
- •1.8. Психогенетика в России
- •Словарь терминов
- •Вопросы для самопроверки
- •Раздел II. Элементарные основы общей генетики
- •Тема 2. Признаки в популяциях
- •Словарь терминов
- •Вопросы для самопроверки
- •Тема 3. Генетическая основа простых качественных признаков. Материальный субстрат наследственности
- •3.1. Законы Менделя
- •3.1.1. Г. Мендель и его опыты
- •3.1.2. Моногибридное скрещивание и первый закон Менделя
- •3.1.3. Дигибридное скрещивание и второй закон Менделя
- •3.2. Хромосомная теория наследственности
- •3.2.1. Возникновение хромосомной теории наследственности
- •3.2.2. Два типа клеточного деления
- •3.2.3. Хромосомы человека
- •3.2.4. Рекомбинация хромосом в процессе образования половых клеток
- •3.2.5. Сцепление и кроссинговер
- •3.2.6. Генетическая уникальность индивида
- •3.3. Молекулярные основы наследственности
- •3.3.2. Определение гена. Основная функция гена
- •3.3.3. Генетический код
- •3.4. Гены в хромосомах. Мутации
- •3.4.1. Понятия локуса и аллеля. Множественные аллели. Гомозиготность и гетерозиготность
- •3.4.2. Генные мутации
- •3.4.3. Хромосомные аномалии
- •3.5. Гены в популяциях. Закон Харди-Вайнберга
- •3.1. Законы Менделя
- •3.2. Хромосомная теория наследственности
- •3.3. Молекулярные основы наследственности
- •3.4. Гены в хромосомах. Мутации
- •Словарь терминов
- •Вопросы для самопроверки
- •Раздел III. Биометрическая генетика глава 4. Генетические основы количественной изменчивости
- •4.1. Количественная изменчивость и методы ее описания
- •4.1.1. Измерение количественных признаков
- •4.1.2. Характеристики центральной тенденции
- •4.1.3. Характеристики разброса
- •4.1.4. Межгрупповые и межиндивидуальные различия
- •4.2.1. Генотип и фенотип
- •4.2.2. Возникновение количественной изменчивости под действием полимерных генов. Генетическая дисперсия
- •4.2.3. Различные типы взаимодействия генов. Аддитивное взаимодействие
- •4.2.4. Возникновение количественной изменчивости под действием среды. Норма реакции. Средовая дисперсия
- •4.2.5. Совместный вклад генотипа и среды в количественную изменчивость. Генетическая и средовая дисперсии как составляющие популяционной фенотипической дисперсии
- •4.3. Показатель наследуемости и его особенности
- •4.3.1. Показатель наследуемости в количественной генетике и генетике поведения
- •4.3.2. Чувствительность показателя наследуемости к частотам генотипов в популяции
- •4.3.3. Чувствительность показателя наследуемости к изменениям среды
- •4.3.4. Важность правильной интерпретации показателя наследуемости
- •4.4. Генотип-средовое взаимодействие
- •4.4.1. Вклад генотип-средового взаимодействия в популяционную изменчивость
- •4.4.2. Генотип-средовая ковариация
- •4.1. Количественная изменчивость и методы ее описания
- •4.2. Наследственность и среда как факторы возникновения количественной изменчивости
- •4.3. Показатель наследуемости и его особенности
- •4.4. Генотип-средовое взаимодействие
- •Словарь терминов
- •Вопросы для самопроверки
- •Тема 5. Фенотипическая структура популяции и математическое моделирование в психогенетике
- •5.1. Введение
- •5.2. Компоненты генетической дисперсии
- •5.3. Компоненты средовой дисперсии и эффекты генотип-средового взаимодействия
- •5.4. Ассортативность как фактор, влияющий на фенотипическую дисперсию
- •5.5. Математическое моделирование в психогенетике
- •Словарь терминов
- •Вопросы для самопроверки
- •Раздел IV. Экспериментальные методы психогенетики
- •Тема 6. Измерение сходства и различий между родственниками
- •6.1. Семейное и генетическое сходство
- •6.2. Общие гены у родственников. Понятие о вероятности. Коэффициент родства
- •6.3. Способы количественной оценки фенотипического сходства между родственниками
- •6.3.1. Конкордантность
- •6.3.2. Корреляция
- •6.3.3. Регрессия
- •Словарь терминов
- •Вопросы для самопроверки
- •Тема 7. Экспериментальные схемы генетико-популяционных исследований
- •7.1. Близнецы и близнецовый метод
- •7.1.1. Биология близнецовости
- •7.1.2. Концепция близнецового метода
- •7.1.3. Разновидности близнецового метода
- •7.2. Метод приемных детей
- •7.3. Семейные исследования
- •7.3.1. Анализ родословных
- •7.3.2. Исследования родственников в семьях
- •7.4. Сопоставление результатов, полученных разными методами
- •7.1. Близнецы и близнецовый метод
- •7.2. Метод приемных детей
- •7.3. Семейные исследования
- •7.4. Сопоставление результатов, полученных разными методами
- •Словарь терминов
- •Вопросы для самопроверки
- •Тема 8. Методы, использующие молекулярно-генетические технологии и моделирование на животных
- •8.1. Геномика и психогенетика
- •8.2. Анализ сцепления
- •8.2.1. Классический вариант анализа сцепления
- •8.2.2. Картирование локусов количественных признаков (лкп)
- •8.3. Анализ ассоциаций. Метод гена-кандидата
- •8.4. Прямой анализ днк и выявление мутаций
- •8.5. Моделирование на животных
- •8.1. Геномика и психогенетика
- •8.2. Анализ сцепления
- •8.3. Анализ ассоциаций. Метод гена-кандидата
- •8.4. Прямой анализ днк и выявление мутаций
- •8.5. Моделирование на животных
- •Словарь терминов
- •Вопросы для самопроверки
- •Раздел V. Психогенетика и развитие тема 9. Генотип и среда в индивидуальном развитии
- •9.1. Концепция нормы реакции и развитие
- •9.2. Как среда может взаимодействовать с генотипом в процессе развития?
- •9.3. Молекулярные аспекты развития
- •9.3.1. Фенотип на клеточном уровне
- •9.3.2. Транскрипция, трансляция и факторы, влияющие на эти процессы
- •9.3.3. Ранние гены и их роль в развитии
- •9.3.4. Гормоны и их роль в генетической регуляции
- •9.3.5. Регуляторная роль g-белков
- •9.4. Морфогенез нервной системы и факторы, влияющие на этот процесс
- •9.5. Роль эмбрионального и неонатального опыта в развитии поведения
- •9.6. Родительские эффекты в развитии
- •9.7. Принцип системности и диалектика взаимодействия генотипа и среды в развитии
- •9.7.1. Вариабельность в нервной системе
- •9.7.2. Эпигенез
- •9.7.3. Теория эпигенеза путем селективной стабилизации синапсов
- •9.7.4. Случайности развития
- •9.7.5. Историзм развития
- •Словарь терминов
- •Вопросы для самопроверки
- •Раздел VI. Психогенетические исследования нормальной вариативности
- •Тема 10. Элементарные психические функции. Психофизиологические и двигательные характеристики
- •10.1. Сенсорное восприятие
- •10.2. Морфология и физиология мозга
- •10.2.1. Генетические исследования морфологии мозга человека
- •10.2.2. Генетические исследования биоэлектрической активности мозга человека
- •10.3. Двигательные характеристики
- •10.1. Сенсорное восприятие
- •10.2. Морфология и физиология мозга
- •10.3. Двигательные характеристики
- •Словарь терминов
- •Вопросы для самопроверки
- •Тема 11. Интеллект и когнитивные характеристики. Темперамент. Личность
- •11.1. Психогенетические исследования интеллекта
- •11.2. Психогенетические исследования темперамента и личности
- •11.1. Психогенетические исследования интеллекта
- •11.2. Психогенетические исследования темперамента и личности
- •Словарь терминов
- •Вопросы для самопроверки
- •Раздел VII. Психогенетика и психопатология тема 12. Психогенетические исследования нарушенного поведения
- •12.1. Шизофрения
- •12.2. Депрессивное расстройство
- •12.3. Болезнь Альцгеймера (старческое слабоумие, деменция)
- •12.4. Умственная отсталость и задержка умственного развития
- •12.5. Неспособность к обучению
- •12.6. Дислексия
- •12.7. Преступность и алкоголизм
- •12.1. Шизофрения
- •12.2. Депрессивное расстройство
- •12.3. Болезнь Альцгеймера (старческое слабоумие, деменция)
- •12.4. Умственная отсталость и задержка умственного развития
- •12.5. Неспособность к обучению
- •12.6. Преступность и алкоголизм
- •Словарь терминов
- •Вопросы для самопроверки
7.4. Сопоставление результатов, полученных разными методами
Сопоставление результатов исследования одной и той же психологической характеристики с применением разных методов - близнецового, семейного и метода приемных детей - позволяет оценивать их надежность.
Если результаты исследования одной и той же психологической характеристики, полученные разными методами, вступают в противоречие, необходим дополнительный анализ причин, влияющих на внутрипарное сходство тех или иных родственников.
Словарь терминов
Близнецы
Монозиготные (однояйцевые) близнецы
Дизиготные (двуяйцевые) близнецы
Зиготность близнецов
Близнецовый метод
Близнецовость
Сиамские близнецы
Близнецовая ситуация
Автономный язык близнецов
Метод приемных детей
Семейный метод
Генеалогический метод
Родословная
Поколение
Пробанд
Биологические родители
Родители-усыновители
Вопросы для самопроверки
Какие типы близнецов существуют в человеческой популяции?
Каково происхождение МЗ и ДЗ близнецов?
Каким способом можно подсчитать частоту рождаемости МЗ и ДЗ близнецов в разных популяциях?
Какие факторы увеличивают вероятность рождаемости близнецов и к какому типу близнецов это относится?
На чем основано применение близнецового метода и кто его автор?
Что такое зиготность близнецов, для чего ее определяют и какими методами?
Почему в классическом варианте близнецового метода (метод контрастных пар) помимо сходства МЗ близнецов необходимо оценивать и сходство ДЗ близнецов?
В каком случае можно ограничиться изучением только МЗ близнецов?
На каких допущениях основан близнецовый метод?
По каким простым формулам можно примерно оценить вклад генотипа, общей и различающейся среды в вариативность количественных признаков, изучаемых близнецовым методом?
В каких случаях нарушаются основные допущения близнецового метода?
С чем связано существование систематических различий между близнецами и неблизнецами?
Какие пренатальные, перинатальные и постнатальные факторы приводят к неравноценности средовых условий для партнеров-близнецов?
Что такое близнецовая ситуация и зачем ее нужно исследовать?
Почему у близнецов может наблюдаться отставание в речевом и умственном развитии? Что нужно делать для профилактики этого?
Какие стратегии в воспитании близнецов используются родителями и к чему это приводит?
Какие разновидности близнецовых исследований вы знаете и для чего они используются?
Какие обозначения приняты в родословных?
Для каких признаков составление родословных имеет смысл?
Какие типы наследования позволяет выявить анализ родословных?
Какие психологические характеристики можно исследовать с помощью родословных?
Назовите примеры семей, в которых прослеживались какие-либо выдающиеся способности.
Какие возможны объяснения для передачи специальных способностей от поколения к поколению?
Может ли генеалогический метод быть полезен для изучения количественных признаков?
Какие конкретные генеалогические исследования в области психогенетики вам известны?
Как может генеалогический метод использоваться при анализе сцепления?
Почему семейный метод относится к "нежестким" схемам исследования?
На чем основано применение метода приемных детей в психогенетике?
Почему применение этого метода в России практически невозможно?
Почему при применении метода приемных детей возможно смешение оценок средних величин и дисперсий? Поясните это на примере.
Приведите пример схемы исследования методом приемных детей.
Если приемные дети по абсолютной величине признака больше похожи на своих приемных родителей (по сравнению с биологическими), о чем это может говорить?
По каким формулам можно определить долю генетических и средовых компонентов фенотипической дисперсии при применении метода приемных детей?
Почему метод приемных детей относится к "жестким схемам" исследования?
Почему в психогенетике часто прибегают к сочетанию различных методов? Приведите примеры.
Тема 8. Методы, использующие молекулярно-генетические технологии и моделирование на животных
8.1. Геномика и психогенетика
8.2. Анализ сцепления
8.3. Анализ ассоциаций. Метод гена-кандидата
8.4. Прямой анализ ДНК и выявление мутаций
8.5. Моделирование на животных
Методы психогенетики, описанные в предыдущей теме 7, не могут быть использованы для поиска генов, имеющих отношение к детерминации поведения. Они лишь позволяют статистически оценить наследственные и средовые эффекты, определяющие изменчивость психологических характеристик в конкретных популяциях людей. Получаемые при этом оценки наследуемости и средовых эффектов общей и индивидуальной среды оказываются малоинформативными в плане познания механизмов действия наследственности и среды на формирование конкретных психологических особенностей людей. Новая эра в психогенетике началась с момента основания в конце 80-х гг. долгосрочной программы "Геном человека", о которой мы уже упоминали в теме 1. Широкомасштабные исследования, проводимые в последнее время в рамках проекта "Геном человека", открыли новые возможности для исследований в генетике поведения. Можно с уверенностью сказать, что за последние несколько лет кардинально изменились акценты в генетике поведения. Приход молекулярно генетических технологий в генетику поведения человека можно считать революционным этапом, в корне преобразовавшим эту область. Прежде чем начать описание конкретных методических приемов, используемых для поиска генов и изучения механизмов их действия, необходимо коротко остановиться на основных достижениях молекулярной генетики последних лет, чтобы понять, на чем основываются новые технологии.
8.1. Геномика и психогенетика
Геномика, пожалуй, самая молодая область генетики. Длительное время понятие "геном" определяли как совокупность генов в гаплоидном наборе хромосом определенного биологического вида. Когда говорили о геноме человека, то имелся в виду гаплоидный набор хромосом вида "Homo sapiens" с содержащимися в нем генами. Сейчас положение кардинально изменилось. Во-первых, были накоплены сведения о внехромосомной ДНК, находящейся в цитоплазме и ядрах клеток вне хромосом. Во-вторых, оказалось, что ДНК - это не просто цепочка генов, следующих один за другим: структура и функции ее намного сложнее. Структурные гены, т.е. те, которые кодируют полипептидную цепь или молекулу РНК, занимают лишь небольшую часть ДНК (примерно 3-5%). Существует огромное количество межгенных участков с пока еще неясными функциями, образующих вместе с генами всю совокупность нуклеотидных последовательностей ДНК. В настоящее время геномом называется полный состав ДНК клетки. Геномика изучает принципы построения геномов и их структурно-функциональную организацию. Геномика еще очень молода, но столь стремительно развивается, что в ее рамках уже появились самостоятельные направления: структурная геномика, функциональная геномика, медицинская геномика, компьютерная геномика, сравнительная геномика, эволюционная геномика, этническая геномика. Структурная геномика изучает нуклеотидные последовательности ДНК, в том числе строение и локализацию генов, определяет их границы, изучает строение межгенных участков, обеспечивающих регуляторные функции ДНК. В задачу структурной геномики входит построение генетических карт организма. Функциональная геномика решает вопросы, связанные с идентификацией функций отдельных участков генома, в том числе и структурных генов, а также механизмы их взаимодействия в клеточном ансамбле. С функциональной геномикой тесно связана еще одна молодая область молекулярной биологии - протеомика, изучающая функционирование белков в клетках. Геномика не может развиваться без современных компьютерных технологий, поскольку оперирует огромными базами данных (компьютерная геномика). Достижения структурной и функциональной геномики применяются в прикладных целях (медицинская геномика, сельскохозяйственная геномика). Сравнительная и эволюционная геномика изучает сходства и различия геномов разных организмов и происхождение генетического полиморфизма, свойственного всем живым организмам на Земле. Этническая геномика изучает особенности геномного полиморфизма отдельных популяций, рас, народностей. Современные представления о геноме человека сложились благодаря нескольким открытиям молекулярной биологии (в 70-х гг.х ХХ столетия), позволившим получать неограниченные количества ДНК (открытие полимеразной цепной реакции - ПЦР) и расшифровывать последовательности нуклеотидов в ее цепях (секвенирование). Немаловажным фактором в стремительном прогрессе геномики была автоматизация процессов секвенирования и развитие информационных технологий. В США и Великобритании разработаны роботы-секвенаторы, которые были названы геномотронами. Эти приборы осуществляют до 100 000 полимеразных реакций в час. В течение недели секвенаторы могут осуществить расшифровку нуклеотидных последовательностей длиной в несколько миллионов пар нуклеотидов. В результате создания высоких биотехнологий стало возможным в обозримые сроки просеквенировать весь геном человека, что и было выполнено примерно за 10 лет в результате действия международной и национальных программ проекта "Геном человека" (1990-2000). Результатом этих работ стало получение информации не только о последовательности нуклеотидов всей ДНК человека, но и открытие громадного количества новых полиморфизмов - генетических вариантов последовательностей нуклеотидов одного и того же участка ДНК у разных людей. Когда мы в теме 3 на примере групп крови системы АВ0 вводили понятие множественного аллелизма, мы фактически разбирали случай генетического полиморфизма у человека по определенным белкам крови. Аллели - это различные формы гена (отсюда - полиморфизм). Геномный полиморфизм представляет собой участки ДНК (функции которых могут быть в настоящее время неизвестны), варьирующие у отдельных индивидов. Любые изменения в ДНК ведут к возникновению генетического полиморфизма. Полиморфизм может возникать в результате замены или потери нуклеотидов. Это однонуклеотидный полиморфизм (рис. 8.1).

Полиморфизм может быть также результатом количественных изменений генома. В этом случае варьирует число нуклеотидных повторов. Полиморфизмы наблюдаются как в смысловых (экзоны), так и в несмысловых (интроны) участках генома. Однонуклеотидные полиморфизмы составляют основу генетической вариативности. Они встречаются по всему геному и отражают прошлые мутации. Вся длина генома составляет 3,2 млрд пар нуклеотидов. К 2001 г. идентифицировано и картировано 1,42 млн однонуклеотидных полиморфизмов. По расчетам генетиков, люди оказываются идентичными по нуклеотидным последовательностям на 99,9%. Таким образом, столь заметная вариативность между людьми возникает за счет различий лишь в 1% генома (Бочков Н.П., 2002). Данные секвенирования показали, что в геноме человека чуть более 30 000 генов, тогда как раньше считалось, что их, по крайней мере, в два-три раза больше. Большинство генов имеют размеры до 50 000 пар нуклеотидов. Число синтезируемых белковых продуктов превышает число генов в 1,5-2 раза. Это является результатом альтернативного сплайсинга при вырезании интронов (рис.8.2. a, b, c). Как размеры генов, так и число экзонов и интронов в них варьирует в довольно широких пределах (табл. 8.1 и 8.2)
Таблица 8.1
Классификация генов человека по размеру
Категория и первичный продукт |
Размер, тыс. пар нуклеотидов |
кДНК (мРНК), тыс. пар нуклеотидов |
Число интронов |
|
0,8 1,5 1,7 3,6 4,2 11,0 18,0 38,0 25,0 32,0 34,0 34,0 45,0 90,0 186,0 >300,0 ~230 >2000,0 |
0,5 0,6 0,4 1,2 1,0 1,04 5,0 5,0 2,1 1,5 2,8 1,6 5,5 2,4 9,0 8,7 6,5 ~16,0 |
2 2 2 3 2 7 50 50 14 14 7 12 17 12 26 >36 27 >60 |
Таблица 8.2
Распределение генов человека по размеру
Размер, тыс. пар нуклеотидов |
% общего числа |
<10 10-25 26-50 51-100 101-500 >500 |
23,3 35,6 20,2 13,0 6,7 1,2 |
Благодаря открытию геномного полиморфизма генетики получили широкие возможности для картирования генов, т.е. локализации генов на хромосомах. Распределенные по всему геному, полиморфизмы используются как генетические маркеры. Генетическими маркерами называются участки ДНК с известной локализацией и множественными аллельными формами. Они служат как бы опорными точками для картирования генов (подробнее об этом см. в следующем параграфе). Поиск генетических маркеров был одной из самостоятельных задач проекта "Геном человека". Концептуальная модель использования маркеров для локализации генов чрезвычайно проста. Если два индивида, связанные кровным родством, имеют идентичные маркеры, высока вероятность того, что рядом расположенные участки ДНК, в силу тесного сцепления, будут у них также идентичны. Если у этих родственников наблюдается к тому же одно и то же заболевание, т.е. они являются по нему конкордантными, можно предполагать, что ген болезни расположен рядом с маркером. Похожий принцип лежит и в основе картирования локусов количественных признаков (Quantitative Trait Loci - QTL), которые до недавнего времени, в отличие от признаков качественных, практически не могли быть картированы. Основные молекулярные методы, разработанные на основе исследований генома человека и животных, были ассимилированы генетикой поведения и в настоящее время широко используются для локализации генов, связанных с различными психическими заболеваниями и отклонениями в развитии психики. Наиболее успешно решается проблема локализации генов моногенных заболеваний (фенилкетонурия, хорея Гентингтона), наследуемых по Менделю. Гораздо труднее идентифицировать гены, имеющие отношение к мультифакториальным заболеваниям (шизофрения, депрессия, алкоголизм и т.п.) или нормально варьирующим признакам (интеллект, темперамент, особенности личности). Можно выделить три основных экспериментальных подхода, использующих молекулярные технологии при работе с людьми. Это различные варианты метода анализа сцепления, анализ ассоциаций и непосредственный анализ ДНК, т.е. определение последовательности нуклеотидов (секвенирование) и идентификация мутаций. Кроме исследований, ведущихся на человеке, современная психогенетика привлекает также методы моделирования на животных. Остановимся на каждом из этих подходов более подробно.
8.2. Анализ сцепления
8.2.1. Классический вариант анализа сцепления
8.2.2. Картирование локусов количественных признаков (ЛКП)
8.2.1. Классический вариант анализа сцепления
Как уже упоминалось в теме 3, гены в хромосомах располагаются линейно, один за другим. Этим обстоятельством определяются две основные особенности наследования генов, относящихся к одной хромосоме. Во-первых, такие гены имеют тенденцию передаваться совместно, поэтому их называют сцепленными. Во-вторых, хотя эти гены в процессе кроссинговера и могут рекомбинировать, их рекомбинация не является полностью случайной: вероятность совместной передачи повышается с уменьшением расстояния между генами. Известный американский генетик Томас Морган еще в начале ХХ века предложил использовать явление сцепления для локализации генов, расположенных на одной хромосоме (Хрестомат. 8.1). Этот метод генетического анализа получил название анализ сцепления, а результатом его применения стало создание генетических карт, т.е. схем расположения конкретных генов на конкретных хромосомах (рис. 8.3). Генетические карты животных и растений, для которых возможны экспериментальные скрещивания, создаются постепенно в процессе наблюдений за частотой рекомбинации (чем чаще гены передаются совместно, тем ближе они расположены на хромосоме). Используя рекомбинантный анализ, Т. Морган и его коллеги успешно локализовали многие гены плодовой мушки дрозофилы. В настоящее время созданы подробные генетические карты для многих видов экспериментальных организмов и ряда сельскохозяйственных культур.
У человека
экспериментальные скрещивания невозможны,
поэтому классический способ рекомбинантного
анализа может применяться весьма
ограниченно, лишь на основе информации,
которую дает анализ родословных. Чтобы
выявить кроссинговер
у человека, нужно располагать либо
большой родословной, либо иметь несколько
небольших родословных. Проще всего по
родословной обнаруживается Х-сцепленное
наследование, т.е. расположение генов
в Х-хромосоме,
поскольку характерный признак или
заболевание наблюдается у лиц одного
пола. Однако, чтобы установить расположение
гена в конкретном сегменте Х-хромосомы,
нужны дополнительные схемы анализа,
требующие применения новейших методик.
Почти все Х-сцепленные гены (а их более
100) были картированы с помощью анализа
родословных.
Для
того, чтобы картировать гены, принадлежащие
аутосомам,
необходимо сначала выявить группы
генов, относящихся к определенной
хромосоме. Простой анализ родословных
не позволяет это сделать. Впервые
локализация гена в аутосоме оказалась
возможной благодаря наличию морфологического
маркера хромосомы. Такой маркер в виде
вторичной перетяжки был обнаружен на
длинном плече первой хромосомы человека.
Оказалось, что примерно в 0,5% случаев в
популяции эта морфологическая особенность
первой хромосомы отличается от нормы:
перетяжка оказывается тоньше и длиннее.
Было обнаружено, что такой вариант
перетяжки наследуется доминантно.
С этим морфологическим
маркером оказался тесно
сцепленным локус
группы крови Даффи, а еще ранее было
показано, что ген Даффи сцеплен с
врожденной очаговой катарактой. Помимо
визуально наблюдаемых морфологических
особенностей хромосом, локализации
генов на конкретных хромосомах могут
способствовать анализ делеций (выпадений
участков хромосомы) и некоторых других
хромосомных аномалий, которые влекут
за собой изменение ферментативной
активности.
 Таким
образом, чтобы локализовать ген на
определенной хромосоме, необходим
маркер, по отношению к которому можно
оценивать тесноту сцепления. Такими
маркерами могут быть гены, локализация
которых в данной хромосоме уже известна
(например, локализация генов цветовой
слепоты в Х-хромосоме), а также различные
морфологические маркеры. В последнее
время, благодаря успехам генной
инженерии, стало возможным
выявление молекулярных
маркеров в ДНК
человека. Огромные возможности для
локализации генов появились с разработкой
новых методов гибридизации клеток
(например, клеток человека и мыши). В
результате число уже локализованных
генов человека растет с поразительной
быстротой. Как показывают расчеты, весь
геном человека может быть картирован,
если исследователи будут располагать
всего несколькими сотнями маркеров,
которые случайно распределены по
хромосомам (Фогель
Ф., Мотульски А., 1989).
Открытие множества геномных
полиморфизмов человека
обогатило генетику человека сотнями
новых маркеров, благодаря которым
проблема локализации генов и картирования
хромосом успешно решается. Секвенирование
генома позволяет составить полные
генетические карты для всех
хромосом.
На
рисунке
8.4. приведена в качестве примера
карта третьей хромосомы человека, на
которой представлены мутации, приводящие
к различным наследственным заболеваниям.
Карты хромосом постоянно пополняются
новыми мутациями. В настоящее время
наиболее полная генетическая карта
составлена для генома митохондрий (рис.
8.5)
Мерой
"генетического расстояния" служит
частота рекомбинации между маркером и
исследуемым геном. Это расстояние
измеряется в морганидах или сантиморганидах
(сМ), единицах, названных так в честь
Томаса Моргана. Одна сантиморганида
соответствует расстоянию между генами,
рекомбинация между которыми происходит
с частотой 1%. Карты генома могут
составляться в двух вариантах. Одни из
них - карты генетического сцепления -
строятся на основе анализа данных по
наследованию гена или маркера в ряду
поколений, другие - физические карты -
на прямом исследовании носителей
генетической информации (Пузырев
В.П., Степанов В.А., 1997).
Генетическое расстояние в 1 сМ примерно
равно физическому расстоянию в 1 миллион
пар оснований. Длина генетической карты
генома человека составляет около
3000-3500 сантиморганид (Бочков
Н.П., 2002).
Если
частота рекомбинации соответствует
50%, это означает, что два локуса
находятся на таком расстоянии, что
наследуются независимо. Если два гена
передаются совместно в 10 поколениях,
вероятность того, что это происходит
случайно, то есть гены не являются
сцепленными, ничтожно мала (1/1000 или
1/103). В научной практике эта вероятность
выражается в логарифмической шкале
(LOD score) и составляет в данном случае 3
lod. При работе с родословными пользуются
различными таблицами лод-баллов и
специально разработанными алгоритмами.
Благоприятные возможности для определения
сцепления по родословной существуют,
если один из родителей является
гетерозиготным по двум различным генам,
а второй - гомозиготным.
Чаще всего анализ сцепления проводится
для часто встречающихся в популяции
маркеров или в тех случаях, когда часто
встречающийся маркер сопутствует
редкому наследственному заболеванию.
Как доказательство сцепления обычно
рассматривается лод-балл не менее 3
(1000:1 в пользу сцепления). В настоящее
время разработаны специальные компьютерные
программы для анализа сцепления по
родословным. Широко используется
программа LIPED, которая позволяет получать
оценки максимального правдоподобия
параметров сцепления по данным родословных
(Ott,
1991), а также программа
LINCAGE (Lathrop
et al., 1984).
Анализ
сцепления чаще всего используется при
изучении альтернативных (качественных)
признаков. Делаются попытки применять
этот метод и для анализа количественных
признаков в расчете на то, что удастся
обнаружить главные гены, влияющие на
изучаемые характеристики. Теоретически
такой подход вполне оправдан, однако,
как отмечают Ф. Фогель и А. Мотульски
(1989), следует соблюдать большую осторожность
в интерпретации данных. Во-первых, при
анализе большого числа количественных
признаков существует риск обнаружить
сцепление за счет чисто случайных
флуктуаций критериев значимости.
Во-вторых, корреляция, наблюдаемая в
семьях, может возникать не только за
счет сцепления, но и за счет наличия
ассортативности
по исследуемому признаку. Следует
отметить, что пока анализ сцепления для
количественных признаков испытывает
значительные трудности и часто не
приносит ожидаемых результатов, однако
с появлением молекулярных маркеров ДНК
возможности анализа и интерпретации
данных постоянно возрастают.
Таким
образом, чтобы локализовать ген на
определенной хромосоме, необходим
маркер, по отношению к которому можно
оценивать тесноту сцепления. Такими
маркерами могут быть гены, локализация
которых в данной хромосоме уже известна
(например, локализация генов цветовой
слепоты в Х-хромосоме), а также различные
морфологические маркеры. В последнее
время, благодаря успехам генной
инженерии, стало возможным
выявление молекулярных
маркеров в ДНК
человека. Огромные возможности для
локализации генов появились с разработкой
новых методов гибридизации клеток
(например, клеток человека и мыши). В
результате число уже локализованных
генов человека растет с поразительной
быстротой. Как показывают расчеты, весь
геном человека может быть картирован,
если исследователи будут располагать
всего несколькими сотнями маркеров,
которые случайно распределены по
хромосомам (Фогель
Ф., Мотульски А., 1989).
Открытие множества геномных
полиморфизмов человека
обогатило генетику человека сотнями
новых маркеров, благодаря которым
проблема локализации генов и картирования
хромосом успешно решается. Секвенирование
генома позволяет составить полные
генетические карты для всех
хромосом.
На
рисунке
8.4. приведена в качестве примера
карта третьей хромосомы человека, на
которой представлены мутации, приводящие
к различным наследственным заболеваниям.
Карты хромосом постоянно пополняются
новыми мутациями. В настоящее время
наиболее полная генетическая карта
составлена для генома митохондрий (рис.
8.5)
Мерой
"генетического расстояния" служит
частота рекомбинации между маркером и
исследуемым геном. Это расстояние
измеряется в морганидах или сантиморганидах
(сМ), единицах, названных так в честь
Томаса Моргана. Одна сантиморганида
соответствует расстоянию между генами,
рекомбинация между которыми происходит
с частотой 1%. Карты генома могут
составляться в двух вариантах. Одни из
них - карты генетического сцепления -
строятся на основе анализа данных по
наследованию гена или маркера в ряду
поколений, другие - физические карты -
на прямом исследовании носителей
генетической информации (Пузырев
В.П., Степанов В.А., 1997).
Генетическое расстояние в 1 сМ примерно
равно физическому расстоянию в 1 миллион
пар оснований. Длина генетической карты
генома человека составляет около
3000-3500 сантиморганид (Бочков
Н.П., 2002).
Если
частота рекомбинации соответствует
50%, это означает, что два локуса
находятся на таком расстоянии, что
наследуются независимо. Если два гена
передаются совместно в 10 поколениях,
вероятность того, что это происходит
случайно, то есть гены не являются
сцепленными, ничтожно мала (1/1000 или
1/103). В научной практике эта вероятность
выражается в логарифмической шкале
(LOD score) и составляет в данном случае 3
lod. При работе с родословными пользуются
различными таблицами лод-баллов и
специально разработанными алгоритмами.
Благоприятные возможности для определения
сцепления по родословной существуют,
если один из родителей является
гетерозиготным по двум различным генам,
а второй - гомозиготным.
Чаще всего анализ сцепления проводится
для часто встречающихся в популяции
маркеров или в тех случаях, когда часто
встречающийся маркер сопутствует
редкому наследственному заболеванию.
Как доказательство сцепления обычно
рассматривается лод-балл не менее 3
(1000:1 в пользу сцепления). В настоящее
время разработаны специальные компьютерные
программы для анализа сцепления по
родословным. Широко используется
программа LIPED, которая позволяет получать
оценки максимального правдоподобия
параметров сцепления по данным родословных
(Ott,
1991), а также программа
LINCAGE (Lathrop
et al., 1984).
Анализ
сцепления чаще всего используется при
изучении альтернативных (качественных)
признаков. Делаются попытки применять
этот метод и для анализа количественных
признаков в расчете на то, что удастся
обнаружить главные гены, влияющие на
изучаемые характеристики. Теоретически
такой подход вполне оправдан, однако,
как отмечают Ф. Фогель и А. Мотульски
(1989), следует соблюдать большую осторожность
в интерпретации данных. Во-первых, при
анализе большого числа количественных
признаков существует риск обнаружить
сцепление за счет чисто случайных
флуктуаций критериев значимости.
Во-вторых, корреляция, наблюдаемая в
семьях, может возникать не только за
счет сцепления, но и за счет наличия
ассортативности
по исследуемому признаку. Следует
отметить, что пока анализ сцепления для
количественных признаков испытывает
значительные трудности и часто не
приносит ожидаемых результатов, однако
с появлением молекулярных маркеров ДНК
возможности анализа и интерпретации
данных постоянно возрастают.
8.2.2. Картирование локусов количественных признаков (лкп)
Описанный выше
метод анализа сцепления в классическом
варианте, как правило, используется для
альтернативных признаков, наследуемых
по Менделю. Для количественных признаков
разработана несколько отличающаяся
модель картирования - это так называемый
метод QTL (Quantitative Trait Loci), или картирование
ЛКП (локусов количественных признаков).
ЛКП представляют собой полигенные
системы, обеспечивающие непрерывную
вариативность признака в
популяции.
Метод
картирования ЛКП о сновывается
на исследовании ДНК у пар близких
родственников, чаще всего сибсов. Идея
его очень проста. Мы уже знаем, что сибсы
имеют в среднем примерно 50% общих аллелей.
В каждой конкретной паре сибсов
совпадающие аллели будут отличаться.
Таким образом, у детей одних и тех же
родителей в данном локусе аллели
матери и отца могут представлять
различные сочетания (рис.
8.6).
Рассмотрим
ген, который имеет четыре аллеля: А, В,
С, D. Допустим, мать обладает аллелями А
и В, а отец - аллелями С и D. Каждый ребенок
может получить от матери один из ее
аллелей (А или В) и от отца - один из его
аллелей (С или D), при этом ребенок
наследует свой генотип независимо от
других детей в этой семье. Соответственно
возможны четыре различных сочетания.
Сравнение генотипов,
представленных на рисунке, показывает,
что любой ребенок в этой семье,
унаследовавший, к примеру, генотип АС,
может иметь от 0 до 2 общих аллелей с
любым из своих братьев и сестер.
Предположим, мы выявили пару сибсов,
которые имеют два общих аллеля. Эти
сибсы оказались более похожими по
какому-либо количественному признаку,
чем сибсы, имеющие один общий аллель.
Последние, в свою очередь, обнаружили
большее сходство, чем те сибсы, у которых
общих аллелей в этом локусе не было
совсем. На основании этих наблюдений,
мы можем предполагать, что этот ген
влияет на интересующий нас количественный
признак. Если разница в количестве
совпадающих аллелей никак не отражается
на количественных соотношениях признака
у сибсов, значит тестированный ген не
имеет отношения к изучаемому признаку.
Обычно при таком подходе вместо реальных
генов используются маркеры и вычисляются
корреляции между наличием маркера и
степенью выраженности количественного
признака. При анализе группы "количественных
локусов" корреляции вычисляются для
каждого из нескольких маркеров,
расположенных на определенном участке
хромосомы. Величина коэффициентов
меняется от локуса
к локусу. На основании дальнейшего
анализа определяют участок предполагаемой
локализации гена, вносящего свой вклад
в количественный признак.
В
некотором смысле метод
картирования ЛКП с
использованием пар сибсов напоминает
близнецовый метод: сибсы, у которых
совпадают оба аллеля аналогичны МЗ
близнецам (100% общих генов). Сибсы, у
которых совпадает 1 аллель аналогичны
ДЗ близнецам (50% общих генов). Сибсы, не
имеющие совпадений, аналогичны
неродственникам (0% общих генов).
Целью
картирования ЛКП является поиск не
единичного гена, определяющего сложный
признак, а скорее множественных генов,
принимающих участие в формировании
популяционной вариативности по изучаемой
характеристике. Метод картирования ЛКП
достаточно эффективен для выявления
действия так называемых главных
генов, т.е. генов, вносящих
основной вклад в формирование
количественного признака.
Предположим,
имеется ген, участие которого определяет
10% вариативности признака, кроме того,
существует еще 5 генов, каждый из которых
дает вклад в 2%, и еще 10 других генов с
вкладом в изменчивость в 1%. Если эффекты
этих ЛКП (или QTL) независимы, то все они
вместе будут определять 30% вариативности
(10 + 2•5 + 1•10 = 30). Для генов, наследуемых
по Менделю и имеющих вклад, оцениваемый
в 100%, эффект порядка 10% может показаться
весьма малым. Однако для различных
психических расстройств такой вклад
считается достаточно большим. На
сегодняшний день метод картирования
ЛКП используется для изучения
количественных признаков или заболеваний
с наследственной предрасположенностью
и обладает разрешающей способностью,
позволяющей выявлять гены с эффектом
порядка 10% (Plomin
R., McGuffin P., 2003). Малые
эффекты (порядка 1%) пока недоступны для
обнаружения. Несомненно, что поиск генов
комплексных заболеваний и других
мультифакториальных
признаков представляет
собой весьма сложную задачу.
Среди
различных подходов, используемых в
методе картирования ЛКП, наиболее
популярным является анализ сибсовых
пар (sibpair QTL linkage analysis), принцип
которого разобран выше. Наиболее часто
используемый вариант этого метода -
модель пораженной пары (affected
sibpair design). При такой схеме исследования
оба сибсовых партнера имеют одинаковый
диагноз или крайнее выражение какого-либо
количественного признака. В среднем у
сибсов должно наблюдаться совпадение
в одном из двух аллелей (50%). Связь
тестируемого участка хромосомы с
болезнью можно предполагать, если у
пораженных болезнью (т.е. конкордантных)
сибсов совпадение аллелей будет
наблюдаться в гораздо большем проценте
случаев, чем ожидаемые 50%.
сновывается
на исследовании ДНК у пар близких
родственников, чаще всего сибсов. Идея
его очень проста. Мы уже знаем, что сибсы
имеют в среднем примерно 50% общих аллелей.
В каждой конкретной паре сибсов
совпадающие аллели будут отличаться.
Таким образом, у детей одних и тех же
родителей в данном локусе аллели
матери и отца могут представлять
различные сочетания (рис.
8.6).
Рассмотрим
ген, который имеет четыре аллеля: А, В,
С, D. Допустим, мать обладает аллелями А
и В, а отец - аллелями С и D. Каждый ребенок
может получить от матери один из ее
аллелей (А или В) и от отца - один из его
аллелей (С или D), при этом ребенок
наследует свой генотип независимо от
других детей в этой семье. Соответственно
возможны четыре различных сочетания.
Сравнение генотипов,
представленных на рисунке, показывает,
что любой ребенок в этой семье,
унаследовавший, к примеру, генотип АС,
может иметь от 0 до 2 общих аллелей с
любым из своих братьев и сестер.
Предположим, мы выявили пару сибсов,
которые имеют два общих аллеля. Эти
сибсы оказались более похожими по
какому-либо количественному признаку,
чем сибсы, имеющие один общий аллель.
Последние, в свою очередь, обнаружили
большее сходство, чем те сибсы, у которых
общих аллелей в этом локусе не было
совсем. На основании этих наблюдений,
мы можем предполагать, что этот ген
влияет на интересующий нас количественный
признак. Если разница в количестве
совпадающих аллелей никак не отражается
на количественных соотношениях признака
у сибсов, значит тестированный ген не
имеет отношения к изучаемому признаку.
Обычно при таком подходе вместо реальных
генов используются маркеры и вычисляются
корреляции между наличием маркера и
степенью выраженности количественного
признака. При анализе группы "количественных
локусов" корреляции вычисляются для
каждого из нескольких маркеров,
расположенных на определенном участке
хромосомы. Величина коэффициентов
меняется от локуса
к локусу. На основании дальнейшего
анализа определяют участок предполагаемой
локализации гена, вносящего свой вклад
в количественный признак.
В
некотором смысле метод
картирования ЛКП с
использованием пар сибсов напоминает
близнецовый метод: сибсы, у которых
совпадают оба аллеля аналогичны МЗ
близнецам (100% общих генов). Сибсы, у
которых совпадает 1 аллель аналогичны
ДЗ близнецам (50% общих генов). Сибсы, не
имеющие совпадений, аналогичны
неродственникам (0% общих генов).
Целью
картирования ЛКП является поиск не
единичного гена, определяющего сложный
признак, а скорее множественных генов,
принимающих участие в формировании
популяционной вариативности по изучаемой
характеристике. Метод картирования ЛКП
достаточно эффективен для выявления
действия так называемых главных
генов, т.е. генов, вносящих
основной вклад в формирование
количественного признака.
Предположим,
имеется ген, участие которого определяет
10% вариативности признака, кроме того,
существует еще 5 генов, каждый из которых
дает вклад в 2%, и еще 10 других генов с
вкладом в изменчивость в 1%. Если эффекты
этих ЛКП (или QTL) независимы, то все они
вместе будут определять 30% вариативности
(10 + 2•5 + 1•10 = 30). Для генов, наследуемых
по Менделю и имеющих вклад, оцениваемый
в 100%, эффект порядка 10% может показаться
весьма малым. Однако для различных
психических расстройств такой вклад
считается достаточно большим. На
сегодняшний день метод картирования
ЛКП используется для изучения
количественных признаков или заболеваний
с наследственной предрасположенностью
и обладает разрешающей способностью,
позволяющей выявлять гены с эффектом
порядка 10% (Plomin
R., McGuffin P., 2003). Малые
эффекты (порядка 1%) пока недоступны для
обнаружения. Несомненно, что поиск генов
комплексных заболеваний и других
мультифакториальных
признаков представляет
собой весьма сложную задачу.
Среди
различных подходов, используемых в
методе картирования ЛКП, наиболее
популярным является анализ сибсовых
пар (sibpair QTL linkage analysis), принцип
которого разобран выше. Наиболее часто
используемый вариант этого метода -
модель пораженной пары (affected
sibpair design). При такой схеме исследования
оба сибсовых партнера имеют одинаковый
диагноз или крайнее выражение какого-либо
количественного признака. В среднем у
сибсов должно наблюдаться совпадение
в одном из двух аллелей (50%). Связь
тестируемого участка хромосомы с
болезнью можно предполагать, если у
пораженных болезнью (т.е. конкордантных)
сибсов совпадение аллелей будет
наблюдаться в гораздо большем проценте
случаев, чем ожидаемые 50%.
8.3. Анализ ассоциаций. Метод гена-кандидата
Еще один подход к картированию ЛКП использует принцип неравновесного сцепления (linkage disequilibrium) (или ассоциации). Под неравновесным сцеплением понимаются конкретные комбинации аллелей, по которым наблюдается неслучайное распределение в исследуемой группе лиц по сравнению с общей популяцией. В связи с этим частоты этих аллелей в популяции не соответствуют ожидаемым по случайному закону. Метод анализа ассоциаций может обнаруживать ЛКП, которые отвечают за гораздо меньший процент вариативности, чем позволяет анализ обычного сцепления. Ассоциация есть корреляция между отдельными аллелями и признаками в популяции. Например, известен ген, который имеет название аполипопротеин Е (АРОЕ). Этот ген имеет аллель АРОЕ-4, частота которого у людей, пораженных болезнью Альцгеймера (с поздним проявлением) составляет 40%, в то время как в контрольной группе - всего 15%. Болезнь Альцгеймера - наследственное заболевание человека, которое характеризуется прогрессирующим нарушением памяти, утратой навыков, психотическими расстройствами, гиперкинезами и т.п. Связано с диффузной атрофией мозга. Проявляется в пожилом возрасте. АРОЕ-4 обладает значительным эффектом, но наличие этого аллеля не является решающим фактором в развитии заболевания. Оно лишь повышает его риск. При этом около трети пациентов с болезнью Альцгеймера не имеют в своем генотипе АРОЕ-4, а примерно половина тех людей, что им обладают, доживают до 80 лет, не проявляя признаков болезни (Williams, 2003; цит. по: Plomin & McGuffin, 2003). В большинстве исследований, использующих метод ассоциаций, сначала формулируется соответствующая гипотеза о влиянии какого-либо известного гена на поведенческий признак или заболевание. Этот ген называется геном-кандидатом (candidate gene). Так, в терапии депрессии и некоторых других психических заболеваний, связанных с повышенным беспокойством и тревогой, широко используются препараты, действующие на белок-переносчик серотонина в нервной системе. Этот белок является важным элементом связи между нейронами, продуцирующими серотонин. Другие исследования подтверждают, что обмен серотонина в нервной системе имеет отношение к развитию состояний тревоги и депрессии. Соответственно, ген, кодирующий белок-переносчик серотонина, рассматривается как ген-кандидат. Далее гипотеза проверяется с использованием анализа сцепления, метода ассоциаций и мутационного анализа. Вообще гены, кодирующие белки, участвующие в процессах передачи информации в нервной системе, вызывают повышенный интерес исследователей как возможные гены-кандидаты для поведенческих признаков. Например, геном-кандидатом для поведения, связанного с рисками (поиск новизны - novelty seeking), является ген, кодирующий рецептор дофамина. В ассоциативных исследованиях сопоставляется встречаемость определенного аллеля гена-кандидата в популяции в целом и у лиц, обладающих/не обладающих изучаемым типом поведения или пораженных болезнью. Если данный аллель чаще встречается у людей с выраженным поведенческим признаком (или заболеванием), чем у тех, кому оно совершенно не свойственно (или здоровых), то можно предполагать, что аллель играет определенную роль в наследственной детерминации признака. Однако полностью полагаться на результаты не следует, поскольку может случиться так, что ген-кандидат не сам регулирует поведение, а просто тесно сцеплен с тем геном, который на самом деле имеет отношение к признаку. В этом смысле на исследователях лежит определенная ответственность, поскольку они должны учесть все альтернативные возможности интерпретации получаемых результатов и только после этого делать заключение об ассоциации гена и признака.
8.4. Прямой анализ днк и выявление мутаций
Когда в результате анализа сцепления предполагаемое место гена на хромосоме определено, это означает всего лишь, что мы знаем, где находится данный ген, но этого недостаточно для того, чтобы понять механизмы изучаемого заболевания или типа поведения. Главная задача исследователей - не установить, где расположен ген, а понять, как он работает, и как факторы среды могут влиять на формирование изучаемой характеристики. До недавнего времени такая задача вообще не имела решения в рамках тех генетико-эпидемиологических подходов, которыми пользовалась психогенетика (см. предыдущую тему). Сейчас положение в корне изменилось: современные молекулярно-генетические методы позволяют непосредственно изучать тот участок молекулы ДНК, в котором расположен ген, связанный с контролем поведенческого признака. Гораздо меньшие возможности существуют пока для того, чтобы изучать, как среда влияет на работу гена. Сейчас коротко опишем некоторые методы, которые применяются при непосредственном анализе ДНК. Вначале рассмотрим некоторые основные достижения генетики последних лет, которые создали предпосылки для массового использования молекулярно-генетических методов. Осуществление проекта "Геном человека" было бы невозможно без применения методов генетической инженерии. Это направление в генетике возникло в начале 70-х гг. В его основе лежит методология конструирования и получения рекомбинантных ДНК. Рекомбинантными называются молекулы ДНК, которые получаются путем объединения in vitro (в пробирке) чужеродных фрагментов ДНК, которые в природе не встречаются. При этом применяются методы обратной транскрипции, позволяющие с помощью особого фермента (обратной транскриптазы) на основе фрагментов молекулы РНК получать комплементарные фрагменты ДНК. Напомним, что при синтезе белка с гена считывается информация в направлении ДНК —> РНК. При обратной транскрипции процесс идет в противоположном направлении. Подлинную революцию в изучении генома совершило открытие в 1983 г. полимеразной цепной реакции (ПЦР). Ее автору, К. Муллису в 1993 г. была присуждена Нобелевская премия в области биологии и медицины. Метод ПЦР позволяет тиражировать in vitro фрагменты ДНК в неограниченном количестве, при этом в качестве исходного материала достаточно минимального количества ДНК. Процесс амплификации ДНК состоит из повторяющихся циклов, каждый из которых включает три стадии: денатурации (получение одноцепочечных фрагментов ДНК), отжига (присоединение праймеров к комплементарным последовательностям одноцепочечных молекул) и синтеза (рис. 8.7). Эти и некоторые другие методы генетической инженерии лежат в основе молекулярно-генетической диагностики. Коротко остановимся на некоторых этапах молекулярно-генетических исследований.
Для начала необходимо получить образцы ДНК для анализа. Исходным материалом для получения ДНК могут служить любые клетки организма, содержащие ядро. Чаще всего используют лейкоциты периферической крови. Для одного анализа необходимо от нескольких нанограммов до нескольких микрограммов ДНК. Для получения такого количества ДНК потребуется не более 1 мл крови. Для некоторых анализов достаточно всего одной капли крови. Вся ДНК клетки называется геномной ДНК, поскольку содержит весь геном. Часто для анализа требуются не вся ДНК, а лишь определенные ее фрагменты, в которых расположены изучаемые гены.
Для проведения анализа необходимо иметь достаточное количество ДНК. Эта задача сейчас решается с помощью описанной выше полимеразной цепной реакции (ПЦР).
Необходимым этапом является также рестрикция (разрезание) ДНК под действием специальных ферментов (рестриктаз), которые способны распознавать специфические короткие (4-10 пар нуклеотидов) последовательности. Каждая рестриктаза разрезает цепь ДНК в строго определенном месте. В результате действия каждой рестриктазы образуется специфичный для нее набор фрагментов различной длины.
Далее смесь фрагментов подвергают электрофорезу в специальном геле. В зависимости от своей длины фрагменты движутся в геле с различной скоростью. По окончании электрофореза фрагменты ДНК занимают каждый определенное положение в виде полосы, однако, поскольку размер генома велик, полосы после электрофореза расположены настолько тесно, что их невозможно различить.
Чтобы выявить специфические фрагменты ДНК, проводят еще одну процедуру, которая называется блот-гибридизацией по Саузерну (рис. 8.8). Эта методика состоит из нескольких этапов и приводит к получению четкой картины фрагментов ДНК, напоминающей штрих-код (рис. 8.9).
Для обнаружения конкретных мутаций проводят секвенирование ДНК, т.е. определение точной последовательности пар нуклеотидов в ДНК. Существуют различные модификации описанных методов, однако главной целью работы в любом случае является получение максимально возможной информации о строении гена.
8.5. Моделирование на животных
Преимущества
генетических исследований на животных
очевидны - это широкие возможности для
скрещивания и отбора, контроля условий
среды, в которых развивается потомство,
отсутствие этических преград для
проведения любых манипуляций на всех
уровнях функционирования, начиная с
геномного
и кончая популяционным. Спектр возможностей
исследований человека гораздо уже.
Поэтому психогенетика
часто использует методы моделирования
на животных различных состояний,
некоторых психических заболеваний,
элементарных форм научения.
У
человека и других млекопитающих гораздо
больше общности, чем различий. Например,
число нуклеотидов
в ДНК человека и мыши составляет примерно
три миллиарда, причем более 99% генов у
них являются общими. Любое поведение
является результатом деятельности
мозга. Известно, что многие механизмы
деятельности мозга у человека и животных
также идентичны. Поэтому нет ничего
удивительного в том, что эксперименты
на животных, как на более простых
системах, позволяющих к тому же
осуществлять вмешательство в деятельность
этих систем, позволяют подойти к решению
некоторых проблем генетики поведения
человека. Вообще генетика
поведения животных является самостоятельной
областью генетики поведения, и в данной
области ведутся различные исследования,
прямым образом не связанные с генетикой
человека. Мы не будем подробно касаться
этой сферы, а упомянем лишь несколько
примеров исследований на животных,
которые способствуют пониманию проблем
генетики поведения человека. В дальнейшем,
особенно в том разделе, где речь пойдет
об индивидуальном развитии, мы еще не
раз столкнемся с модельными экспериментами,
ведущимися на животных. Воспользуемся
несколькими примерами модельных
экспериментов на животных.
Способность
к обучению. Никто не станет отрицать,
что способность к обучению присуща не
только человеку, но и животным. Эта
способность широко исследуется в
генетике поведения животных. Исследования
проводятся также в основном на инбредных
линиях крыс или мышей.
В этой области преимущество экспериментов
на животных заключается в том, что по
результатам скрещивания особей разных
линий, т.е. животных с разными
"поведенческими" генами, можно
составить представление о характере
наследования способности к обучению,
а возможность выращивать потомство в
различных условиях среды помогает
определить характер средовых влияний
на формирование способности к обучению,
что в экспериментах с человеком,
естественно, невозможно.
В
ряде экспериментов изучались различия
между линейными животными по обучению
условной реакции избегания. Животных
помещали в специальную клетку, разделенную
на два отсека. В один из отсеков подавался
электрический ток, вызывающий неприятные
ощущения. Чтобы избежать неприятного
воздействия, животное должно было
перепрыгнуть в другой, безопасный отсек
клетки. Сначала животное обучается этой
реакции, а затем перед включением тока
подается сигнал в виде вспышки света,
и животное постепенно обучается
реагировать на включение вспышки, а не
на сам ток. Показателем скорости обучения
служит число вспышек, необходимое для
формирования условной реакции избегания.
Оказалось, что инбредные линии мышей
значительно отличаются по скорости
обучения. Скрещивание линий с высокой
и низкой скоростью обучения показало,
что в основе различий лежит простой
моногенный тип наследования.
Другой
тип поведения, связанного с обучением,
- о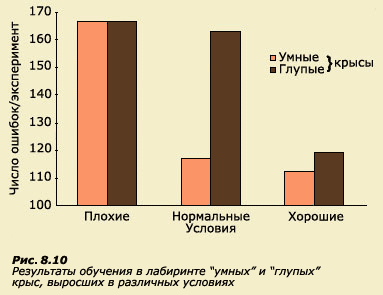 бучение
в лабиринте - в отличие от поведения
избегания, оказался подвержен не только
генетическим, но и средовым влияниям.
Чтобы добраться до кормушки, крысам
необходимо было преодолеть лабиринт.
В исходной популяции встречались
животные, которые быстро находят путь
и делают мало ошибок, и, наоборот, такие,
которые затрачивают на это много времени
и часто ошибаются. Выборочная селекция
в нескольких поколениях позволила
выделить неперекрывающиеся субпопуляции
"умных" и "глупых" животных.
Это говорит о том, что в исходной популяции
существовала заметная генетическая
изменчивость по способности к обучению
в лабиринте.
Затем
был осуществлен эксперимент, который
чрезвычайно важен для формулировки
гипотезы в отношении способности к
обучению у человека. Детенышей каждой
из линий - "умной" и "глупой"
- разделили на 3 группы. Крысята первой
группы выращивались в обычных условиях.
Детеныши из второй группы с момента
рождения были лишены тех факторов среды,
которые способствуют познавательной
или исследовательской деятельности,
т.е. росли в условиях депривации.
Третья группа крысят, наоборот, была
помещена в обогащенную среду - внутри
клетки находились трапы, зеркала, туннели
и другие приспособления, способствующие
развитию разнообразных видов активности.
Самое интересное заключается в том, что
межлинейные различия в этой ситуации
наблюдались только в группах животных,
выращиваемых в обычных условиях.
Депривированные животные обеих линий
одинаково плохо справлялись с лабиринтом,
а вот животные, росшие в сенсорно-обогащенной
среде, независимо от принадлежности к
линии, почти одинаково хорошо обучались
поведению в лабиринте (рис. 8.10). Из этого
опыта следует, что депривация в раннем
возрасте отрицательно сказывается на
способности к обучению в дальнейшем,
и, наоборот, сенсорно-обогащенная среда
может улучшить эту способность, несмотря
на существующие генетические
различия.
Подчеркнем
еще раз, что генетические различия,
заметные в одном диапазоне сред, могут
не проявиться в фенотипе
при перемещении тех же генотипов в
другой диапазон (см.
тему 4), и что генетическая
детерминации вариативности признака
не означает невозможности его изменения
путем изменения среды. Здесь же хочется
обратить внимание читателей на
гипотетический график нормы реакции
для интеллекта человека (рис.
8.11), демонстрирующий критическое
значение депривации для развития
нормального интеллекта. Так что между
генетическими исследованиями поведения
животных и человека существует множество
точек соприкосновения, и некоторые
схемы эксперимента, которые мы можем
осуществить на животных, позволяют
проверять наши гипотезы в отношении
человека.
бучение
в лабиринте - в отличие от поведения
избегания, оказался подвержен не только
генетическим, но и средовым влияниям.
Чтобы добраться до кормушки, крысам
необходимо было преодолеть лабиринт.
В исходной популяции встречались
животные, которые быстро находят путь
и делают мало ошибок, и, наоборот, такие,
которые затрачивают на это много времени
и часто ошибаются. Выборочная селекция
в нескольких поколениях позволила
выделить неперекрывающиеся субпопуляции
"умных" и "глупых" животных.
Это говорит о том, что в исходной популяции
существовала заметная генетическая
изменчивость по способности к обучению
в лабиринте.
Затем
был осуществлен эксперимент, который
чрезвычайно важен для формулировки
гипотезы в отношении способности к
обучению у человека. Детенышей каждой
из линий - "умной" и "глупой"
- разделили на 3 группы. Крысята первой
группы выращивались в обычных условиях.
Детеныши из второй группы с момента
рождения были лишены тех факторов среды,
которые способствуют познавательной
или исследовательской деятельности,
т.е. росли в условиях депривации.
Третья группа крысят, наоборот, была
помещена в обогащенную среду - внутри
клетки находились трапы, зеркала, туннели
и другие приспособления, способствующие
развитию разнообразных видов активности.
Самое интересное заключается в том, что
межлинейные различия в этой ситуации
наблюдались только в группах животных,
выращиваемых в обычных условиях.
Депривированные животные обеих линий
одинаково плохо справлялись с лабиринтом,
а вот животные, росшие в сенсорно-обогащенной
среде, независимо от принадлежности к
линии, почти одинаково хорошо обучались
поведению в лабиринте (рис. 8.10). Из этого
опыта следует, что депривация в раннем
возрасте отрицательно сказывается на
способности к обучению в дальнейшем,
и, наоборот, сенсорно-обогащенная среда
может улучшить эту способность, несмотря
на существующие генетические
различия.
Подчеркнем
еще раз, что генетические различия,
заметные в одном диапазоне сред, могут
не проявиться в фенотипе
при перемещении тех же генотипов в
другой диапазон (см.
тему 4), и что генетическая
детерминации вариативности признака
не означает невозможности его изменения
путем изменения среды. Здесь же хочется
обратить внимание читателей на
гипотетический график нормы реакции
для интеллекта человека (рис.
8.11), демонстрирующий критическое
значение депривации для развития
нормального интеллекта. Так что между
генетическими исследованиями поведения
животных и человека существует множество
точек соприкосновения, и некоторые
схемы эксперимента, которые мы можем
осуществить на животных, позволяют
проверять наши гипотезы в отношении
человека.
Алкоголизм. При изучении наследственных причин алкоголизма у человека широко используются эксперименты на мышах и крысах. Исследователям удалось путем инбридинга (близкородственного скрещивания) получить чистые линии мышей с различной потребностью в алкоголе (напомним, что все животные, принадлежащие к одной линии, имеют почти одинаковые генотипы). Мыши некоторых линий полностью избегают алкоголя, тогда как другие предпочитают в среднем до 2/3 дневной нормы жидкости получать в виде 10% раствора алкоголя. Были исследованы межлинейные различия в свойствах мозга и печени животных. Основные различия между животными, принадлежащими к контрастным линиям, выявились в двух сферах - в метаболизме алкоголя и в его воздействии на физиологию мозга. Было показано, что повышенная потребность в алкоголе сочетается с высокой чувствительностью мозга к его наркотическому действию (Хрестомат. 8.2). Эксперименты на животных позволили очертить те области, в которых необходимо было искать генетические различия между людьми - это метаболизм алкоголя, т.е. комплекс его превращений в организме, и нейрофизиологические реакции на алкоголь. В исследованиях на близнецах было обнаружено существенное генетическое влияние на метаболизм алкоголя, а в нейрофизиологических экспериментах с регистрацией электроэнцефалограммы (ЭЭГ) было показано, что лица, склонные и не склонные к потреблению алкоголя, имеют разный характер ЭЭГ и разную ее реактивность на введение алкоголя. Оказалось, что родственники алкоголиков, не страдающие алкоголизмом, имели похожий характер биоэлектрической активности мозга, а МЗ близнецы, в отличие от ДЗ, демонстрировали высокое сходство по реактивности ЭЭГ на алкоголь. Все эти эксперименты позволили заключить, что некоторые особенности метаболизма и характер чувствительности нервной системы к алкоголю являются генетически обусловленными причинами различий между людьми в склонности к потреблению алкоголя. Возникновение же алкоголизма как болезни, со всем комплексом поведенческих и личностных расстройств, определяется в основном внешними обстоятельствами, т.е. средой. В обществе, где алкоголь доступен и традиционно является одним из элементов среды при общении людей, генетически восприимчивый к алкоголю человек имеет больше шансов заболеть алкоголизмом. Помимо способности к обучению и алкоголизма на животных моделируются агрессивность, склонность к беспокойству и страху, а также такие заболевания человека, как эпилепсия и болезнь Альцгеймера (Хрестомат. 8.3 и 8.4). С развитием генной инженерии стали появляться принципиально новые возможности исследований эффектов единичных генов. В последние годы все чаще исследуются так называемые трансгенные мыши и мыши-нокауты. Разработаны методы внедрения в геном чужеродного гена (трансгенные мыши) и выключения (нокаута) одного из естественных генов. При нокауте один из нормальных генов полностью инактивирован. Нокаут напоминает прием, используемый в нейрофизиологии для изучения последствий удаления отдельных областей мозга. В случае генного нокаута изучаются последствия удаления отдельного гена, т.е. фактически последствия лишения организма того генного продукта, который вырабатывается на основе изучаемого гена. Оба метода сложны в осуществлении. Работа ведется в несколько этапов, которые включают клонирование нужного гена в бактериях, работу с генной ДНК, внедрение измененной ДНК в эмбриональные клетки на ранних стадиях развития, различные ухищрения для отбора нужных клеток, в которых произошла инактивация гена или, наоборот, был внедрен "чужой" ген, последовательные скрещивания для получения поколения мышей с нужным геномом. В дальнейшем это потомство тщательно исследуется для выявления морфологических, физиологических и поведенческих нарушений, являющихся последствиями вмешательства. К сожалению, такие методически сложные процедуры нередко заканчиваются лишь констатацией наличия плейотропного эффекта действия гена. Плейотропный, или множественный, эффект означает, что генный продукт может быть включен в столь важные процессы метаболизма, что они существенно влияют на самые разнообразные признаки, в том числе и на поведение. Однако уже сейчас получены первые результаты, демонстрирующие, что утеря некоторых важных биохимических субстанций в нервной клетке в связи с нокаутом или внедрение новых генов могут вызывать специфические изменения поведения (Хрестомат. 8.5). Еще один интересный факт заслуживает внимания. Не так давно исследователи генетики поведения животных провели своеобразные "эксперименты-близнецы". В трех независимых лабораториях (в штатах Орегон и Нью Йорк в США и в штате Альберта в Канаде) были выполнены идентичные исследования. В каждой из лабораторий ученые постарались максимально уравнять все генетические и средовые переменные: выбрали генетически идентичные линии животных (мышей), применили одну и ту же схему эксперимента, максимально контролировали все условия среды (питание животных, световой режим, время проведения тестирования и т.п.). Однако, несмотря на это, ни в одной из лабораторий не удалось получить полностью совпадающих результатов. Этот факт свидетельствует о том, что существует множество средовых эффектов и случайностей, которые трудно уравнять, например, запахи в лабораториях. Среда оказывается настолько вариабельной, что не поддается полному контролю. Этот эксперимент продемонстрировал, что даже незначительные различия в среде могут приводить к заметным изменениям в поведении. Тем более важно это учитывать в исследованиях, проводимых на человеке.
Выводы
8.1. Геномика и психогенетика
Геномом называется полный состав ДНК клетки.
Геномика - это молодая интенсивно развивающаяся отрасль генетики, изучающая принципы построения геномов и их структурно-функциональную организацию.
Структурная геномика изучает нуклеотидные последовательности ДНК, в том числе строение и локализацию генов. Одной из задач структурной геномики является построение генетических карт организмов.
Функциональная геномика решает задачи идентификации функций отдельных участков генома и механизмы их взаимодействий в клеточном ансамбле.
Современные представления о геноме человека базируются на нескольких открытиях молекулярной биологии 70-х годов ХХ века, основными из которых являются открытие полимеразной цепной реакции (ПЦР), позволяющей получать достаточное количество ДНК для анализа, и разработка методов секвенирования, которые позволяют расшифровывать точную последовательность нуклеотидов в цепях ДНК.
В конце 80-х годов ХХ столетия началось осуществление международного проекта "Геном человека", основной задачей которого было секвенирование генома человека. Полное секвенирование генома человека было завершено в 2000 году.
Секвенирование генома человека привело к открытию огромного количества однонуклеотидных полиморфизмов (ОНП) - генетических вариантов последовательностей нуклеотидов одного и того же участка ДНК у разных людей. Распределенные по всему геному ОНП используются в качестве генетических маркеров.
По расчетам генетиков люди оказываются идентичными по нуклеотидным последовательностям на 99,9%. Таким образом, генетическая вариативность людей возникает за счет различий лишь в 0,1% генома.
Данные секвенирования показали, что в геноме человека чуть более 30000 генов. Большинство генов имеют размеры до 50000 пар нуклеотидов. Число синтезируемых белковых продуктов превышает число генов в 1,5-2 раза. Это является результатом альтернативного сплайсинга.
В современной психогенетике используются три основных подхода к изучению поведенческой геномики: анализ сцепления, анализ ассоциаций, непосредственный анализ ДНК (секвенирование и идентификация мутаций).
8.2. Анализ сцепления
Классический вариант анализа сцепления использован на использовании явления кроссинговера. В процессе кроссинговера гены, расположенные в одной хромосоме (сцепленные), рекомбинируют тем чаще, чем дальше они отстоят друг от друга. Т.Морган в начале ХХ века предложил использовать явление сцепления для создания генетических карт, т.е. схем расположения конкретных генов на конкретных хромосомах.
Для локализации гена на хромосоме необходим маркер, т.е. ген, локализация которого известна, либо морфологический или молекулярный маркер.
При анализе сцепления мерой "генетического расстояния" служит частота рекомбинации между маркером и исследуемым геном. Расстояние между генами измеряется в сантиморганидах (сМ). Одна сантиморганида соответствует расстоянию между генами, рекомбинация которых происходит с частотой 1%. При частоте рекомбинации 50% считается, что гены наследуются независимо.
Классический анализ сцепления чаще всего используется для локализации генов альтернативных (качественных) признаков. Для количественных признаков используется несколько иная модель картирования.
Локусы количественных признаков (ЛКП) - это полигенные системы, обеспечивающие непрерывную вариативность признака в популяции.
Метод картирования ЛКП основан на исследовании ДНК у пар близких родственников (чаще всего сибсов). Идея метода состоит в том, что любой ребенок в семье может иметь от 0 до 2 общих аллелей с любым из своих братьев и сестер. Если разница в количестве совпадающих аллелей никак не сказывается на количественных соотношениях признака у сибсов, значит тестируемый ген не имеет отношения к признаку. Соответственно, обратная картина говорит о причастности гена к детерминации изучаемого признака.
Целью картирования ЛКП является поиск не единичного гена, а, скорее, групп генов, принимающих участие в формировании популяционной вариативности по количественному признаку. Метод картирования ЛКП эффективен для выявления эффектов главных генов, вносящих основной вклад в формирование количественного признака.
