
- •Содержание
- •1. Введение.
- •1.1 Общие закономерности химических процессов. Классификация процессов общей химико-технологических процессов
- •Требования к химическим производствам
- •Компоненты химического производства
- •Разделение на две твердые фазы:
- •Разделение жидкости и твердого вещества:
- •1.2 Промышленный катализ
- •Основные положения теории катализа.
- •1.3. Сырьевая база химической промышленности.
- •Классификация сырья
- •Характеристика минерального сырья
- •Химическое сырье
- •Растительное и животное сырье
- •Характеристика разработок минерального сырья
- •Качество сырья и методы его обработки
- •Способы сортировки:
- •Способы обогащения:
- •Сырьевая база химических производств
- •1.4 Энергетическая база химических производств
- •1.5 Критерии оценки эффективности производства
- •1.5.1. Интегральные уравнения баланса материальных потоков в технологических процессах. Понятие о расходных коэффициентах. Относительный выход продукта
- •1.5.2. Балансы производства
- •1. Материальный баланс
- •2. Энергетический (тепловой) баланс
- •3. Экономический баланс
- •1.5.3. Технологические параметры химико-технологических процессов.
- •1.6.Принципы создания ресурсосберегающих технологий
- •2. Теоретические основы химической технологии
- •2.1. Энергия в химическом производстве. Тепловой эффект реакции в технологических расчетах. Направленность реакции в технологических расчетах
- •2.2 Массообменные процессы. Основные принципы массообменных процессов. Моделирование процессов теплообмена.
- •Молекулярная диффузия. Первый закон Фика
- •Турбулентная диффузия
- •Уравнение массоотдачи
- •Уравнение массопередачи
- •Связь коэффициента массопередачи и коэффициентов массоотдачи (или уравнение аддитивности фазовых сопротивлений)
- •Подобие массобменных процессов
- •3. Химическое производство как сложная система. Иерархическая организация процессов в химическом производстве
- •3.1. Химико-технологические системы (хтс). Элементы хтс. Структура и описание хтс. Методология исследования хтс, синтез и анализ хтс.
- •Методология исследование химико-технологических систем.
- •3.2. Сырьевая и энергетическая подсистема хтс
- •1. Классификация химических реакторов по гидродинамической обстановке.
- •2. Классификация химических реакторов по условиям теплообмена.
- •3. Классификация химических реакторов по фазовому составу реакционной массы.
- •4. Классификация по способу организации процесса.
- •5. Классификация по характеру изменения параметров процесса во времени.
- •6. Классификация по конструктивным характеристикам.
- •3.4. Промышленные химические реакторы. Реакторы для гомогенных процессов, гетерогенных процессов с твердой фазой, гетерогенно-каталитических процессов, гетерофазных процессов.
- •Реакторы для гетерогенных процессов с твердой фазой.
- •Реакторы для гетерогенно-каталитических процессов.
- •4. Основные математические модели процессов в химических реакторах
- •4.1. Идеальные химические реакторы. Непрерывный реактор идеального вытеснения. Непрерывный реактор идеального смешения
- •4.2. Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения. Обоснование использования каскада реакторов.
- •Каскад реакторов смешения.
- •Влияние степени конверсии.
- •Влияние температуры.
- •5. Применение кинетических моделей для выбора и оптимизации условий проведения процессов
- •5.1. Экономические критерии оптимизации и их применение для оптимизации реакционных узлов.
- •Оптимальные концентрации инициатора и температуры в радикально-цепных реакциях
- •Оптимизация степени конверсии.
- •7. Важнейшие промышленные химические производства
- •7.1 Проблема фиксации атмосферного азота. Синтез аммиака, Физико-химические основы производства и обоснование выбора параметров и типа реакционного узла. Технологическая схема процесса.
- •Синтез аммиака
- •Сырье для синтеза аммиака.
- •Технология процесса.
- •Основные направления в развитии производства аммиака.
- •7.2. Получение азотной кислоты. Физико-химические основы химических стадий процесса, обоснование выбора параметров и типа реакторов. Технологическая схема процесса.
- •Физико-химические основы процесса.
- •Контактное окисление аммиака.
- •Обоснование роли параметров и их выбор.
- •Окисление оксида азота (II) до диоксида.
- •Абсорбция диоксида азота.
- •Технология процесса.
- •7.3. Производство минеральных удобрений. Классификация минеральных удобрений
- •Классификация минеральных удобрений.
- •7.3.1. Азотные удобрения. Физико-химические основы производства нитрата аммония. Устройство реакционного узла. Теоретические основы процесса и его технологическое оформление
- •Производство нитрата аммония.
- •7.3.2. Производство фосфорной кислоты. Физико-химические основы процесса. Технологическая схема
- •Функциональная схема производства эфк.
- •Сернокислотное разложение апатита.
- •7.3.3. Фосфорные удобрения. Физико-химические основы процессов их производства. Типы реакционных узлов.
- •Производство простого суперфосфата.
- •Производство двойного суперфосфата
- •Азотнокислое разложение фосфатов. Получение сложных удобрений
- •Обжиг серосодержащего сырья.
- •Обоснование роли параметров и их выбор.
- •Сжигание серы.
- •Окисление диоксида серы.
- •Обоснование роли параметров и их выбор.
- •Технология контактного окисления so2.
- •Абсорбция триоксида серы.
- •Перспективы развития сернокислотных производств.
- •7.5. Электрохимические производства. Теоретические основы электролиза водных растворов и расплавленных сред. Технология электролиза раствора хлорида натрия.
- •Основные направления применения электрохимических производств
- •Электролиз раствора хлорида натрия
- •Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой
- •Электролиз раствора хлорида натрия с ртутным катодом
- •7.6. Промышленный органический синтез
- •Первичная переработка нефти.
- •Каталитический риформинг углеводородов.
- •7.6.2. Производство этилбензола и диэтилбензола. Теоретические основы процесса и обоснование выбора условий процесса. Технология процесса
- •7.6.3. Синтезы на основе оксида углерода. Производство метанола. Теоретические основы процесса.
- •Окисление изопропилбензола (кумола)
- •Технологическая схема получения фенола и ацетона кумольным способом.
- •7.6.5. Биохимические производства. Особенности процессов биотехнологии.
- •7.6.5.1. Производство уксусной кислоты микробиологическим синтезом
- •7.6.5.2. Производство пищевых белков
- •8. Химико-технологические методы защиты окружающей среды
- •8.1. Утилизация и обезвреживание твердых отходов
- •8.2. Утилизация и обезвреживание жидких отходов
- •8.3. Обезвреживание газообразных отходов
Электролиз раствора хлорида натрия
Электролиз раствора NaCl – наиболее простой и экономичный метод одновременного получения трех важнейших химических продуктов – хлора, водорода и гидроксида натрия с использованием дешевого и доступного природного сырья. Это самое крупномасштабное электрохимическое производство. Суммарная реакция в электролизере может быть выражена уравнением
![]()
Хлор применяют в больших масштабах как сырье для производства хлорорганических растворителей и пластмасс, синтетических каучуков, химических волокон, ядохимикатов. В металлургии хлор применяется для хлорирующего обжига руд, в текстильной и целлюлозно-бумажной промышленности – для очистки и отбеливания целлюлозы, бумажной массы и тканей. Большие количества хлора идут на очистку и стерилизацию сточных вод и питьевой воды.
Гидроксид натрия используется в производстве многих химических продуктов, прежде всего в промышленном органическом синтезе, в целлюлозно-бумажном производстве, в производстве искусственных волокон, в металлургии (производство алюминия), в нефтехимической промышленности и др.
О значении водорода как топлива будущего и химическом реагенте говорилось раньше.
Электролиз раствора NaCl осуществляется двумя методами, различными по характеру электродных процессов и по аппаратурному оформлению:
электролиз с твердым катодом и фильтрующей диафрагмой;
электролиз без диафрагмы с жидким ртутным катодом.
Газообразные продукты – хлор и водород при любом способе отличаются высокой чистотой. При электролизе с ртутным катодом и третий продукт – раствор гидроксида натрия имеет высокую концентрацию NaOH и является химически чистым. Благодаря чистоте получаемых продуктов, простому и компактному аппаратурному оформлению, а также одностадийности процесс электролиза раствора NaCl является единственным в мире способом производства хлора и основным способом получения гидроксида натрия.
Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой
При реализации этого процесса на катоде в соответствии с значениями электродных потенциалов протекают следующие процессы:
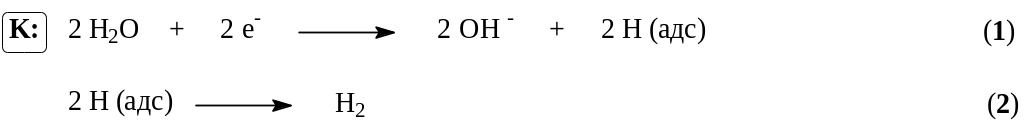
Материалами для катода служит сталь, на которой водород выделяется с относительно невысоким перенапряжением (0,3 В). В реальных условиях электролиза (концентрированный раствор NaCl, содержащий NaOH, температура 90С) фактический потенциал выделения водорода составляет около – 0,845 В. Снижение потенциала до 0,3 – 0,4 В можно достичь применением пористых графитовых катодов, для упрочнения и гидрофобизации пропитанных политетрафторэтиленом и активированных солями меди или серебра.
Накапливающиеся в катодном пространстве гидроксид-ионы образуют нейтральные молекулы гидроксида натрия
![]()
На аноде выделяется хлор:
![]()
Материалом анода служит оксидно-рутениевая система (композиция из оксидов рутения и титана, нанесенных на титановую основу), обладающая прочностью и химической инертность по отношению к кислороду являющемуся побочным продуктом, образующемся на аноде:
![]()
Кроме того, в объеме электролита анодного пространства в результате гидролиза хлора идут побочные химические реакции:
![]()
![]()
![]()
Образующийся в результате этой последовательной реакции гипохлорит анион претерпевает анодное окисление
![]()
Побочные реакции снижают выход по току основных продуктов и повышают расходные коэффициенты по энергии. Поэтому условия электролиза и концентрация электролитов должны обеспечивать минимальное протекание побочных реакций и достижение максимального выхода по току целевых продуктов. Для этого электролиз реализуют в электролизерах непрерывного действия с вертикальными фильтрующими диафрагмами при противотоке движения электролита и OH –ионов. Схема электролизера представлена на рис. 1.
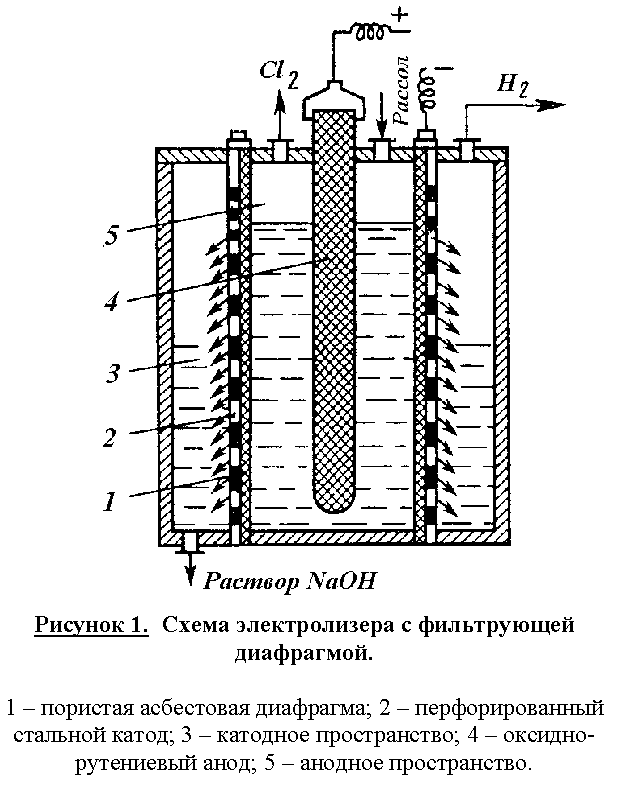
Корпус ванны в этой конструкции разделен на катодное и анодное пространства пористой диафрагмой из асбеста, модифицированного полимерными веществами. Диафрагма плотно прилегает к перфорированному стеклянному катоду. В современных электролизерах катоды имеют гребенчатую разветвленную форму с целью развития поверхности. В анодном пространстве расположен оксидно-рутениевый анод. Очищенный рассол подают в анодное пространство и вследствие гидростатического давления он фильтруется через диафрагму и катод в катодное пространство. Из катодного пространства непрерывно отводят водород и раствор гидроксида натрия, а из анодного – хлор. В образующемся хлор-газе содержится 95 – 96% Cl2. Хлор-газ охлаждают до 20С (при этом конденсируется вода) и дополнительно сушат промывкой концентрированной серной кислотой. Катодный продукт – раствор гидроксида натрия содержит 120 – 140 г/л NaOH и 170 – 180 г/л неразложившегося NaCl. Раствор выпаривают, при этом NaCl переходит в твердую фазу, т.к. его растворимость резко снижается с увеличением концентрации NaOH. После выпарки и плавки щелоков получают безводны гидроксид натрия, содержащий 92 – 95% NaOH и 2 – 4% NaCl.
Благодаря противотоку электролита и ионов OH -, последние практически не попадают в анодное пространство и побочные реакции (5), (7) – (9), за которые они ответственны, предельно минимизированы.
