
- •Содержание
- •1. Введение.
- •1.1 Общие закономерности химических процессов. Классификация процессов общей химико-технологических процессов
- •Требования к химическим производствам
- •Компоненты химического производства
- •Разделение на две твердые фазы:
- •Разделение жидкости и твердого вещества:
- •1.2 Промышленный катализ
- •Основные положения теории катализа.
- •1.3. Сырьевая база химической промышленности.
- •Классификация сырья
- •Характеристика минерального сырья
- •Химическое сырье
- •Растительное и животное сырье
- •Характеристика разработок минерального сырья
- •Качество сырья и методы его обработки
- •Способы сортировки:
- •Способы обогащения:
- •Сырьевая база химических производств
- •1.4 Энергетическая база химических производств
- •1.5 Критерии оценки эффективности производства
- •1.5.1. Интегральные уравнения баланса материальных потоков в технологических процессах. Понятие о расходных коэффициентах. Относительный выход продукта
- •1.5.2. Балансы производства
- •1. Материальный баланс
- •2. Энергетический (тепловой) баланс
- •3. Экономический баланс
- •1.5.3. Технологические параметры химико-технологических процессов.
- •1.6.Принципы создания ресурсосберегающих технологий
- •2. Теоретические основы химической технологии
- •2.1. Энергия в химическом производстве. Тепловой эффект реакции в технологических расчетах. Направленность реакции в технологических расчетах
- •2.2 Массообменные процессы. Основные принципы массообменных процессов. Моделирование процессов теплообмена.
- •Молекулярная диффузия. Первый закон Фика
- •Турбулентная диффузия
- •Уравнение массоотдачи
- •Уравнение массопередачи
- •Связь коэффициента массопередачи и коэффициентов массоотдачи (или уравнение аддитивности фазовых сопротивлений)
- •Подобие массобменных процессов
- •3. Химическое производство как сложная система. Иерархическая организация процессов в химическом производстве
- •3.1. Химико-технологические системы (хтс). Элементы хтс. Структура и описание хтс. Методология исследования хтс, синтез и анализ хтс.
- •Методология исследование химико-технологических систем.
- •3.2. Сырьевая и энергетическая подсистема хтс
- •1. Классификация химических реакторов по гидродинамической обстановке.
- •2. Классификация химических реакторов по условиям теплообмена.
- •3. Классификация химических реакторов по фазовому составу реакционной массы.
- •4. Классификация по способу организации процесса.
- •5. Классификация по характеру изменения параметров процесса во времени.
- •6. Классификация по конструктивным характеристикам.
- •3.4. Промышленные химические реакторы. Реакторы для гомогенных процессов, гетерогенных процессов с твердой фазой, гетерогенно-каталитических процессов, гетерофазных процессов.
- •Реакторы для гетерогенных процессов с твердой фазой.
- •Реакторы для гетерогенно-каталитических процессов.
- •4. Основные математические модели процессов в химических реакторах
- •4.1. Идеальные химические реакторы. Непрерывный реактор идеального вытеснения. Непрерывный реактор идеального смешения
- •4.2. Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения. Обоснование использования каскада реакторов.
- •Каскад реакторов смешения.
- •Влияние степени конверсии.
- •Влияние температуры.
- •5. Применение кинетических моделей для выбора и оптимизации условий проведения процессов
- •5.1. Экономические критерии оптимизации и их применение для оптимизации реакционных узлов.
- •Оптимальные концентрации инициатора и температуры в радикально-цепных реакциях
- •Оптимизация степени конверсии.
- •7. Важнейшие промышленные химические производства
- •7.1 Проблема фиксации атмосферного азота. Синтез аммиака, Физико-химические основы производства и обоснование выбора параметров и типа реакционного узла. Технологическая схема процесса.
- •Синтез аммиака
- •Сырье для синтеза аммиака.
- •Технология процесса.
- •Основные направления в развитии производства аммиака.
- •7.2. Получение азотной кислоты. Физико-химические основы химических стадий процесса, обоснование выбора параметров и типа реакторов. Технологическая схема процесса.
- •Физико-химические основы процесса.
- •Контактное окисление аммиака.
- •Обоснование роли параметров и их выбор.
- •Окисление оксида азота (II) до диоксида.
- •Абсорбция диоксида азота.
- •Технология процесса.
- •7.3. Производство минеральных удобрений. Классификация минеральных удобрений
- •Классификация минеральных удобрений.
- •7.3.1. Азотные удобрения. Физико-химические основы производства нитрата аммония. Устройство реакционного узла. Теоретические основы процесса и его технологическое оформление
- •Производство нитрата аммония.
- •7.3.2. Производство фосфорной кислоты. Физико-химические основы процесса. Технологическая схема
- •Функциональная схема производства эфк.
- •Сернокислотное разложение апатита.
- •7.3.3. Фосфорные удобрения. Физико-химические основы процессов их производства. Типы реакционных узлов.
- •Производство простого суперфосфата.
- •Производство двойного суперфосфата
- •Азотнокислое разложение фосфатов. Получение сложных удобрений
- •Обжиг серосодержащего сырья.
- •Обоснование роли параметров и их выбор.
- •Сжигание серы.
- •Окисление диоксида серы.
- •Обоснование роли параметров и их выбор.
- •Технология контактного окисления so2.
- •Абсорбция триоксида серы.
- •Перспективы развития сернокислотных производств.
- •7.5. Электрохимические производства. Теоретические основы электролиза водных растворов и расплавленных сред. Технология электролиза раствора хлорида натрия.
- •Основные направления применения электрохимических производств
- •Электролиз раствора хлорида натрия
- •Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой
- •Электролиз раствора хлорида натрия с ртутным катодом
- •7.6. Промышленный органический синтез
- •Первичная переработка нефти.
- •Каталитический риформинг углеводородов.
- •7.6.2. Производство этилбензола и диэтилбензола. Теоретические основы процесса и обоснование выбора условий процесса. Технология процесса
- •7.6.3. Синтезы на основе оксида углерода. Производство метанола. Теоретические основы процесса.
- •Окисление изопропилбензола (кумола)
- •Технологическая схема получения фенола и ацетона кумольным способом.
- •7.6.5. Биохимические производства. Особенности процессов биотехнологии.
- •7.6.5.1. Производство уксусной кислоты микробиологическим синтезом
- •7.6.5.2. Производство пищевых белков
- •8. Химико-технологические методы защиты окружающей среды
- •8.1. Утилизация и обезвреживание твердых отходов
- •8.2. Утилизация и обезвреживание жидких отходов
- •8.3. Обезвреживание газообразных отходов
1.2 Промышленный катализ
Катализаторы – это вещества, которые изменяют скорость химической реакции, но не входят в состав продуктов реакции. Явление изменения скорости химической реакции под действием катализатора называют катализом.
Катализатор, как правило, ускоряет реакцию (положительный катализ). Вещества, в присутствии которых реакция замедляется (отрицательный катализ), называют ингибиторами.
Действие катализатора основано на том, что он образует с реагентами промежуточные соединения и направляет процесс по иному реакционному пути.
Основные положения теории катализа.
1) Катализ применим для изменения скорости только термодинамически возможных процессов (для каталитических реакций G<0).
2) Катализаторы изменяют механизм реакции, направляя её по пути с меньшей энергией активации, что и приводит к увеличению скорости процесса.
Например, реакция разложения перекиси водорода ускоряется в присутствии сульфата железа (II) в 105 раз, а под действием фермента каталазы – в 1010 раз, что связано с соответствующим уменьшением энергии активации процесса:
2H2O2 2H2O + O2 Еакт=75 кДж/моль
2H2O2 [Fe2+];(((( 2H2O + O2 Еакт=40 кДж/моль
2H2O2 [каталаза];(((( 2H2O + O2 Еакт = 7 кДж/моль
3) Катализатор не влияет на тепловой эффект процесса.
4) Катализатор не влияет на положение химического равновесия, так как в равной степени ускоряет прямую и обратную реакции, сокращая тем самым время достижения равновесия.
5) Катализаторы действуют селективно, т. е. ускоряют одни процессы и не влияют на протекание других.
Так, из этанола в зависимости от катализатора и условий проведения реакции можно получить до 40 разных продуктов, например:
C2H5OH [Al2O3];350-360 C;(((((( C2H4 + H2O
C2H5OH [Cu];200-250 C;((((((( CH3CHO + H2
В отсутствие катализатора обе реакции протекают параллельно.
зависимости от фазового состояния катализатора и реагентов различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагенты находятся в одной фазе.
При гетерогенном катализе катализатор образует отдельную фазу, на поверхности которой протекает каталитическая реакция.
Механизм гомогенного катализа основан на образовании катализатором и реагентами в той же фазе реакционноспособных промежуточных соединений. В результате каталитическая реакция протекает по новому механизму, который складывается из элементарных стадий с меньшими энергиями активации, чем некаталитическая реакция, например (см. рис.1):
в отсутствие катализатора
А В Еакт=Е1
в присутствии катализатора К
 А [K];(( В
А [K];(( В
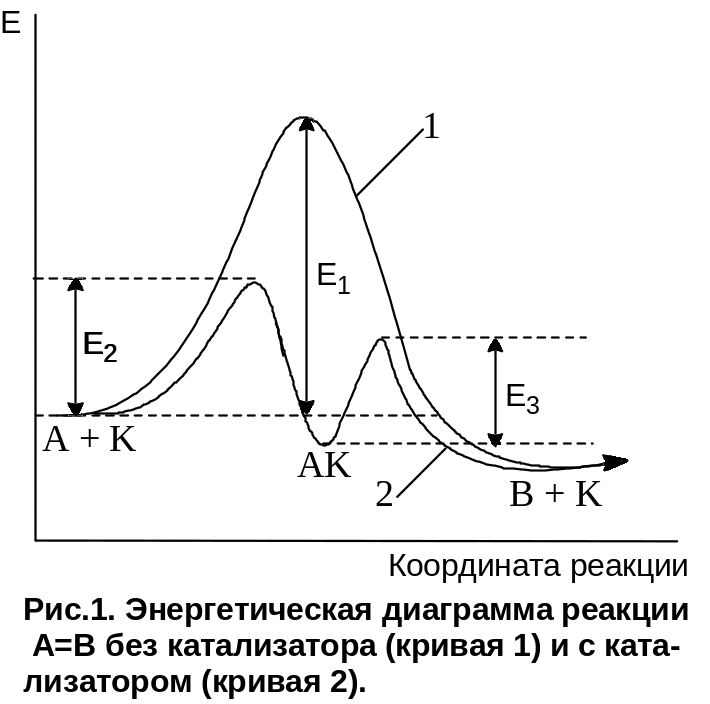 1 стадия А + К
АК Еакт=Е2
1 стадия А + К
АК Еакт=Е2
2 стадия АК В + К Еакт=Е3.
Примером гомогенной каталитической реакции может служить разложение ацетальдегида в присутствии паров иода:
без катализатора
CH3CHO(г) CH4(г) + CO(г) Еакт=190 кДж/моль
в присутствии катализатора
CH3CHO(г) [I2];(((CH4(г) + CO(г) Еакт= 136 кДж/моль

1 стадия CH3CHO + I2 CH3I + HI + CO
2 стадия CH3I + HI CH4 + I2
В качестве гомогенных катализаторов используют кислоты, основания, комплексные соединения переходных металлов. Примером гомогенного катализа является ферментативный катализ.
Механизм гетерогенного катализа более сложен и включает несколько последовательных стадий:
диффузия реагентов к поверхности катализатора;
активированная адсорбция реагентов на поверхности катализатора, в результате которой происходит сближение реакционных центров и повышение их активности под действием силового поля поверхностных атомов катализатора и, как следствие, понижение энергии активации;
химическое взаимодействие;
десорбция продуктов каталитической реакции с поверхности катализатора;
отвод продуктов от поверхности катализатора путем диффузии.
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора связано с понижением энергии активации, которое происходит за счет образования реагирующими веществами промежуточных поверхностных соединений на активных участках катализатора. Например, энергия активации реакции 2NH3 N2 + 3H2 в присутствии платинового катализатора уменьшается с 330 до 160 кДж/моль.
Катализаторами для гетерогенного катализа служат металлы (Pt, Pd, Ni, Fe, Co), оксиды металлов (Al2O3, V2O5, MnO2, Cr2O3, MoO3), сульфиды металлов (MoS2, CoS).
